修回日期: 2008-06-14
接受日期: 2008-06-19
在线出版日期: 2008-07-28
目的: 探讨食管鳞状细胞癌组织中垂体肿瘤转化基因(PTTG)和碱性成纤维细胞生长因子(bFGF)的表达和相关性.
方法: 采用免疫组化S-P法检测PTTG和bFGF在48例食管鳞状细胞癌组织和癌旁正常食管组织中的表达情况.
结果: 48例食管癌组织中PTTG和bFGF的阳性表达率显著高于癌旁正常食管组织中的表达(68.8% vs 9.1%, 70.8% vs 14.3%, P = 0.023, 0.018), PTTG和bFGF的表达均与淋巴结转移、TNM分期显著相关, 与患者年龄、性别、瘤体大小和肿瘤组织分化程度无相关性; PTTG和bFGF的表达呈正相关(r = 0.627, P = 0.012).
结论: PTTG和bFGF的表达与食管癌的临床病理学特征密切相关, 二者的检测将助于食管癌的诊断、评估食管癌患者的恶性程度和预后.
引文著录: 林称意, 郭家龙, 左顺庆, 张军, 谢斌生. 食管鳞状细胞癌中PTTG和bFGF的表达与临床病理因素的关系. 世界华人消化杂志 2008; 16(21): 2399-2403
Revised: June 14, 2008
Accepted: June 19, 2008
Published online: July 28, 2008
AIM: To investigate the expression of pituitary tumor transforming gene (PTTG) and basic fibroblast growth factor (bFGF) and their correlations with the clinical pathological features in esophageal squamous cell carcinoma (ESCC).
METHODS: Immunohistochemical S-P method was used to detect the expression of PTTG and bFGF proteins in 48 ESCC tissues and the corresponding para-cancerous normal tissues.
RESULTS: The positive rates of PTTG and bFGF expression were significantly higher in ESCC tissues than that in the para-cancerous tissues (68.8% vs 9.1%; 70.8% vs 14.3%; P = 0.023, 0.018). The expression levels of PTTG and bFGF were correlated with lymph node metastasis and TNM staging, but not with the age and sex of patients, tumor size and histological grades. Meanwhile, there was a positive correlation between PTTG and bFGF expression (r = 0.627, P = 0.012).
CONCLUSION: PTTG and bFGF expression have close relations with the clinical pathophysiological characteristics in ESCC. Detection of PTTG and bFGF may be valuable for diagnosing ESCC and evaluating its malignant extent and prognosis.
- Citation: Lin CY, Guo JL, Zuo SQ, Zhang J, Xie BS. Correlation of pituitary tumor transforming gene and basic fibroblast growth factor expression with clinicopathologic factors in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2399-2403
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2399.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2399
食管癌为我国最常见的恶性肿瘤之一, 在某些地区位于发病率和死亡率的首位[1-2]. 垂体肿瘤转化基因(pituitary tumor transforminggene, PTTG)是新近发现的一种癌基因, 可通过多条途径参与肿瘤的病理过程, 与多种肿瘤的发生、迁移与转移均有关系[3-6], 是一种强有力的肿瘤转化基因[7-10]. 血管新生是肿瘤生长和转移过程中一个关键限速步骤, 碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)作为一种细胞丝裂原和促血管生成因子, 是发动肿瘤血管新生的主要活化因子之一, 在许多肿瘤的生长中起着重要的作用[11-16]. 有关PTTG与bFGF在食管癌组织中的表达, 及其与食管癌生物学特征的相关性至今报道较少. 为此, 我们应用免疫组化S-P法对组织中PTTG、bFGF两种蛋白进行检测和分析, 探讨二者的相关性及其与食管癌临床病理特征的联系, 以期对临床工作有一定的指导意义.
收集我院2004-2005年病理科存档的48例手术切除的食管癌组织标本, 同时边缘有癌旁正常食管组织, 所有标本均为100 g/L甲醛固定,石蜡包埋, 有完整的临床资料. 其中男性30例, 女性18例, 年龄60岁以下22例, 60岁以上(含60岁)26例. 瘤体直径<5者31例, ≥5者17例. 分化程度包括高分化、中分化33例, 低分化15例. 16例证明有淋巴结转移, 32例没有转移. 所有病例均按照国际抗癌联盟(UICC)的标准(1987)进行病理分期, 包括Ⅰ期、Ⅱ期33例, Ⅲ期15例. 所有患者术前均未接受化疗、放疗及其他特殊治疗. 兔抗人PTTG多克隆抗体和兔抗人bFGF多克隆抗体、SP试剂盒及DAB显色剂均购自北京中杉金桥生物技术有限公司(原北京中山生物技术有限公司). 即用型S-P试剂盒(北京中杉生物公司), DAB染色试剂盒(北京博奥森生物公司)等.
1.2.1 免疫组化方法: 采用免疫组化法检测PTTG和bFGF在食管癌及癌旁正常食管组织中的表达情况. 具体操作步骤简述如下: 标本蜡块重新制备成4 μm连续切片, 微波修复抗原,二甲苯去蜡10 min(2次), 梯度酒精逐级水化. 柠檬酸缓冲液(pH6.0)95℃修复10 min: 3% H2O2室温孵育10 min, 磷酸盐缓冲液(PBS)冲洗后滴加非免疫性动物血清室温孵育15 min, 加一抗(抗PTTG抗体1:100, 抗 bFGF抗体 1:100), 4℃孵育过夜; PBS冲洗后滴加生物素标记二抗37℃孵育10 min, 辣根过氧化物酶标记抗生物素三抗37℃孵育15 min, PBS冲洗后DAB显色, 冲洗, 苏木精复染, 封片, 显微镜观察并拍照. 免疫组化染色程序严格按照试剂盒说明书进行操作, 用已知的阳性垂体瘤切片为阳性对照, 用PBS液(0.01 mol/L, pH7.4)代替一抗作阴性对照.
1.2.2 结果判定: 参照Bresalier et al[17]半定量法判断食管癌组织中PTTG和bFGF的表达情况. 出现棕黄色颗粒为阳性表达. 在光学显微镜下每张切片随机选取5个视野(×400), 每个视野计数100个细胞, 计算各个视野中的阳性细胞的平均百分率作为该切片阳性细胞的百分率, 然后打分: 0分为阴性, 1分为阳性细胞<30%, 2分为30%-70%, 3分为>70%. 同时染色强度亦进行打分, 以多数呈现的染色特征为计分标准: 0分为无色, 1分为淡黄色, 2分为棕黄色, 3分为棕褐色. 最后以阳性细胞百分率计分和染色强度计分相加所得的总分进行结果判定: 0分为阴性, 1-6分为阳性.
统计学处理 应用SPSS13.0软件包进行统计学分析, 两样本比较采用χ2检验, 相关性分析采用Spearman等级相关分析, 以P<0.05为差异有统计学意义.
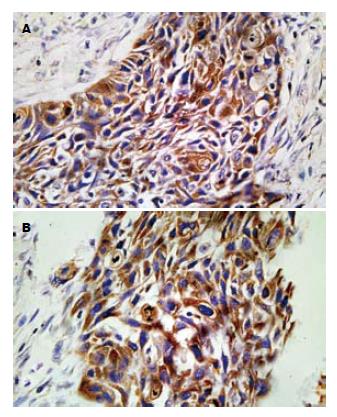
PTTG和bFGF阳性表达均主要定位于肿瘤细胞的胞质, 呈弥漫性全胞质分布, 偶见胞核表达. 食管癌灶中为弥漫性或灶性分布, 肿瘤间质及炎症细胞少见不规则弱阳性分布(图1). 食管癌组织中PTTG表达阳性率为68.8%(33/48), bFGF表达阳性率为70.8%(34/48), 在癌旁正常食管组织中阳性表达率分别为9.1%和14.3%, 两组比较差异均有统计学意义(P<0.05, 表1).
| 类型 | PTTG | P | bFGF | P | |||
| + | - | + | - | ||||
| 癌组织 | 33 | 15 | 0.023 | 34 | 14 | 0.018 | |
| 正常组织 | 4 | 44 | 6 | 42 | |||
PTTG和bFGF的表达与淋巴结转移和TNM分期有关, 而与患者年龄、性别、肿瘤大小、组织学分化程度无关. 即有淋巴结转移和Ⅲ期的食管癌组织中, PTTG和bFGF的阳性表达率明显高于无淋巴结转移和Ⅰ、Ⅱ期的食管癌组织(P<0.05, 表2).
| 病理因素 | PTTG | P | bFGF | P | ||
| + | - | + | - | |||
| 年龄 | 0.845 | 0.817 | ||||
| <60 | 15 | 7 | 16 | 6 | ||
| ≥60 | 18 | 8 | 18 | 8 | ||
| 性别 | 0.537 | 0.401 | ||||
| 男 | 23 | 9 | 24 | 8 | ||
| 女 | 10 | 6 | 10 | 6 | ||
| 瘤体大小(cm) | 0.624 | 0.736 | ||||
| <5 | 21 | 10 | 23 | 8 | ||
| ≥5 | 12 | 5 | 11 | 6 | ||
| 组织分化程度 | 0.358 | 0.425 | ||||
| 高、中分化 | 21 | 10 | 22 | 9 | ||
| 低分化 | 12 | 5 | 12 | 5 | ||
| 淋巴结转移 | 0.015 | 0.018 | ||||
| + | 14 | 2 | 15 | 1 | ||
| - | 19 | 13 | 19 | 13 | ||
| TNM分期 | 0.028 | 0.022 | ||||
| Ⅰ、Ⅱ期 | 20 | 13 | 21 | 12 | ||
| Ⅲ期 | 13 | 2 | 13 | 2 | ||
PTTG是由Pei et al[18]在1997年从大鼠GH4垂体瘤中分离出的新的原癌基因, 定位于染色体5q33, 含有5个外显子和个内含子, 编码一个含202个氨基酸残基、相对分子质量为22×103的蛋白质, 以细胞周期依赖性方式表达,在有丝分裂期(特别是G2/M期)表达水平最高. 在大多数正常人体组织如结肠、胰腺、卵巢、大脑等, PTTG只有弱表达甚至检测不到, 但在多种增生活跃的组织, 如胚胎肝、脾脏、睾丸等存在PTTG的表达, 在肿瘤细胞中如肺癌、膀胱癌、肝癌、垂体瘤、白血病、甲状腺癌等中高表达[19-22]. PTTG可通过多条途径参与肿瘤的病理过程, 如诱导细胞转化, 促进其他原癌基因及促瘤因子的表达, 干扰姊妹染色单体分离, 促进bFGF参与的肿瘤血管生成等[1]. 众多研究发现, PTTG是一个强有力的细胞转化基因, 在无其他辅助癌基因的参与下即能引起细胞转化, 与肿瘤的侵袭性、恶性程度、细胞分化程度及预后密切相关[23-24]. 本实验研究结果表明, 在食管癌组织中PTTG表达水平显著高于癌旁正常食管组织(P<0.05). PTTG表达与患者年龄、性别、瘤体大小和肿瘤组织分化程度无相关性: 与有无淋巴结转移、TNM分期显著相关, 患者有淋巴结转移时TNM分期越晚, PTTG阳性表达率也越高, 这表明PTTG基因的阳性表达与肿瘤细胞的侵袭和转移密切相关: 这与金中元 et al[4]对原发性肝细胞癌的报道相一致.
肿瘤新生血管的形成在肿瘤的生长、侵袭、转移中起到重要的作用, bFGF是一种具有广泛生物活性的肽类物质, 是调节血管生成的重要因子, bFGF对新生血管形成过程中的各个环节均有促进作用, 可趋化血管内膜的各类细胞, 并诱导这些细胞表达胶原酶、蛋白水解酶等, 这些酶类可以促使血管内皮降解和刺激内膜各类细胞的增殖, 诱导血管内皮细胞长入胶原基质形成管腔, 促进新生血管生长. 通过自分泌或旁分泌的形式促进细胞分裂增殖并强烈刺激肿瘤的血管生成, 在多种肿瘤中过度表达[25].
PTTG可促进c-Myc和bFGF等其他促瘤因子的表达, 其中PTTG与bFGF的关系最为密切, 有学者认为PTTG的某些生物学作用通过bFGF实现[26-27]. 研究表明, 肿瘤细胞内过度表达的PTTG蛋白通过其反式激活作用激活bFGF的分泌, 同时, bFGF可促进Ⅳ型胶原酶的分泌, 后者降解间质亦为癌细胞的转移提供了基础. 体外实验表明, PTTG与b-FGF可相互诱导, 形成自分泌与旁分泌的反馈环路[28]. Ishikawa et al[25]发现转染PTTG的NIH3T3细胞的培养液中b-FGF表达增加, 这种培养液在体外能诱导人奇静脉内皮细胞增生、迁移和毛细血管管腔形成. 在体内, 可诱导鸡绒毛膜、尿囊膜呈轮辐状排列, 后者为血管新生的表现. Tfelt-Hansenet al[29]发现PTTG的过度表达可显著上调bFGF的表达, 并促进肿瘤的血管形成. 本研究发现b-FGF表达水平与患者年龄、性别、瘤体大小和肿瘤组织分化程度无相关性: 而与有无淋巴结转移、TNM分期显著相关. b-FGF在Ⅲ期食管癌中阳性率明显高于Ⅰ+Ⅱ期, 说明b-FGF的表达与肿瘤的进展有关. b-FGF的阳性表达亦与淋巴结转移密切相关, 表明其与肿瘤浸润转移有关(P<0.05). 近期研究表明, b-FGF与多种恶性肿瘤的发生、发展有关, 且其表达与肿瘤的预后相关[14-17].
本实验结果表明, PTTG和b-FGF在食管癌中具有高表达, 并且二者表达均与肿瘤有无淋巴结转移、TNM分期显著相关, 这与Shibata et al[30]的研究结果相一致. 同时, PTTG和bFGF的二者的表达呈显著正相关, 这表明二者在肿瘤细胞的发生和发展中可能起一种协同作用. 因此我们认为PTTG可能通过提高bFGF的表达促进肿瘤新生血管的形成而促进肿瘤的生长及向恶性转化.
总之, 本实验证实了PTTG和bFGF在食管癌中的表达情况及二者的相关性. 这将为食管癌的基因治疗以及开发新的药物治疗提供新的思路.
食管癌为我国最常见的恶性肿瘤之一, 在某些地区位于发病率和死亡率的首位. 垂体肿瘤转化基因(PTTG)是新近发现的一种癌基因, 可通过多条途径参与肿瘤的病理过程, 与多种肿瘤的发生、迁移与转移均有关系, 是一种强有力的肿瘤转化基因.
肖恩华, 教授, 中南大学湘雅二医院放射教研室; 阎晓初, 副教授, 中国人民解放军第三军医大学西南医院病理研究所.
有关PTTG与碱性成纤维细胞生长因子(bFGF)在食管癌组织中的表达, 及其与食管癌生物学特征的相关性至今报道较少.
Ishikawa et al发现转染PTTG的NIH3T3细胞的培养液中b-FGF表达增加, 这种培养液在体外能诱导人奇静脉内皮细胞增生、迁移和毛细血管管腔形成.
本实验证实了PTTG和bFGF在食管癌中的表达情况及二者的相关性. 这将为食管癌的基因治疗以及开发新的药物治疗提供新的思路.
本文内容新颖, 写作规范, 具有一定的临床指导意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Yu R, Melmed S. Pituitary tumor transforming gene: an update. Front Horm Res. 2004;32:175-185. [PubMed] [DOI] |
| 2. | Chen L, Puri R, Lefkowitz EJ, Kakar SS. Identification of the human pituitary tumor transforming gene (hPTTG) family: molecular structure, expression, and chromosomal localization. Gene. 2000;248:41-50. [PubMed] [DOI] |
| 3. | Yu R, Ren SG, Horwitz GA, Wang Z, Melmed S. Pituitary tumor transforming gene (PTTG) regulates placental JEG-3 cell division and survival: evidence from live cell imaging. Mol Endocrinol. 2000;14:1137-1146. [PubMed] [DOI] |
| 5. | Boelaert K, McCabe CJ, Tannahill LA, Gittoes NJ, Holder RL, Watkinson JC, Bradwell AR, Sheppard MC, Franklyn JA. Pituitary tumor transforming gene and fibroblast growth factor-2 expression: potential prognostic indicators in differentiated thyroid cancer. J Clin Endocrinol Metab. 2003;88:2341-2347. [PubMed] [DOI] |
| 6. | Meten-Mucha G. [Molecular aspects of pituitary tumors]. Endokrynol Pol. 2005;56:333-338. [PubMed] |
| 7. | Boelaert K, Yu R, Tannahill LA, Stratford AL, Khanim FL, Eggo MC, Moore JS, Young LS, Gittoes NJ, Franklyn JA. PTTG's C-terminal PXXP motifs modulate critical cellular processes in vitro. J Mol Endocrinol. 2004;33:663-677. [PubMed] [DOI] |
| 8. | McCabe CJ, Boelaert K, Tannahill LA, Heaney AP, Stratford AL, Khaira JS, Hussain S, Sheppard MC, Franklyn JA, Gittoes NJ. Vascular endothelial growth factor, its receptor KDR/Flk-1, and pituitary tumor transforming gene in pituitary tumors. J Clin Endocrinol Metab. 2002;87:4238-4244. [PubMed] [DOI] |
| 9. | Yu R, Melmed S. Oncogene activation in pituitary tumors. Brain Pathol. 2001;11:328-341. [PubMed] |
| 10. | McCabe CJ, Gittoes NJ. PTTG--a new pituitary tumour transforming gene. J Endocrinol. 1999;162:163-166. [PubMed] [DOI] |
| 11. | Ma EL, Li YC, Tsuneki H, Xiao JF, Xia MY, Wang MW, Kimura I. Beta-eudesmol suppresses tumour growth through inhibition of tumour neovascularisation and tumour cell proliferation. J Asian Nat Prod Res. 2008;10:159-167. [PubMed] [DOI] |
| 14. | Bilgic I, Ozalp N, Tez M, Koc M. Serum bFGF concentrations in gastric cancer patients. Bratisl Lek Listy. 2008;109:8-9. [PubMed] |
| 15. | Strutz F, Zeisberg M, Renziehausen A, Raschke B, Becker V, van Kooten C, Muller G. TGF-beta 1 induces proliferation in human renal fibroblasts via induction of basic fibroblast growth factor (FGF-2). Kidney Int. 2001;59:579-592. [PubMed] [DOI] |
| 16. | Smolej L, Andrys C, Krejsek J, Belada DZ, Zak P, Siroky O, Maly J. [Basic fibroblast growth factor (bFGF) and vascular endothelial growth factor (VEGF) are elevated in peripheral blood plasma of patients with chronic lymphocytic leukemia and decrease after intensive fludarabine-based treatment]. Vnitr Lek. 2007;53:1171-1176. [PubMed] |
| 17. | Bresalier RS, Ho SB, Schoeppner HL, Kim YS, Sleisenger MH, Brodt P, Byrd JC. Enhanced sialylation of mucin-associated carbohydrate structures in human colon cancer metastasis. Gastroenterology. 1996;110:1354-1367. [PubMed] [DOI] |
| 18. | Pei L, Melmed S. Isolation and characterization of a pituitary tumor-transforming gene (PTTG). Mol Endocrinol. 1997;11:433-441. [PubMed] [DOI] |
| 19. | Stratford AL, Boelaert K, Tannahill LA, Kim DS, Warfield A, Eggo MC, Gittoes NJ, Young LS, Franklyn JA, McCabe CJ. Pituitary tumor transforming gene binding factor: a novel transforming gene in thyroid tumorigenesis. J Clin Endocrinol Metab. 2005;90:4341-4349. [PubMed] [DOI] |
| 20. | Wierinckx A, Auger C, Devauchelle P, Reynaud A, Chevallier P, Jan M, Perrin G, Fevre-Montange M, Rey C, Figarella- Branger D. A diagnostic marker set for invasion, proliferation, and aggressiveness of prolactin pituitary tumors. Endocr Relat Cancer. 2007;14:887-900. [PubMed] [DOI] |
| 21. | Minematsu T, Suzuki M, Sanno N, Takekoshi S, Teramoto A, Osamura RY. PTTG overexpression is correlated with angiogenesis in human pituitary adenomas. Endocr Pathol. 2006;17:143-153. [PubMed] [DOI] |
| 22. | Bradshaw C, Kakar SS. Pituitary tumor transforming gene: an important gene in normal cellular functions and tumorigenesis. Histol Histopathol. 2007;22:219-226. [PubMed] |
| 23. | Mu YM, Oba K, Yanase T, Ito T, Ashida K, Goto K, Morinaga H, Ikuyama S, Takayanagi R, Nawata H. Human pituitary tumor transforming gene (hPTTG) inhibits human lung cancer A549 cell growth through activation of p21(WAF1/CIP1 ). Endocr J. 2003;50:771-781. [PubMed] [DOI] |
| 24. | 杨 竹林, 苗 雄鹰, 钟 德玝, 黄 生福, 梁 珊, 付 汐. 胰腺癌和慢性胰腺炎组织中垂体肿瘤转化基因mRNA和脆性组氨酸 三联体表达研究. 中华消化杂志. 2006;26:423-424. |
| 25. | Ishikawa H, Heaney AP, Yu R, Horwitz GA, Melmed S. Human pituitary tumor-transforming gene induces angiogenesis. J Clin Endocrinol Metab. 2001;86:867-874. [PubMed] [DOI] |
| 26. | Cong J, Wang HY, Zhang CL. [Expression and clinical significance of PTTG and b-FGF in acute leukemia]. Zhongguo Shiyan Xuetexue Zazhi. 2005;13:951-953. [PubMed] |
| 27. | Wang YK, Cui N, Li J, Luo B. [Expression of pituitary tumor-transforming gene in endometrial carcinoma]. Zhonghua Fuchanke Zazhi. 2004;39:538-542. [PubMed] |
| 28. | McCabe CJ, Khaira JS, Boelaert K, Heaney AP, Tannahill LA, Hussain S, Mitchell R, Olliff J, Sheppard MC, Franklyn JA. Expression of pituitary tumour transforming gene (PTTG) and fibroblast growth factor-2 (FGF-2) in human pituitary adenomas: relationships to clinical tumour behaviour. Clin Endocrinol (Oxf). 2003;58:141-150. [PubMed] [DOI] |
| 29. | Tfelt-Hansen J, Kanuparthi D, Chattopadhyay N. The emerging role of pituitary tumor transforming gene in tumorigenesis. Clin Med Res. 2006;4:130-137. [PubMed] |
| 30. | Shibata Y, Haruki N, Kuwabara Y, Nishiwaki T, Kato J, Shinoda N, Sato A, Kimura M, Koyama H, Toyama T. Expression of PTTG (pituitary tumor transforming gene) in esophageal cancer. Jpn J Clin Oncol. 2002;32:233-237. [PubMed] [DOI] |