修回日期: 2008-06-12
接受日期: 2008-06-17
在线出版日期: 2008-07-28
目的: 研究Genistein对人胰腺癌细胞系Panc-1诱导细胞上皮-间质样转化的作用, 以探讨Genistein抑制胰腺癌侵袭作用的机制.
方法: 用TGF-β1和不同浓度Genistein(0、1、25、50 μmol/L)处理Panc-1细胞, 对照组加入等量PSB. 采用Transwell小室法检测Genistein作用于TGF-β1诱导Panc-1细胞后侵袭力的变化; RT-PCR技术检测波形蛋白(Vimentin)、E-钙依赖黏附素(E-Cadherin)的mRNA表达; Western blot蛋白印迹法检测E-Cadherin蛋白的表达; 应用显微镜观察分析细胞结构的改变.
结果: TGF-β1对Panc-1细胞有显著诱导上皮-间质转化的作用, 并增加细胞侵袭力, Genistein不但对诱导后Panc-1细胞侵袭力有抑制, 对细胞上皮-间质样转化也有抑制, 且这种作用呈剂量依赖性. 0 μmol/L Genistein组细胞计数明显比对照组高(99.16±11.30 vs 65.46±8.99, P<0.05), 50 μmol/L Genistein处理诱导后细胞48 h, 细胞侵袭力下降, Vimentin mRNA表达水平降低, 而E-Cadherin mRNA和蛋白表达水平升高, 细胞形态学间质样特性被逆转.
结论: Genistein具有明显抑制TGF-β1诱导的人胰腺癌细胞Panc-1侵袭力的作用, 这可能是其抗侵袭作用的机制之一.
引文著录: 韩磊, 郭克建, 周文平, 陈希涛. Genistein对TGF-β1诱导人胰腺癌细胞上皮-间质样转化的作用. 世界华人消化杂志 2008; 16(21): 2359-2363
Revised: June 12, 2008
Accepted: June 17, 2008
Published online: July 28, 2008
AIM: To investigate the effect of Genistein on epithelial-mesenchymal transdifferentiation (EMT) induced by transforming growth factor-β1 (TGF-βl) in human pancreatic cancer cell line Panc-1, and to explore the mechanism of Genistein inhibiting invasion of Panc-1 cells.
METHODS: Panc-1 cells were treated with TGF-β1 and Genistein (0, 1, 25, 50 μmol/L), and those treated with PSB served as controls. Transwell chamber assay was performed to determine the invasion ability change of Panc-1 cells. Reverse transcription-polymerase chain reaction (RT-PCR) was used to estimate the mRNA expression of vimentin and E-cadherin. Western bloting assay was used to measure the protein expression of E-cadherin. Cell structure was observed by microscopy.
RESULTS: TGF-βl obviously promoted EMT and invasion abilibty of Panc-1 cells. Not only the invasion ability but also EMT induced by TGF-βl were significantly inhibited by Genistein in a dose-dependent manner. The number of Panc-1 cells was larger in 0 μmol/L Genistein group than that in the control group (99.16 ± 11.30 vs 65.46 ± 8.99, P < 0.05). Genistein at concentraion of 50 μmol/L down-regulated the mRNA expression of vimentin and up-regulated the mRNA and protein expression of E-cadherin. The characteristic morphology of EMT was reversed.
CONCLUSION: Genistein can inhibit TGF-β1-induced invasion of Panc-1 cells remarkably, which may be one of its anti-invasion mechanisms.
- Citation: Han L, Guo KJ, Zhou WP, Chen XT. Effect of Genistein on epithelial-mesenchymal transdifferentiation induced by transforming growth factor-β1 in human pancreatic cancer cell line Panc-1. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2359-2363
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2359.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2359
细胞上皮间质样转化(epithelial-mesenchymal transdifferentiation, EMT)发生于多种生理、病理过程, 如胚胎发育、伤口愈合、肿瘤转移级联反应阶段. EMT的发生以上皮细胞极性的丧失和间质特性的获得、细胞间黏附能力丧失和细胞迁移及运动能力获得为主要特征, 与肿瘤细胞侵袭和远隔转移有密切关系[1-3]. 在胰腺癌侵袭研究领域, EMT已成为热点, 越来越多的学者致力于通过各种方法抑制EMT而降低胰腺癌的侵袭性[4]. TGF-β1具有强烈的刺激EMT的作用[1,3]. 三羟异黄酮(genistein)是大豆中一类重要的非营养素成分, 具有广泛抗癌作用. 研究发现, Genistein可以通过干预肿瘤细胞骨架中波形蛋白的排布方式, 降低肿瘤的恶性程度[5]以及逆转腹膜间皮细胞的EMT细胞形态学的改变[6]. 目前, Genistein在胰腺癌EMT过程中的作用尚无相关报道. 本研究通过观察Genistein对E-钙依赖黏附素(E-Cadherin)和波形蛋白(vimentin)表达以及细胞形态学方面的影响, 探讨其在TGF-β1诱导的胰腺癌细胞Panc-1发生EMT过程中所发挥作用.
人胰腺癌细胞系Panc-1购自上海中科院细胞研究所. 用含双抗及100 mL/L小牛血清的高糖DMEM培养液, 在37℃含50 mL/L的培养箱中传代培养. 人重组TGF-β1购自Pepro tech公司. 24孔Transwell侵袭小室购自Corning公司; Matrigel 购自B.D.公司; 目的基因引物通过在GenBank上查找, 并应用Primer 5软件自行设计, 由大连宝生物工程有限公司合成; RT-PCR试剂盒购自大连宝生物工程有限公司; Genistein购自Sigma公司. 鼠抗E-cadherin抗体购自武汉博士德公司.
1.2.1 Transwell体外侵袭实验: 应用24孔Transwell侵袭小室进行侵袭实验. 上室的聚碳酸酯膜-Matrigel(250 μg/cm2)在37℃聚合后待用. 收集对数生长期Panc-1细胞经胰酶消化后加入无血清培养液制成单细胞悬液加入上室孔中, 细胞浓度为2×105/孔, 用10 mg/L TGF-β1和不同浓度Genistein处理, 使Genistein终浓度分别为0、1、25、50 μmol/L, 对照组加入等量PSB. 下室中加入趋化因子400 μL(MRC-5细胞48 h无血清的条件培养液), 培养48 h. 待培养时间结束后将Transwell上室的附着细胞用湿棉签擦去. 苏木精染色, 封片后显微镜下(200倍)计数穿过滤膜的细胞数. 每张膜计数上下左右中5个随机的不同视野, 每组平行设3个滤膜. 侵袭抑制率IR(%) = [(对照组穿膜细胞数-给药组穿膜细胞数)/对照组穿膜细胞数]×100%.
1.2.2 Western blot蛋白印迹检测E-cadherin表达: 10 μg/L TGF-β1处理细胞后30 min加入不同浓度Genistein, 常规培养48 h. 细胞用预冷的PBS洗3遍, 适当体积裂解缓冲液[20 mmol/L Tris-HCL, pH7.5, 0.1 mmol/L Na3VO4, 25 mmol/L NaF, 25 mmol/L β-glycerophosphate, 2 mmol/L EDTA, 2 mmol/L EGTA, 1 mmol/L DTT, 1 mmol/L PMSF, 2 mg/L leupeptin]重悬细胞, 超声裂解细胞后, 4℃ 12 000 g离心1 h, 收集上清-70℃保存. 考马斯亮蓝法测定蛋白浓度, 用80 g/L SDS-聚丙烯酰胺凝胶电泳分离蛋白, 分离的蛋白电转移至PVDF膜后, 用5%脱脂奶的TBST室温封闭4 h, 加入1:400鼠抗E-cadherin, β-actin 4℃孵育过夜, 1:2000稀释的酶标二抗室温孵育1 h, TBS洗净后, 酶显法, 显色剂显色. 采用FlourChem V 2.0凝胶成像分析软件(America)分析. 实验重复3次.
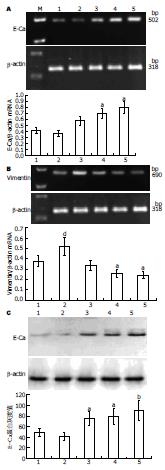
1.2.3 RT-PCR检测E-cadherin和Vimentin的表达: 细胞总的RNA的提取: 收集各实验组细胞, 按TRIzol试剂盒说明提取RNA, 电泳鉴定RNA质量并在A260nm测其浓度. 引物序列: Vimentin: sense primer(5'-CGC TTC GCC AAC TAC AT-3'), antisense primer(5'-AGG GCA TCC ACT TCA CAG-3')690 bp. E-caderin: sense primer(5'-CGC ATT GCC ACA TAC A-3'), antisense primer(5'-CGT TAG CCT CGT TCT CA-3')502 bp; 以为β-actin内参, sense primer(5'-ATC ATG TTT GAG ACC TTC AAC A-3')antisense primer(5'-CAT CTC TTG CTC GAA GTC CA-3'), 318 bp. PCR扩增条件: 变性94℃ 1 min, 退火55-57℃ 1 min, 延伸72℃ 1 min, 循环31次. 将15 g/L琼脂糖凝胶置于含0.5×TBE的电泳槽中, 取10 μL扩增产物与1 μL 6×上样缓冲液混合后上样, 电泳(10 mA, 100 V)结束后, 结果采用FlourChem V 2.0凝胶成像分析软件(America)分析. 实验重复3次.
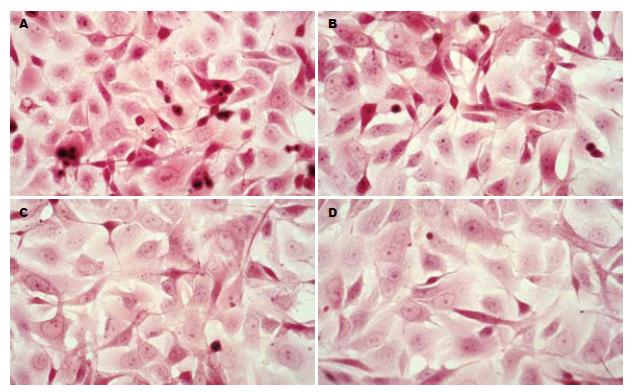
1.2.4 光镜观察: 将各组细胞常规培养48 h后, 常规HE染色后, 光镜(10×40倍)观察并拍照.
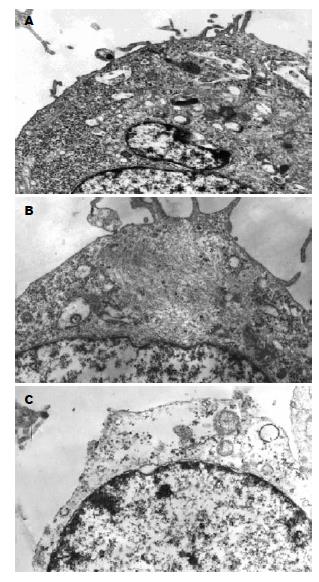
1.2.5 透射电镜观察: 10 μg/L TGF-β1处理细胞后30 min分别加入不同浓度Genistein(对照组加入等体积DMEM培养基), 培养 48 h收集各组细胞(1×l05/瓶), 25 g/L戊二醛固定, 常规包埋、切片, 透射电镜观察细胞超微结构的变化.
统计学处理 采用SPSS13.0软件包对结果进行分析, 应用方差分析及两样本间χ2检验方法统计分析, 数据以mean±SD表示;P<0.05有统计学意义.
与TGF-β1刺激组相比, 治疗3组抑制率增加(P<0.05), 提示高浓度Genistein具有抑制TGF-β1诱导后的胰腺癌细胞侵袭能力(表1).
光镜结果: TGF-β1(10 μg/L)诱导后Panc-1表现散在趋势, 细胞间连接不紧密, 呈散在生长; 细胞形态呈不规则改变, 部分细胞呈梭形. Genistein浓度为25 μmol/L细胞散在生长趋势减轻, 部分呈团簇型生长, 细胞连接较为紧密, 浓度为50 μmol/L时表现更为明显(图1). 透射电镜结果: TGF-β1处理组细胞胞质内可见致密核心颗粒分布, 部分细胞内可见在细胞核周围形成"丝团状"结构, 细胞外微绒毛增多变密; Genistein(50 μmol/L)治疗组后伪足形成减少, 细胞骨架重排, 呈解聚状态, 分布弥散, 核周"丝团状"结构消失(图2).
与TGF-β1处理组相比, 治疗1、2、3组(1、25、50 μmol/L)E-cadherin mRNA和蛋白表达明显增加, Vimentin mRNA表达降低, 呈浓度依赖性(图3), 说明Genistein通过降低Vimentin表达和增加E-cadherin表达, 降低外源性TGF-β1诱导人胰腺癌细胞Panc-1发生EMT的诱导作用.
EMT的重要特征之一是上皮细胞标志的E- cadherin表达的减少和间质细胞标志的Vimentin表达增加. EMT在胰腺癌侵袭和转移中的发挥重要作用, 并于不良预后有关. 殷涛 et al[7]研究表明TGF-β1可以明显诱导人胰腺癌细胞Panc-1的发生EMT, 同时细胞侵袭能力增加. 本实验结果也表明: 外源性TGF-β1诱导人胰腺癌细胞Panc-1 48 h后E-cadherin表达下降, 而Vimentin表达明显增加, 形态学具有上皮细胞向间质细胞转变的特征. 与以往文献报道结果一致.
E-cadherin是一种Ca2+依赖性跨膜糖蛋白, 广泛分布于各类上皮细胞, 是维持上皮细胞、组织形态和结构完整性和极性的重要分子[8]. E-Cadherin胞内区通过连环素(Catenins)与细胞内骨架系统形成复合体, 发挥上皮细胞间的黏附功能[9]. 在肿瘤组织中, 他可使细胞保持密切接触, 难以脱离原发部位进入周围组织和脉管, 故具有抑制肿瘤转移作用. Vimentin是一种中间丝, 是细胞骨架(cytoskeleta1)成分之一, 细胞骨架与细胞的运动行为密切相关. Vimentin被看作是一种间质细胞的标志物[10]. Vimentin在上皮源肿瘤中的反常高表达现象是肿瘤发生EMT过程的表型改变[11]. 细胞发生EMT时Vimentin排列方式发生改变, 使细胞更具有运动能力. 本实验中, 人胰腺癌细胞Panc-1经Genistein治疗后, E-cadherin表达明显增加而Vimentin表达降低, 同时细胞形态学方面, 与TGF-β1处理组相比, 表现为细胞连接趋于紧密, 类成纤维样细胞数量减少, 电镜下细胞骨架重新排列, 细胞伪足减少, 细胞运动能力减弱. 由此说明, Genistein具有对抗TGF-β1诱发EMT的作用, 使细胞侵袭能力降低.
Genistein是一种酪氨酸蛋白激酶抑制剂, 他能竞争性地抑制ATP结合到酪氨酸激酶催化结构域, 抑制酪氨酸激酶的活性, 同时还具有类雌激素作用、抗氧化及抑制拓扑异构酶Ⅱ活性等多种生物学效应. 虽然Genistein的抗肿瘤作用已被广泛认识, 但在以往研究中, 多集中在Genistein的抑制肿瘤细胞生长和增殖、促进凋亡等方面[12-14]. 已有实验表明, 在胰腺癌细胞中, Genistein可以改变多种与肿瘤生长和侵袭有关的基因表达[15], 在胰腺癌裸鼠的转移模型中也发挥明显的抑制作用[16], 但关于其在胰腺癌EMT过程中的作用尚无相关报道. 本研究首次表明, Genistein在细胞转化方面发挥一定的作用, 这可能是其抗肿瘤侵袭作用的机制之一. 在未来, 我们将进一步研究Genistein在TGF-β1诱导EMT过程中相关信号转导通路的作用靶点.
胰腺癌是恶性程度很高的消化系肿瘤, 发病率呈上升趋势. 由于胰腺癌特殊的生物学特性, 使药物治疗胰腺癌始终不理想. 目前亟待解决的问题是寻找一种可以针对肿瘤侵袭过程的重要环节及肿瘤所建立的局部微环境的破坏能力强, 而对正常人体细胞作用轻微的无毒或低毒性药物.
张水军, 教授, 郑州大学第一附属医院普通外科; 吴泰璜, 教授, 山东省立医院肝胆外科.
在胰腺癌侵袭研究领域, 上皮细胞向间叶样细胞转化(EMT)成为近年来研究热点. 运动能力相对弱的胰腺癌上皮细胞在TGF-β1诱导后可以向具有运动能力相对强的间叶细胞转化, 使肿瘤细胞更具有侵袭和转移的能力. 这种细胞转化在胰腺癌中与侵袭能力呈正相关.
虽然Genistein的抗肿瘤作用已被广泛认识, 但在以往研究中, 多集中在Genistein的抑制肿瘤细胞生长和增殖、促进凋亡等方面, 关于针对其在胰腺癌EMT过程中的作用还没有相关报道. 其他研究发现, Genistein可以通过干预肿瘤细胞骨架中波形蛋白的排布方式, 降低肾癌的恶性程度. 在EMT相关分子机制的研究中发现, Genistein可以逆转腹膜间皮细胞的EMT细胞形态学改变.
本研究首次报道Genistein对TGF- β1诱导后胰腺癌发生EMT细胞转化的潜在逆转作用, 为阐明该药在胰腺癌中与EMT之间的关系提供了有价值的理论参考.
本文内容比较新颖, 研究方法得当, 论述条理, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Huber MA, Kraut N, Beug H. Molecular requirements for epithelial-mesenchymal transition during tumor progression. Curr Opin Cell Biol. 2005;17:548-558. [PubMed] [DOI] |
| 2. | Bates RC, DeLeo MJ 3rd, Mercurio AM. The epithelial-mesenchymal transition of colon carcinoma involves expression of IL-8 and CXCR-1-mediated chemotaxis. Exp Cell Res. 2004;299:315-324. [PubMed] [DOI] |
| 3. | Ellenrieder V, Hendler SF, Boeck W, Seufferlein T, Menke A, Ruhland C, Adler G, Gress TM. Transforming growth factor beta1 treatment leads to an epithelial-mesenchymal transdifferentiation of pancreatic cancer cells requiring extracellular signal-regulated kinase 2 activation. Cancer Res. 2001;61:4222-4228. [PubMed] |
| 4. | Jungert K, Buck A, von Wichert G, Adler G, König A, Buchholz M, Gress TM, Ellenrieder V. Sp1 is required for transforming growth factor-beta-induced mesenchymal transition and migration in pancreatic cancer cells. Cancer Res. 2007;67:1563-1570. [PubMed] [DOI] |
| 6. | Demir AY, Groothuis PG, Nap AW, Punyadeera C, de Goeij AF, Evers JL, Dunselman GA. Menstrual effluent induces epithelial-mesenchymal transitions in mesothelial cells. Hum Reprod. 2004;19:21-29. [PubMed] [DOI] |
| 7. | 殷 涛, 王 春友, 赵 刚, 刘 涛, 周 峰, 陶 京. 转化生长因子-β1诱导的上皮向间叶转化对胰腺癌侵袭和转移的意义. 华中 科技大学学报(医学版). 2007;36:67-70. |
| 9. | Jiang WG. E-cadherin and its associated protein catenins, cancer invasion and metastasis. Br J Surg. 1996;83:437-446. [PubMed] [DOI] |
| 10. | Fraga CH, True LD, Kirk D. Enhanced expression of the mesenchymal marker, vimentin, in hyperplastic versus normal human prostatic epithelium. J Urol. 1998;159:270-274. [PubMed] [DOI] |
| 11. | Lang SH, Hyde C, Reid IN, Hitchcock IS, Hart CA, Bryden AA, Villette JM, Stower MJ, Maitland NJ. Enhanced expression of vimentin in motile prostate cell lines and in poorly differentiated and metastatic prostate carcinoma. Prostate. 2002;52:253-263. [PubMed] [DOI] |
| 12. | Moiseeva EP, Almeida GM, Jones GD, Manson MM. Extended treatment with physiologic concentrations of dietary phytochemicals results in altered gene expression, reduced growth, and apoptosis of cancer cells. Mol Cancer Ther. 2007;6:3071-3079. [PubMed] [DOI] |
| 13. | Sakla MS, Shenouda NS, Ansell PJ, Macdonald RS, Lubahn DB. Genistein affects HER2 protein concentration, activation, and promoter regulation in BT-474 human breast cancer cells. Endocrine. 2007;32:69-78. [PubMed] [DOI] |
| 14. | Huang X, Chen S, Xu L, Liu Y, Deb DK, Platanias LC, Bergan RC. Genistein inhibits p38 map kinase activation, matrix metalloproteinase type 2, and cell invasion in human prostate epithelial cells. Cancer Res. 2005;65:3470-3478. [PubMed] |