修回日期: 2008-06-17
接受日期: 2008-06-23
在线出版日期: 2008-07-28
目的: 研究线粒体DNA上游调节基因mtTFA和NRF-1对冷保存肝移植大鼠肝细胞线粒体DNA ATPase6基因表达的影响, 探讨mtTFA和NRF-1对冷保存肝移植大鼠肝细胞线粒体DNA调节作用及其机制.
方法: Wistar大鼠186只, 采用改良"二袖套法"制作大鼠肝移植模型, 动物随机分为A组: 冷保存30 min; B组: 冷保存6 h; C组: 冷保存12 h; 和D组(假手术对照组), 分别于制模后于12 h、24 h、3 d、5 d、7 d采集标本, 保证每时相点存活大鼠6只. 观察各组大鼠肝脏ATP含量. 采用RT-PCR方法检测mtDNA ATPase6 mRNA、mtTFA和NRF-1 mRNA的表达变化.
结果: 冷保存再灌注后早期(12 h), A、B、C三组mtTFA mRNA表达降低, 与A、B组相比, C组最为显著(0.57±0.05 vs 0.87±0.11, 0.69±0.10, P<0.05), NRF-1 mRNA表达变化与mtTFA mRNA相一致. 24 h后各组mtTFA及NRF-1 mRNA表达开始升高, ATPase6表达和肝组织ATP含量也升高, 并且升高趋势与mtTFA及NRF-1 mRNA表达增高基本一致.
结论: mtTFA和NRF-1可能通过基因转录调节ATPase6基因表达, 改变线粒体呼吸链转运电子、合成ATP的能力.
引文著录: 张莹, 别平, 石承先, 任娟娟. mtTFA、NRF-1对冷保存-再灌注肝移植大鼠线粒体DNA ATPase6基因表达的调节. 世界华人消化杂志 2008; 16(21): 2337-2342
Revised: June 17, 2008
Accepted: June 23, 2008
Published online: July 28, 2008
AIM: To observe the effects of mitochondrial transcription factor A (mtTFA) and nuclear respiratory factor-1 (NRF-1) on the expression of mitochondrial ATP6 genes during cold preservation and reperfusion injury in rats receiving orthotopic liver transplantation.
METHODS: Orthotopic liver transplantation was performed in Wistar rats using the cuff technique as described by Kamada with modifications. A total of 186 rats were randomly divided into 4 groups, named as group A (30 min of cold preservation), group B (6 h of cold preservation), group C (12 h of cold preservation) and group D (sham operation). Hepatic samples were collected at 12 h, 24 h and on the 3rd, 5th, 7th day after operation. The ATP levels were observed in each group. The expression levels of NRF-1, mtTFA and mtDNA encoding ATPase6 mRNA were determined by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: The expression of mtTFA decreased in groups A, B and C 12 h after operation, and it was lower in group C and groups A and B (0.57 ± 0.05 vs 0.87 ± 0.11, 0.69 ± 0.10, P < 0.05). The expression change of NRF-1 mRNA was consistent with that of mtTFA. After 24 h, the expression levels of mtTFA and NRF-1 mRNA started to increase, and the expression of ATPase6 mRNA and ATP in hepatic tissues were in accordance with mtTFA and NRF-1 mRNA.
CONCLUSION: mtTFA and NRF-1 increase the expression of ATPase6 mRNA, suggesting mtTFA and NRF-1 may be important factors in controling ATPase6 mRNA transcription.
- Citation: Zhang Y, Bie P, Shi CX, Ren JJ. Effects of mitochondrial transcription factor A and nuclear respiratory factor-1 on the expression of mitochondrial DNA ATPase6 genes during cold preservation and reperfusion injury in rat orthotopic liver transplantation. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2337-2342
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2337.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2337
线粒体呼吸链蛋白亚基是由核基因组和线粒体基因组编码合成[1]. 线粒体转录因子A(mitochondrial transcription factor A, mtTFA)在mtDNA的表达调控中处于中心位置, 通过调控线粒体呼吸链上蛋白质亚基表达, 调控线粒体能量代谢. 核呼吸因子-1(nuclear respiratory factor-1, NRF-1)是核基因编码的影响mtDNA的另一重要因子, 他控制着线粒体电子传递链的一些蛋白质的合成. mtDNA ATPase6基因是调控ATP合成的关键基因. 目前, 有关冷保存-再灌注过程中移植肝线粒体编码基因的变化研究较少. 本研究建立大鼠肝移植模型, 从转录调控水平初步探讨移植肝冷保存-再灌注过程中核基因mtTFA、NRF-1对冷保存-再灌注损伤肝移植大鼠mtDNA ATPase6基因表达的调节机制.
健康清洁级Wistar(n = 186)大鼠, 雌雄各半, 体质量200-250 g, 中国人民解放军第三军医大学大坪医院动物所提供. ♀供体术前自由饮食, ♂受体术前12 h禁食, 自由饮水.
1.2.1 分组和造模: 取180只大鼠随机分为3组. A组(冷保存30 min组): 供肝切取后冷保存30 min后植入受体. 供肝植入后12 h、24 h、3 d、5 d、7 d共5个时相点分别处死实验动物采集标本. 每个时相点6只. 全组动物供、受体各30只. B组: 冷保存6 h组. 即切取供肝, 4℃ UW液保存6 h后行肝移植术. 模型建立、标本采集时相点及每一时相点大鼠数量同A组. C组: 冷保存12 h组. 即切取供肝, 4℃ UW液保存12 h后行肝移植术. 模型建立、标本采集时相点及每一时相点大鼠数量同A组. 剩余6只作为假手术对照组(D组), 大鼠麻醉后开腹采集血液及组织标本. 采用改良"二袖套法"建立大鼠肝移植模型[2].
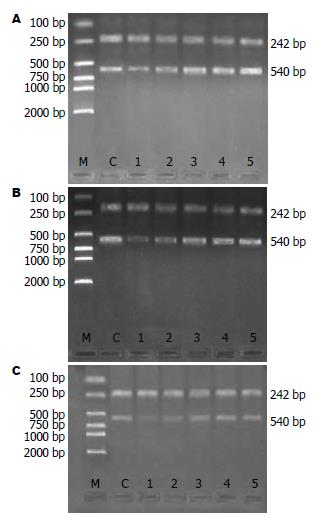
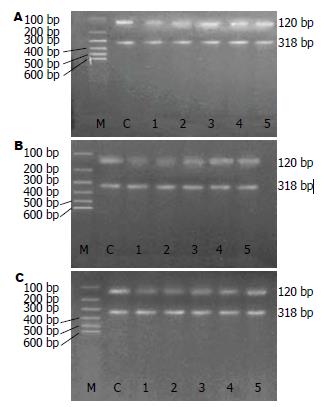
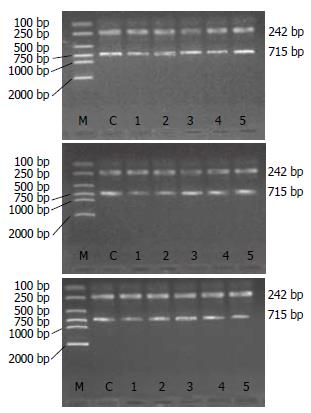
1.2.2 PCR反应引物设计及合成: 根据各反应产物cDNA序列, 设计并合成引物. mtTFA引物: 上游引物: 5'-CGC CTA AAG AAG AAA GCA CAA AG-3'; 下游引物: 5'-CTT AAG CAA ACG GCA GAA CTC G-3'; 扩增片段长度540 bp. β-actin引物: 上游引物(1A): 5'-CCT AGC ACC ATG AAG ATC AA-3下游引物(1B): 5'-AGC CAT GCC AAA TGT CTC AT-3; 扩增片段长度242 bp. NRF-1引物: 上游引物: 5'-CCA CAT TAC AGG GCG GTG AA-3'; 下游引物: 5'-AGT GGC TCC CTG TTG CAT CT-3'; 扩增片段长度120 bp. β-actin引物: 上游引物(2A): 5'-ATC ATG TTT GAG ACC TTC AAC A-3'; 下游引物(2B): 5'-CAT CTC TTG CTC GAA GTC CA-3'; 扩增片段长度318 bp. ATPase6引物: 上游引物: 5'-AAA CGA ATA ACC CTT GAG AAT -3'; 下游引物: 5'-TGG TGG GTC ATT ATG TGT TAT-3'; 扩增片段长度715 bp. β-actin引物: 上游引物(1A): 5'-CCT AGC ACC ATG AAG ATC AA-3; 下游引物(1B): 5'-AGC CAT GCC AAA TGT CTC AT-3'; 片段长度242 bp.
1.2.3 肝组织标本采集: 在处死动物后快速取肝中叶、肝右叶置于液氮保存. 取肝左外叶切成1 cm×0.5 cm×0.5 cm大小, 于40 g/L多聚甲醛溶液固定后石蜡包埋.
1.2.4 逆转录聚合酶链反应(RT-PCR): 逆转录反应试剂盒购于大连宝生物公司. 取肝组织总RNA按试剂盒说明合成cDNA. 取2.5 µL cDNA进行PCR反应. mtTFA扩增条件: 95℃预变性200 s, 95℃变性60 s, 53℃退火60 s, 72℃延伸60 s, 反应35个循环. 72℃延伸10 min. β-actin扩增条件同上. NRF-1扩增条件: 94℃预变性6 min, 94℃变性60 s, 55℃退火2 min, 72℃延伸3 min, 反应32个循环. 72℃延伸7 min. β-actin扩增条件同上. ATPase6扩增条件: 95℃预变性200 s, 95℃变性40 s, 55℃退火30 s, 72℃延伸70 s, 反应30个循环. 72℃延伸10 min. β-actin同上.
1.2.5 肝组织ATP含量测定: 标准ATP购于Sigma公司. 从液氮中取出组织样品, 精确称取细小组织块200 mg左右, 立即加入HClO4液试管中, 机械匀浆6000 r/min, 30 s; 4℃离心, 3000 r/min, 10 min; 另取试管, 取上清1 mL, 按说明书操作.
1.2.6 PCR产物鉴定: 用DYY-Ⅲ2型电泳仪, 15 g/L琼脂糖凝胶, 取10 µL溶液与3uL上样液混和后点样, mtTFA、ATPase6选用DL 2000 Marker, NRF-1选用100-600 bp Marker用量5 µL, 120 V, 30 min后紫外灯下观察并拍照.
1.2.7 mtTFA mRNA、NRF-1 mRNA和ATPase6/β-actin面积光强度比值: 用Quantity one 4.4生物图像分析软件测定各电泳条带面积光强度值, 计算与其相应β-actin面积光强度比值.
统计学处理 数据均以mean±SD表示, 统计学处理采用SPSS10.0软件进行方差分析及t检验, P<0.05为差别显著, P<0.01为差别非常显著.
各组RNA提取以及PCR扩增产物电泳加样量都是相同的, 这样就排除了因加样量不同而造成假阳性和假阴性. mtTFA、NRF-1和ATPase6 PCR产物分别为540 bp(图1)、120 bp(图2)和715 bp(图3). 各组β-actinPCR产物均为一条带, 电泳距离分别在242、318和242 bp处. mtTFA、NRF-1和ATPase6/β-actin经Quantity one 4.4生物图像分析软件分析得出各条带面积光强度值, 取各组大鼠与其相应β-actin面积光强度比值做统计学分析.
A、B、C 3组肝组织mtTFA mRNA表达量早期降低(12 h), C组降低显著(P<0.01), 24 h以后逐渐升高. A组、B组、C组在12 h、24 h、3 d、5 d组间两两比较均具有显著性差异(P<0.05或P<0.01). 3组组内比较可见, 各组mtTFA mRNA表达量均逐渐升高, 与同组前一时间点比较, A组、B组术后24 h、3 d、 5 d升高明显(P<0.05或P<0.01). C组术后12、24 h比较无差异, 3、5、7 d升高明显(P<0.05或P<0.0, 表1).
A、B、C 3组肝组织NRF-1 mRNA表达量早期降低(12 h), 与A组、B组比较, C组降低显著(P<0.01), 24 h以后逐渐升高. A组与B组在12 h无差异, 在24 h、3 d、5 d均具有显著性差异(P<0.05). C组与A组在24 h、3 d、5 d具有显著性差异(P<0.05或P<0.01). C组与B组比较24 h、5 d具有显著性差异(P<0.05或P<0.01). 3组组内比较可见, 各组NRF-1 mRNA表达量均逐渐升高, 与同组前一时间点比较, A组、B组术后24 h、3 d、5 d升高明显(P<0.01). C组术后3、5、7 d升高明显(P<0.05或P<0.01, 表2).
A、B、C 3组肝组织ATPase6 mRNA表达量早期降低(12 h), 并且C组降低显著(P<0.05或P<0.01), 24 h以后逐渐升高. A、B、C三组组内比较可见, 各组ATPase6 mRNA表达量均逐渐升高, 与同组前一时间点比较, A组、B组术后24 h、3 d、5 d升高明显(P<0.05). C组术后12、24 h比较无差异, 3、5、7 d升高明显(P<0.05或P<0.01, 图3, 表3).
A、B、C 3组肝组织ATP早期降低(12 h), 并且冷保存时间越长ATP水平降低显著(A组 vs B组P<0.05或A组vs C组P<0.01), 以后逐渐升高. A、B、C 3组组内比较可见, 各组ATP均逐渐升高, 与同组前一时间点比较, A、B组术后24 h、3 d、5 d升高明显, 具有显著性差异(P<0.05或P<0.01). C组术后12、24 h升高但无统计学差异, 3、5、7 d升高明显(P<0.05或P<0.01, 表4).
线粒体呼吸链存在上百种蛋白质, 线粒体基因编码13种蛋白质. 线粒体呼吸链的成分大部分均由核基因编码, 细胞核通过核转录因子如mtTFA及NRF等调控线粒体基因组的表达[3-4]. 目前己证实细胞色素C还原酶和氧化酶、抗氧化物反应元件(antioxidant response element, ARE)及ATPase亚基的基因启动子中均具有NRF-1的功能性结合位点: 由于mtTFA含有NRF-1的结合位点[5-7], 因此mtTFA也受到NRF-1的调节. mtTFA通过调节mtDNA的转录与复制, 从而调控mtDNA编码呼吸链蛋白亚基[7-8].
mtDNA ATPase6亚基基因是编码ATP合酶复合体(FoF1-ATPase)疏水部分Fo的基因. FoF1 -ATPase复合体位于线粒体内膜的基质侧, 主要由疏水部分Fo和亲水部分F1组成. 在电子传递过程中所释放的能量被用来将基质内的质子泵出到线粒体内膜外, 从而在线粒体内膜两侧产生电化学梯度, 形成线粒体膜电位. 内膜外的质子可通过复合体VF0亚基上的质子通道流回到基质内, 质子回流所释放的势能被用来使ADP磷酸化形成ATP[9-10]. ATPase6基因是编码ATP合成的FoF1-ATPase复合物的一部, 直接影响ATP的生成, 其基因的改变, 使其编码的呼吸链蛋白也将发生变化, 这必将影响ADP磷酸化形成ATP.
本实验观察到C组NRF-1、mtTFA mRNA在再灌注早期(12 h)表达明显降低, 相应的ATPase6 mRNA、ATP含量降低, 说明此时肝脏能量合成明显损伤, 并且冷保存时间越长, 这种损伤越重; 24 h后NRF-1、mtTFA mRNA表达升高, ATPase6 mRNA也随之升高, 同时ATP含量显著增高. 实验结果说明, 移植肝冷保存-再灌注后肝细胞损伤, 核编码的NRF-1、mtTFA mRNA表达和线粒体编码基因ATPase6 mRNA表达均降低, 线粒体酶活性下降, 从而损伤线粒体能量合成, 致使ATP生成减少. 随着NRF-1、mtTFA mRNA表达的升高, ATPase6 mRNA也随之增高, ATP含量也增高, 这与文献报道在缺氧复氧过程中线粒体ATPase活性明显下降, 导致线粒体能量代谢显著降低的结果一致[10-11].
本试验也观察到冷保存时间越长, 再灌注后NRF-1、mtTFA mRNA表达回复正常的时间也相对较长, 表明线粒体DNA修复的时间也越长. 随着ATP含量的增高, NRF-1、mtTFA mRNA表达升高的趋势也逐渐降低, 说明ATP合成减少可诱导NRF-1、mtTFA mRN的表达, 同时ATP生成又对NRF-1、mtTFA mRNA的表达起反馈调节作用, 从而使能量合成经济、有效的进行, 利于肝脏功能的恢复和发挥正常的功能.
本研究结果提示, 随着冷保存时间的延长, ATPase6 mRNA表达下调, 能量代谢障碍加重. 推测氧自由基等造成mtDNA ATPase6基因表达异常, 同时机体又有自身保护性反馈机制, 氧自由基和ATP可能又作为第二信号诱导核基因mtTFA及NRF-1的表达, mtTFA和NRF-1可能通过基因转录调节ATPase6 mRNA表达, 改变线粒体呼吸链转运电子、合成ATP的能力. 因此, 寻找阻止线粒体DNA损伤及促进其上游调节因子表达的策略和方法, 对改善移植肝线粒体功能, 促进移植肝尽早发挥正常功能具有重要意义.
肝脏移植在冷保存-再灌注过程中不可避免造成供肝的损伤. 线粒体DNA(mtDNA)是最易受损的细胞成分之一, 他的损伤直接影响细胞的能量代谢过程, 导致ATP生成减少, 进而加剧细胞损伤. 由核基因组编码的线粒体呼吸链蛋白的转录翻译等过程受核呼吸因子NRF-1 和mtTFA调节,目前已证实了细胞色素C还原酶和氧化酶、抗氧化物反应元件(ARE)及ATPase亚基的基因启动子中均具有NRF-1的功能性结合位点.
宋振顺, 教授, 中国人民解放军第四军医大学西京医院肝胆外科.
如何保护和减少并修复冷保存-再灌注造成的mtDNA损伤是该领域研究热点.
Gibelin et al对大鼠肝脏冷保存12 h,再灌注90 min, 检测组织学改变, 证实存在线粒体损伤, 并且认为细胞内部的损伤对预后更为重要. 李伟文发现失血性休克大鼠肠上皮细胞线粒体DNA ATPase6 mRNA下调和能量代谢障碍形成恶性循环, 最终使细胞功能失常. Suliman et al研究发现mtTFA通过调节mtDNA的转录与复制,从而调控mtDNA编码呼吸链蛋白亚基, 保护和修复受损的mtDNA, 恢复mtDNA的完整性和线粒体的功能.
本研究通过大鼠同种异体原位肝移植模型, 探讨移植肝冷保存-再灌注中调控ATP合成的mt DNA ATPase6基因的改变以及其上游调节因子mt TFA和NRF-1的变化, 从基因水平探讨线粒体损伤在能量代谢障碍中的作用, 从能量代谢角度揭示移植肝冷保存-再灌注损伤的机制, 为改善冷保存条件、提高移植肝质量提供理论依据.
本研究结果提示, 氧自由基等造成mtDNA ATPase6基因表达异常, 同时机体又有自身保护性反馈机制, 诱导核基因mtTFA及NRF-1的表达, mtTFA和NRF-1可能通过基因转录调节ATPase6 mRNA表达, 改变线粒体呼吸链转运电子、合成ATP的能力. 因此, 寻找阻止线粒体DNA损伤及促进其上游调节因子表达的策略和方法, 对改善移植肝线粒体功能, 促进移植肝尽早发挥正常功能具有重要意义.
本文结构清楚, 结论可靠, 学术价值较好, 但描述需要改进.
编辑: 李军亮 电编:吴鹏朕
| 1. | Polimeno L, Margiotta M, Marangi L, Lisowsky T, Azzarone A, Ierardi E, Frassanito MA, Francavilla R, Francavilla A. Molecular mechanisms of augmenter of liver regeneration as immunoregulator: its effect on interferon-gamma expression in rat liver. Dig Liver Dis. 2000;32:217-225. [PubMed] [DOI] |
| 3. | Yoshida Y, Izumi H, Ise T, Uramoto H, Torigoe T, Ishiguchi H, Murakami T, Tanabe M, Nakayama Y, Itoh H. Human mitochondrial transcription factor A binds preferentially to oxidatively damaged DNA. Biochem Biophys Res Commun. 2002;295:945-951. [PubMed] [DOI] |
| 4. | Choi YS, Kim S, Kyu Lee H, Lee KU, Pak YK. In vitro methylation of nuclear respiratory factor-1 binding site suppresses the promoter activity of mitochondrial transcription factor A. Biochem Biophys Res Commun. 2004;314:118-122. [PubMed] [DOI] |
| 5. | Huo L, Scarpulla RC. Mitochondrial DNA instability and peri-implantation lethality associated with targeted disruption of nuclear respiratory factor 1 in mice. Mol Cell Biol. 2001;21:644-654. [PubMed] [DOI] |
| 6. | Garstka HL, Schmitt WE, Schultz J, Sogl B, Silakowski B, Pérez-Martos A, Montoya J, Wiesner RJ. Import of mitochondrial transcription factor A (TFAM) into rat liver mitochondria stimulates transcription of mitochondrial DNA. Nucleic Acids Res. 2003;31:5039-5047. [PubMed] [DOI] |
| 7. | Suliman HB, Carraway MS, Piantadosi CA. Postlipopolysaccharide oxidative damage of mitochondrial DNA. Am J Respir Crit Care Med. 2003;167:570-579. [PubMed] [DOI] |
| 8. | Santos JH, Hunakova L, Chen Y, Bortner C, Van Houten B. Cell sorting experiments link persistent mitochondrial DNA damage with loss of mitochondrial membrane potential and apoptotic cell death. J Biol Chem. 2003;278:1728-1734. [PubMed] [DOI] |
| 9. | Aksimentiev A, Balabin IA, Fillingame RH, Schulten K. Insights into the molecular mechanism of rotation in the Fo sector of ATP synthase. Biophys J. 2004;86:1332-1344. [PubMed] |
| 10. | Angevine CM, Herold KA, Fillingame RH. Aqueous access pathways in subunit a of rotary ATP synthase extend to both sides of the membrane. Proc Natl Acad Sci U S A. 2003;100:13179-13183. [PubMed] [DOI] |