修回日期: 2008-05-22
接受日期: 2008-05-27
在线出版日期: 2008-07-28
目的: 探讨神经型钙黏附蛋白(N-cadherin)在食管鳞癌组织中的表达及其临床病理意义, 以及RNA干扰(RNAi)沉默N-cadherin基因表达对人食管癌细胞系EC9706体外侵袭能力的影响.
方法: 采用免疫组织化学PV法和RT-PCR检测62例食管鳞癌组织、31例癌旁不典型增生组织及62例正常食管黏膜组织中N-cadherin蛋白和mRNA的表达. 将N-cadherin基因的RNA干扰载体稳定转染至EC9706, 通过RT-PCR和Western blotting检测RNAi的效果; 运用Transwell体外侵袭实验检测RNAi后细胞侵袭能力的改变.
结果: 正常黏膜组织、癌旁不典型增生组织及食管鳞癌组织中N-cadherin的阳性表达率依次升高, 分别为29.0%(18/62)、61.3%(19/31)、75.8%(47/62), 组间比较差异有统计学意义(P<0.05); N-cadherin蛋白的阳性表达率与食管鳞癌的浸润深度、分化程度及淋巴结转移密切相关(χ2 = 6.916, 6.924, 4.486, P<0.05). 食管鳞状细胞癌组织中N-cadherin mRNA 的相对含量高于癌旁不典型增生组织及正常食管黏膜组织(0.6631±0.0162 vs 0.4613±0.0239, 0.1538±0.0192), 组间比较差异有统计学意义(χ2 = 819.242, P<0.01). RNAi后EC9706中N-cadherin的表达显著下降; Transwell小室体外侵袭实验显示, EC9706的体外侵袭能力也降低.
结论: 食管鳞癌组织中N-cadherin的高表达与食管鳞癌的浸润、恶化有密切的关系. RNAi沉默N-cadherin基因表达能够使EC9706体外侵袭能力降低.
引文著录: 李克, 王鑫, 何炜, 林娜, 樊青霞. 神经型钙黏附蛋白的表达对食管鳞癌侵袭和转移的影响. 世界华人消化杂志 2008; 16(21): 2325-2332
Revised: May 22, 2008
Accepted: May 27, 2008
Published online: July 28, 2008
AIM: To explore the relationship between N-cadherin expression and clinicopathological significance in esophageal squamous cell carcinoma (ESCC), and to investigate the invasive ability change of EC9706 cells after N-cadherin gene was silenced by RNA interference (RNAi) technique.
METHODS: PV immunohistochemical method and reverse transcription-polymerase chain reaction (RT-PCR) were used to detect the expression of N-cadherin in 62 cases of normal esophageal epithelia, 31 cases of adjacent atypical hyperplasia and 62 cases of ESCC at protein and mRNA level, respectively. N-cadherin siRNA was transfected into EC9706 cells to inhibit the expression of N-cadherin. The effect of RNAi was detected by RT-PCR and Western blot. The invasive ability of EC9706 cells was determined by Transwell assay.
RESULTS: The expression of N-cadherin protein increased by turns in normal esophageal epithelia, adjacent atypical hyperplasia and carcinoma specimens, which was 29.0% (18/62), 61.3% (19/31), and 75.8% (47/62), respectively. There was a significant difference among the groups (P < 0.05). N-cadherin protein expression was related with the invasion, differentiation, and lymph node metastasis (P < 0.05). The expression of N-cadherin mRNA in ESCC was significantly higher than that in atypical hyperplasia and normal esophageal mucosa (0.6631 ± 0.0162 vs 0.4613 ± 0.0239, 0.1538 ± 0.0192; χ2 = 819.242, P < 0.01). N-cadherin mRNA expression was related with the differentiation, infiltration depth, and lymph node metastasis (P < 0.05). After RNAi , the expression of N-cadherin was significantly decreased in EC9706 cells, and the cell invasive abilitiy was also markedly decreased.
CONCLUSION: High-level expression of N-cadherin has a close relationship with the invasion and metastasis of ESCC. RNAi-induced down-regulation of N-cadherin may impair the invasive abilitiy of EC9706 cells.
- Citation: Li K, Wang X, He W, Lin N, Fan QX. Effects of N-cadherin expression on the invasion and metastasis of esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2325-2332
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2325.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2325
恶性肿瘤的侵袭和转移严重威胁着患者的生命. 钙黏附分子家族(cadherin family)和肿瘤的侵袭和转移密切相关, 其中以上皮性钙黏附蛋白(E-cadherin)和神经性钙黏附蛋白(N-cadherin)分布最广泛. 国内外已有许多研究表明食管鳞癌的浸润转移与E-cadherin的低表达或不表达有关[1-2]. 最近研究表明, 在前列腺癌, 乳腺癌中N-cadherin表达增多, 并且在引起肿瘤浸润转移方面有着比E-cadherin减少更为重要的作用[3-4]. N-cadherin对于肿瘤上皮细胞及表达N-cadherin的血管平滑肌细胞和外皮细胞之间的黏附起着重要的作用. 在肿瘤形成的过程中, N-cadherin 的表达有助于血管形成及上皮细胞-间质细胞的迁移, 从而使肿瘤细胞更加富于侵袭性, 易于转移[5].
鉴于上述, 本研究首先对食管鳞癌组织、癌旁不典型增生组织及正常食管黏膜组织中N-cadherin蛋白和mRNA的表达进行检测, 分析其与食管鳞癌临床诸病理因素的关系, 然后运用RNA干扰技术, 从RNA水平降低N-cadherin基因在人食管癌细胞系EC9706中的表达, 以观察N-cadherin基因表达下调对食管癌细胞系EC9706侵袭能力的影响, 从而为食管癌侵袭机制的研究提供新的思路, 并为其临床治疗提供新的靶点.
pEGFP-MSCVneo质粒和pMSCVneo/N-cadherin质粒(由协和医科大学马杰博士馈赠). pEGFP-MSCVneo质粒大小7.2 kb, 内含增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)基因序列和多克隆位点, 在细胞内表达后可发出绿色荧光. 原核细胞中的筛选标记为氨苄青霉素, 真核细胞中为新霉素. pMSCVneo/N-cadherin质粒大小为7.5 kb, 内含EGFP基因序列、U6启动子序列和多克隆位点等. 人食管癌细胞株EC9706由中科院提供. DH5α菌株(由郑州大学医学院重点分子医学实验室侯卫红博士馈赠). RNA提取试剂盒(美国Qiagen公司); RevertTM First Stand cDNA Synthesis Kit(加拿大MBI Fermentas公司); PCR试剂盒(上海生物工程公司); N-cadherin一抗(鼠抗人mAb, 美国Abcam公司); Matrigel matrix(美国BD公司); 脂质体Lipofectamine2000(美国Invitrogen公司); 新霉素G418(美国Gibco-BRL公司); 标准核酸分子量参照物: 100 bp DNA Ladder Marker(大连TaKaRa公司); 内对照β-actin引物、N-cadherin引物、MMP-9引物(上海生物工程公司); Transwell小室(美国Costar公司).
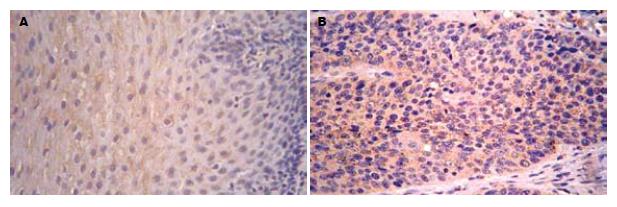
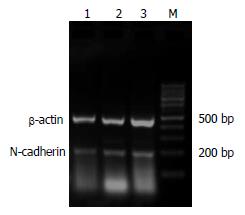
1.2.1 免疫组织化学法检测N-cadherin蛋白在食管鳞癌组织中的表达: (1)标本及处理, 62例食管鳞癌手术切除标本于2006-02-26/03-16取自安阳市肿瘤医院. 其中男36例, 女26例, 年龄38-75岁, 所有病例均病理学诊断明确, 且术前均无化疗、放疗及免疫治疗史. (2)免疫组织化学染色, 62例标本分别取无坏死癌灶、癌旁组织(距癌灶3 cm以内)及远端(距癌灶5 cm以上)正常黏膜组织(经HE染色证实, 癌旁组织中31例有不典型增生), 经40 g/L多聚甲醛固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4-6 μm. 62例均经组织学证实为鳞状细胞癌. 其中组织学分级Ⅰ级15例, Ⅱ级25例, Ⅲ级22例; 伴淋巴结转移者20例, 无淋巴结转移者42例. 浸润黏膜下层或浅肌层者7例, 浸润深肌层或外膜层者55例. 浓缩型鼠抗人神经型钙黏附蛋白mAb, 工作浓度1:110; 二步法免疫组化检测试剂(PV-9000); DAB显色增强剂. 染色方法严格参照免疫组化PV-9000试剂盒说明书进行操作, 以PBS液代替一抗作为阴性对照. (3)结果判断标准, 胞膜/胞质棕黄色染色为阳性, N-cadherin以胞质染色为主, 按着色强度和阳性细胞比例进行综合评分, 阳性比例30%以下为1分, 30%-60%为2分, 60%以上为3分, 着色程度: 无着色为0分(阴性), 浅黄色为1分(弱阳性), 棕黄色为2分(阳性), 棕褐色为3分(强阳性), 然后根据两者乘积的积分进行统计分析, 0-1分为阴性(-), 2-3分为弱阳性(+), ≥4分为阳性(++)[6]. (4)食管鳞癌组织中N-cadherin mRNA的RT-PCR检测, 取冰冻新鲜组织, 按试剂盒说明进行RT-PCR. 内对照β-actin上游引物: 5'-CATCCTGCGTCTGGACCT-3'; 下游引物5'-TCAGGAGGAGCAATGATCTTG-3'; PCR产物480 bp, N-cadherin上游引物: 5'-CAACTTGCCAGAAAACTCCAGG-3'; 下游引物5'-ATGAAACCGGGCTATCTGCTC-3'; PCR产物204 bp. 反应条件为: 94℃预变性5 min, 进入PCR循环: 95℃ 30 s, 62℃ 50 s, 72℃ 60 s, 35个循环后72℃延伸7 min. PCR产物行20 g/L琼脂糖凝胶电泳, 于紫外灯下观察照相. 采用德国Kontron公司IBAS2.0真彩图像分析仪对条带灰度值进行扫描分析.
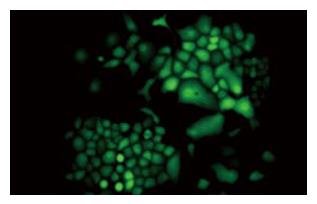
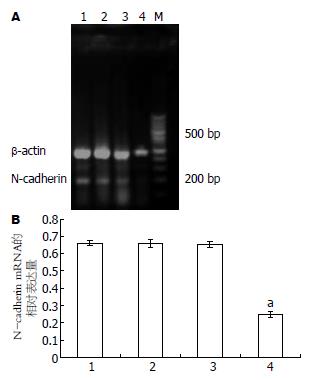
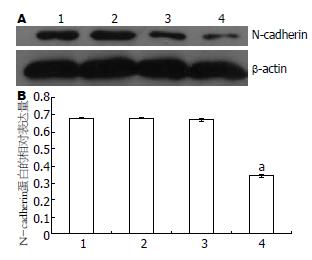
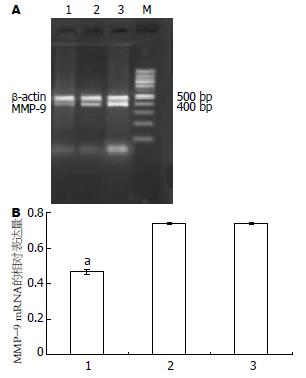
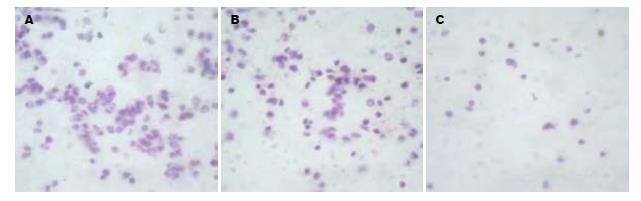
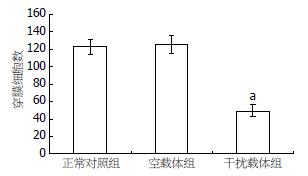
1.2.2 RNA干扰沉默N-cadherin基因在人食管癌细胞系EC9706中的表达及其对细胞体外侵袭能力的影响: (1)阳离子脂质体转染及抗性克隆的筛选和扩增. 将EC9706接种至6孔培养板中, 待其融合达90%-95%时, 用脂质体法对其进行转染(具体方法参照LipofectamineTM 2000说明书). 转染共分4组: 正常对照组、脂质体组、pEGFP-MSCVneo质粒组(空载体组)、pMSCVneo/N-cadherin质粒组(干扰载体组). 选用G418进行抗性克隆的筛选和扩增, 初选浓度为600 mg/L(由预实验得出), 10-15 d后降为300 mg/L, 继续维持10-15 d. 转染后的细胞每隔3-4 d在荧光显微镜下488 nm波长处观察荧光. (2)RT-PCR检测EC9706转染前后N-cadherin mRNA的表达, 选用正常对照组、空载体组、干扰载体组、乳腺癌细胞系435(阳性对照组)4组细胞, 按试剂盒说明进行RT-PCR. 内对照β-actin上游引物: 5'-CATCCTGCGTCTGGACCT-3'; 下游引物5'-TCAGGAGGAGCAATGATCTTG-3'; PCR产物480 bp, N-cadherin上游引物: 5'-CAACTTGCCAGAAAACTCCAGG-3'; 下游引物5'-ATGAAACCGGGCTATCTGCTC-3'; PCR产物204 bp. 反应条件为: 94℃预变性5 min, 进入PCR循环: 95℃ 30 s, 62℃ 50 s, 72℃ 60 s, 35个循环后72℃延伸7 min. PCR产物行20 g/L琼脂糖凝胶电泳, 于紫外灯下观察照相. 采用德国Kontron公司IBAS2.0真彩图像分析仪对条带灰度值进行扫描分析. (3)Western blotting检测转染前后N-cadherin的蛋白表达, 分别取正常对照组、空载体组、干扰载体组、阳性对照组4组细胞消化、PBS洗涤后, 用如下裂解液提取细胞总蛋白: 0.1 mol/L NaCL, 0.01 mol/L Tris-HCL(pH值为7.6), 0.001mol/L EDTA(pH值为8.0), 1 mg/L Aprotinin, 100 mg/L苯甲基磺酰胺(PMSF), PMSF不稳定, 用前现加. PMSF通常配制成10或100 mmol/L浓度的储存液(1.74 g或者17.4 g/L溶解于异丙醇中)保存于-20℃. 离心取上清, 用BCA试剂盒进行蛋白定量. 取等量蛋白60 μg上样于120 g/L聚丙烯酰胺凝胶, 再转移至硝酸纤维素膜, 膜于含5%脱脂奶粉的TBST中室温下封闭1 h, 加以封闭液稀释的N-cadherin兔抗人mAb(1:2000), 4℃过夜. 次日用TBST洗膜3×15 min, 加封闭液稀释的HRP标记的兔抗鼠IgG(1:500), 室温摇床温育1 h, TBST洗膜3×15 min, 加ECL试剂, 胶片(Kodak)曝光, 洗片. 采用德国Kontron公司IBAS2.0真彩图像分析仪对条带灰度值进行扫描分析. (4)RT-PCR检测EC9706转染前后MMP-9 mRNA的表达, 选用正常对照组、空载体组及干扰载体组3组细胞, 按试剂盒说明进行RT-PCR. 内对照β-actin同上, MMP-9上游引物: 5'-TGGAGTCACTGTACACCCTC-3'; 下游引物5'-CGGACATCCGCTAAACAGGT-3'; PCR产物400 bp. 反应条件为: 94℃预变性5 min, 进入PCR循环: 95℃ 30 s, 58℃ 50 s, 72℃ 60 s, 35个循环后72℃延伸7 min. PCR产物行20 g/L琼脂糖凝胶电泳, 于紫外灯下观察照相. 采用德国Kontron公司IBAS2.0真彩图像分析仪对条带灰度值进行扫描分析. (5)Transwell小室体外侵袭试验, 将冻存于-80℃冰箱的基质胶(matrigel)4℃过夜(24 h), 变成液态; 取300 μL无血清培养基, 加入60 μL(或50 μg/室)Matrigel, 混匀, (4℃操作, 最好在冰浴上), 加入上室各100 μL(3个室); 放入37℃培养箱中, 孵育4-5 h(>5 h); 此间经常观察, 当出现"白色层"时, 说明已经变为固态; 收获正常对照组、空载体组及干扰载体组三组细胞, 分别用不含胎牛血清的DMEM悬浮, 制备单细胞悬液, 将细胞密度调至5×108/L; 用无血清培养基洗Matrigel 1次; 每孔加入100 μL细胞悬液; 下腔室中加入500 μL含有200 mL/L FBS条件培养基; 37℃培养箱中, 孵育20-24 h; 弃去上室液体, 小心取出上室, 用湿棉签擦去膜上面未穿过膜的细胞, 用70%甲醇固定45 min, 未结合型苏木素染色5 min, 流水冲洗终止. 光学显微镜下观察迁徙至膜上的细胞, 每孔计数5个高倍镜视野(×100)中的细胞数总和, 求其平均值. 穿膜的细胞数目多少作为评价肿瘤细胞浸润能力强弱的指标.
统计学处理 所获实验数据均采用SPSS11.0版软件包进行统计学处理. 所有数据采用mean±SD表示, 多组均数间比较采用单因素方差进行统计分析. 检验水准α = 0.05.
N-cadherin阳性信号定位于细胞质, 呈黄色或棕黄色, 其在正常食管黏膜组织、癌旁不典型增生组织及癌组织中的表达依次升高29.0%(18/62)、61.3%(19/31)、75.8%(47/62), 组间比较差异有统计学意义(P<0.05, 图1, 表1). 与食管鳞癌分化程度、浸润转移的关系见表2.
| 病理学参数 | n | N-cadherin mRNA表达 | χ2 | P | N-cadherin蛋白表达 | χ2 | P | ||
| + | 相对含量 | + | 阳性率(%) | ||||||
| 正常黏膜上皮 | 62 | 21 | 0.1538±0.0192 | 18 | 29.0 | ||||
| 非典型增生 | 31 | 25 | 0.4613±0.0239 | 819.242 | 0.000 | 19 | 61.3 | 29.091 | 0.000 |
| 鳞癌 | 62 | 52 | 0.6631±0.0162 | 47 | 75.8 | ||||
| 病理特征 | N-cadherin mRNA表达 | N-cadherin蛋白表达 | |||||
| n | 相对含量 | F/t | P | 阳性(n, %) | χ2 | P | |
| 组织分级 | |||||||
| Ⅰ | 10 | 0.5664±0.0123 | 8(53.3) | ||||
| Ⅱ | 21 | 0.6408±0.0078 | 555.231 | 0.000 | 19(76.0) | 6.924 | 0.031 |
| Ⅲ | 21 | 0.7417±0.0064 | 20(90.9) | ||||
| 浸润深度 | |||||||
| 浅层 | 3 | 0.5814±0.0346 | 75.866 | 0.000 | 2(28.6) | 6.916 | 0.009 |
| 深层 | 49 | 0.7470±0.0140 | 45(81.8) | ||||
| 淋巴结转移 | |||||||
| 无 | 30 | 0.6857±0.0907 | 7.269 | 0.012 | 28(66.7) | 4.486 | 0.034 |
| 有 | 22 | 0.7835±0.1072 | 19(95.0) | ||||
N-cadherin mRNA RT-PCR扩增产物与预计一致, 其片段大小为204 bp, 内参β-actin片段大小为480 bp(图2). 扩增结果经凝胶灰度扫描而对N-cadherin mRNA表达进行定量, 在食管鳞癌癌变过程中N-cadherin在正常黏膜组织、癌旁不典型增生组织及癌组织中mRNA的含量依次增高, 组间比较差异有统计学意义(P<0.05, 表1). 不同临床病理特征患者食管组织中N-cadherin mRNA相对含量见表2.
转染24 h后在荧光显微镜下488 nm波长处观察, 空载体组及干扰载体组均可见明亮的绿色荧光, 胞质和胞核都有, 并可维持1 mo以上(图3). 正常对照组、脂质体组未见绿色荧光. 当G418以600 mg/L的初选浓度作用10-15 d后, 正常对照组、脂质体组细胞绝大部分死亡, 然后将G418浓度降为300 mg/L维持, 10-15 d后正常对照组、脂质体组细胞全部死亡, 从而得到稳定表达EGFP的EC9706, 后续培养中仍用300 mg/L的G418维持.
4种细胞均扩出480 bp的β-actin内参带, 阳性对照组、正常对照组和空载体组细胞均可见清晰的约204 bp的N-cadherin目的条带, 而干扰载体组细胞的目的条带亮度明显减弱, 差异有统计学意义(P<0.05, 图4).
空载体组中N-cadherin的蛋白表达与正常对照组相比无明显变化, 而干扰载体组中N-cadherin的蛋白表达与正常对照组相比则明显降低, 差异有统计学意义(P<0.05, 图5).
3组细胞均扩出480 bp的β-actin内参带, 正常对照组和空载体组细胞均可见清晰的约400 bp的MMP-9目的条带, 而干扰载体组细胞的目的条带亮度减弱, 差异有统计学意义(P<0.05, 图6).
N-cadherin在食管鳞癌组织中的表达及其临床病理意义, 目前已知的与肿瘤转移有关的黏附分子可分为5类: 整合素家族、选择素家族、免疫球白超家族、钙黏附蛋白家族和未归类的黏附分子. 钙黏附分子家族由一系列结构和功能相似的单链跨膜糖蛋白组成. 经典的钙黏附蛋白按其最初来源分为: E-cadherin(上皮型)、N-cadherin(神经型)、P-cadherin(胎盘型)3种, 分子质量均约为120 kDa, 主要参与介导钙离子依赖的同型细胞间的黏附. 该家族的特点是既可以作为受体, 又可以作配体按嗜同类结合方式而相互结合, 对细胞识别、迁徙、归类行为及在维持正常组织结构方面起着重要作用, 参与调节组织发生和形态分化[7].
最近研究表明[3-4], N-cadherin在乳腺癌、前列腺癌的表达增多, 并且在引起肿瘤的浸润和转移方面有比E-cadherin的减少更为重要的作用. Utsuki et al[8]发现在脑胶质母细胞瘤和星形细胞瘤中N-cadherin的表达增加, 并且和肿瘤的病理分级相关, 而E-cadherin的表达减少. Makagiansar et al[9]发现N-cadherin可以增加恶性T细胞瘤对上皮细胞的黏附力, 使其更容易发生转移.
本研究结果显示, 随着食管鳞癌浸润深度增加、分化程度降低及发生转移N-cadherin蛋白的阳性表达率增加, 且差异均有统计学意义(P<0.05). RT-PCR结果亦证实: 在正常食管黏膜、癌旁不典型增生及食管鳞状细胞癌组织中均发现N-cadherin mRNA的表达, 但3组间N-cadherin mRNA相对含量比较, 差异有统计学意义(χ2 = 819.242, P<0.01). 不同分化程度、不同浸润深度及有无淋巴结转移的食管鳞状细胞癌组织之间N-cadherin mRNA相对含量差异均有统计学意义(P<0.05), 从而提示N-cadherin可以作为食管鳞癌浸润转移的预测指标.
RNA干扰沉默N-cadherin基因在人食管癌细胞系EC9706中的表达及其对细胞体外侵袭能力的影响. 为了进一步验证N-cadherin基因表达与食管癌浸润、转移的关系, 本研究将N-cadherin 基因的RNA干扰载体pMSCVneo/N-cadherin质粒稳定转染至人食管癌细胞系EC9706, RT-PCR和Western blotting结果显示: 稳定转染干扰载体的EC9706中N-cadherin的mRNA和蛋白表达水平均明显下降, 同时通过Transwell小室体外侵袭实验证明, 伴随着N-cadherin的mRNA和蛋白表达水平的下降, EC9706的体外侵袭能力也随之下降.
肿瘤细胞的浸润和转移包括肿瘤细胞通过黏附作用脱离原发灶, 移动到基底膜, 降解细胞外基质, 突破组织屏障结构, 局部浸润或远距离及全身组织扩散, 而N-cadherin对于肿瘤上皮细胞及表达N-cadherin的血管平滑肌细胞和外皮细胞之间的黏附起着重要的作用. 在肿瘤形成的过程中, N-cadherin的表达有助于血管形成及上皮细胞-间质细胞的迁移, 从而使肿瘤细胞更加富于侵袭性, 易于转移[5]. Nieman et al[10]将外源性N-cadherin基因转入E-cadherin表达阳性的乳腺癌细胞, 尽管转染后的细胞E-cadherin表达仍为阳性, 但细胞的迁移和侵袭能力却得以加强.
对于N-cadherin表达下调导致人食管癌细胞EC9706的体外侵袭能力下降的可能机制本研究也进行了初步探讨. Suyama et al[5]的研究发现N-cadherin的增加可以通过FGF激活MAPK- ERK信号转导途径, 诱导MMP-9基因表达, 有利于肿瘤血管的形成, 使肿瘤易于生长和转移. 基质金属蛋白酶(matrix metal loproteinases, MMPs)是一组结构中含Zn2+和Ca2+的蛋白水解酶家族, MMP-9的主要底物均为Ⅳ/Ⅴ型胶原, 故也称为Ⅳ型胶原酶(明胶酶). Ⅳ型胶原为基底膜中结构蛋白, 对维持基底膜的完整性至关重要. 由于Ⅳ型胶原独特的螺旋结构, 因此大部分蛋白酶对其无降解作用, 但MMP-9可以降解Ⅳ型胶原和层粘连蛋白等成分, 破坏基底膜的完整性[11-14], 这是肿瘤浸润和转移的先决条件. 为此, 本研究通过RT-PCR检测了转染前后EC9706中MMP-9的mRNA表达水平的变化, 结果表明, 伴随着N-cadherin的mRNA和蛋白表达水平的下降, EC9706中MMP-9 mRNA表达水平也随之下降, 从而提示, N-cadherin的表达下调可能通过下调MMP-9的表达, 降低细胞对细胞外基质的降解能力, 进而降低细胞的体外侵袭能力. 至于N-cadherin是如何通过MMP-9发挥作用, 尚需进一步的研究.
总之, 本研究首先从mRNA和蛋白水平证实N-cadherin与食管鳞状细胞癌的发生、侵袭及转移有关; 然后又通过RNA干扰技术, 使得人食管癌细胞系EC9706中N-cadherin mRNA和蛋白表达水平下调, 同时MMP-9 mRNA表达水平也随之下调, 伴随着两者表达的下调, 人食管癌细胞系EC9706的体外侵袭能力也随之下降, 从而提示, 食管癌的侵袭、转移可能是N-cadherin和MMP-9共同作用的结果, 为食管癌侵袭机制的研究提供新的思路, 并为其临床治疗提供新的靶点.
钙黏附分子家族(cadherin family)和肿瘤的侵袭转移密切相关, 其中以上皮性钙黏附蛋白(E-cadherin)和神经性钙黏附蛋白(N-cadherin)分布最广泛. 国内外已有许多研究表明食管鳞癌的浸润转移与E-cadherin的低表达或不表达有关. 最近研究表明, 在前列腺癌, 乳腺癌中N-cadherin表达增多, 并且在引起肿瘤浸润转移方面有着比E-cadherin减少更为重要的作用.
李瑗, 教授, 广西肿瘤研究所; 陈公琰, 主任医师, 哈尔滨医科大学附属肿瘤医院内一科.
关于N-cadherin介导的肿瘤细胞浸润、转移的具体机制已成为研究的热点.
国内外研究表明, 前列腺癌、直肠癌、乳腺癌等N-cadherin基因表达量与肿瘤的侵袭力成正相关, N-cadherin基因可能通过MAPK- ERK等信号转导途径促进肿瘤细胞的浸润转移.
本研究首次采用免疫组织化学PV法和RT-PCR检测了N-cadherin在食管鳞癌组织中的表达; 在研究N- cadherin的作用机制时, 首次采用了RNA干扰技术, 通过降低N-cadherin在EC9706细胞中的表达来分析其对细胞侵袭力的影响.
本研究为食管癌侵袭机制的研究提供新的思路, 并为其临床治疗提供新的靶点.
Transwell小室体外侵袭试验: 将Transwell小室放入培养板中, 小室内称上室, 培养板内称下室, 上室内盛装上层培养液, 下室内盛装下层培养液, 上下层培养液以聚碳酸酯膜相隔. 先在膜上涂一层基质胶, 模拟细胞外基质, 然后将细胞种在上室内, 由于聚碳酸酯膜有通透性, 下层培养液中的成分可以影响到上室内的细胞, 从而可以研究下层培养液中的成分对细胞生长、运动等的影响.
本研究的内容是肿瘤治疗领域较为重要的一个方面, 有较好的前沿性、新颖性, 也符合伦理学要求, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Uchikado Y, Natsugoe S, Okumura H, Setoyama T, Matsumoto M, Ishigami S, Aikou T. Slug Expression in the E-cadherin preserved tumors is related to prognosis in patients with esophageal squamous cell carcinoma. Clin Cancer Res. 2005;11:1174-1180. [PubMed] |
| 2. | Nair KS, Naidoo R, Chetty R. Microsatellite analysis of the APC gene and immunoexpression of E-cadherin, catenin, and tubulin in esophageal squamous cell carcinoma. Hum Pathol. 2006;37:125-134. [PubMed] [DOI] |
| 3. | Jaggi M, Nazemi T, Abrahams NA, Baker JJ, Galich A, Smith LM, Balaji KC. N-cadherin switching occurs in high Gleason grade prostate cancer. Prostate. 2006;66:193-199. [PubMed] [DOI] |
| 4. | Nagi C, Guttman M, Jaffer S, Qiao R, Keren R, Triana A, Li M, Godbold J, Bleiweiss IJ, Hazan RB. N-cadherin expression in breast cancer: correlation with an aggressive histologic variant--invasive micropapillary carcinoma. Breast Cancer Res Treat. 2005;94:225-235. [PubMed] [DOI] |
| 5. | Suyama K, Shapiro I, Guttman M, Hazan RB. A signaling pathway leading to metastasis is controlled by N-cadherin and the FGF receptor. Cancer Cell. 2002;2:301-314. [PubMed] [DOI] |
| 8. | Utsuki S, Sato Y, Oka H, Tsuchiya B, Suzuki S, Fujii K. Relationship between the expression of E-, N-cadherins and beta-catenin and tumor grade in astrocytomas. J Neurooncol. 2002;57:187-192. [PubMed] [DOI] |
| 9. | Makagiansar IT, Yusuf-Makagiansar H, Ikesue A, Calcagno AM, Murray JS, Siahaan TJ. N-cadherin involvement in the heterotypic adherence of malignant T-cells to epithelia. Mol Cell Biochem. 2002;233:1-8. [PubMed] [DOI] |
| 10. | Nieman MT, Prudoff RS, Johnson KR, Wheelock MJ. N-cadherin promotes motility in human breast cancer cells regardless of their E-cadherin expression. J Cell Biol. 1999;147:631-644. [PubMed] [DOI] |
| 11. | Curran S, Murray GI. Matrix metalloproteinases in tumour invasion and metastasis. J Pathol. 1999;189:300-308. [PubMed] [DOI] |
| 12. | Rajapakse N, Kim MM, Mendis E, Huang R, Kim SK. Carboxylated chitooligosaccharides (CCOS) inhibit MMP-9 expression in human fibrosarcoma cells via down-regulation of AP-1. Biochim Biophys Acta. 2006;1760:1780-1788. [PubMed] |
| 13. | Egeblad M, Werb Z. New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer. 2002;2:161-174. [PubMed] [DOI] |
| 14. | Sheu BC, Lien HC, Ho HN, Lin HH, Chow SN, Huang SC, Hsu SM. Increased expression and activation of gelatinolytic matrix metalloproteinases is associated with the progression and recurrence of human cervical cancer. Cancer Res. 2003;63:6537-6542. [PubMed] |