修回日期: 2008-04-16
接受日期: 2008-04-21
在线出版日期: 2008-07-18
目的: 探讨多烯紫杉醇及顺铂联合腹腔化疗治疗进展期胃癌的疗效.
方法: 对45例进展期胃癌患者进行多烯紫杉醇及顺铂联合腹腔化疗, 比较腹腔化疗前后两组肿瘤体积大小、血常规、肝肾功的变化, 观察腹腔化疗术后的不良反应, 并对所有患者进行随访观察其生存时间.
结果: 腹腔化疗后胃癌体积明显缩小(72.4±22.4 cm3vs 7.23±2.4 cm3, t = 2.946, P<0.01), 患者中位生存期为14.0±1.4 mo, 对癌性腹水近期有效率为59%. 腹腔化疗对患者血常规、肝肾功能中部分指标有一定影响, 主要不良反应为脱发、口腔炎、便秘及血尿.
结论: 多烯紫杉醇及顺铂联合腹腔化疗治疗胃癌疗效好, 能明显缩小肿瘤体积, 延长患者生存期, 减少癌性腹水, 且操作方便, 不良反应少.
引文著录: 郭花, 朱金水, 张强, 达炜, 孙群, 陈尼维. 胃癌癌变过程中Smad4表达的变化及其与临床病理特征的关系. 世界华人消化杂志 2008; 16(20): 2304-2307
Revised: April 16, 2008
Accepted: April 21, 2008
Published online: July 18, 2008
AIM: To investigate the therapeutic efficacy of peritoneal chemotherapy in combination with tocetaxel and cisplatin for advanced gastric cancer.
METHODS: Forty-five cases of advanced gastric cancer were treated with tocetaxel in combination with cisplatin by peritoneal chemotherapy. The tumor size, blood routine examination, hepatic and renal function were compared before and after peritoneal chemotherapy. The side effects were observed. All patients were followed-up and their survival time was recorded.
RESULTS: The tumor sizes of gastric cancer were decreased dramatically (72.4 ± 22.4 cm3vs 7.23 ± 2.4 cm3, t = 2.946, P < 0.01). The average survival time was 14.0 ± 1.4 months, and the short-term therapeutic efficacy was 59%. The peritoneal chemotherapy affected some indexes in blood routine examination, hepatic and renal function. The main side effects included hair loss, stomatitis, constipation and blood urine.
CONCLUSION: Peritoneal chemotherapy in combination with tocetaxel and cisplatin reduces the tumor size effectively, prolongs the survival period, and alleviates the tumor ascites in patients with advanced gastric cancer. It's convenient and safe for advanced gastric cancer treatment.
- Citation: Guo H, Zhu JS, Zhang Q, Da W, Sun Q, Chen NW. Treatment of peritoneal chemotherapy in combination with tocetaxel and cisplatin for advanced gastric cancer: an analysis of 45 cases. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2304-2307
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2304.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2304
胃癌是最常见的消化道恶性肿瘤, 确诊时大多数已进入胃癌进展期, 手术切除仍是胃癌的主要治疗手段, 尽管能进行广泛淋巴结清除的胃癌根治术, 但术后复发率高达50%-70%, 术后5年生存率仅20%-50%[1]. 侵袭和转移是导致胃癌患者死亡的最主要原因, 而导致根治术失败的主要原因是手术时腹腔已存在微小转移灶[2], 因此, 消灭腹腔游离癌细胞成为治疗进展期胃癌的关键问题[3]. 腹腔内化疗(intraperitoneal chemotherapy, IPC)是近年新出现的一种高选择性局部化疗方法, 已作为进展期胃癌的辅助治疗手段逐渐应用于临床[4-5], 腹腔内化疗能提高肿瘤局部药物浓度、减轻化疗药物毒性作用. 传统静脉化疗毒副作用较大, 多数晚期胃癌患者体质差, 免疫功能低下, 难以耐受[6]. 与传统周围静脉化疗法相比, 具有明显的药代动力学优势.
1998-03/2006-02我院消化内科收治进展期胃癌患者45例, 行多烯紫杉醇及顺铂联合腹腔化疗, 其中男性30例, 女性15例, 年龄32-75(平均年龄56.2±1.7)岁, 所有患者均经病理学证实为低分化腺癌、管状腺癌或未分化腺癌, 影像学检查未发现肝、肺、脑等转移, 且原发肿瘤无法手术切除或拒绝手术者. 所有病例Karnofsky评分大于50分, 且不伴有严重的心、肝、肺、肾等重要脏器疾病. 所有患者进行多烯紫杉醇及顺铂联合腹腔化疗, 进行腹腔化疗前后比较.
患者排空膀胱后取仰卧位, 取左髂前上棘与脐连线中外1/3处为穿刺点, 常规消毒铺巾后, 20 g/L利多卡因逐层麻醉, 依次注入化疗药物多烯紫杉醇200 mg及顺铂40 mg. 结束后嘱患者不断变换体位, 使化疗药物在腹腔内均匀分布. 1 mo后进行第二次腹腔化疗, 共行2次腹腔化疗. 第1次腹腔化疗前及第2次腹腔化疗后查患者血常规、肝肾功, 并采用超声胃镜测定肿瘤大小, 肿瘤体积 = a×b2×0.5(a: 肿瘤最大径, b: 前者垂直径). 根据B超结果估计腹水量, 并参照WHO实体肿瘤近期疗效的分级标准进行评定, 完全缓解(CR): 治疗后腹水完全消失, 并维持30 d以上; 部分缓解(PR): 腹水减少50%以上, 并维持4 wk以上; 轻度缓解(MR): 腹水减少在25%-50%之间; 稳定(SD): 腹水无明显增加或减少不超过25%. 以CR+PR为有效. 每次腹腔化疗结束后监测患者血压、心率、呼吸等, 观察腹胀腹泻、便秘、口腔炎、皮肤、头发、周围神经炎、神志等发生情况. 对所有患者进行随访, 观察其存活时间.
统计学处理 采用SPSS11.5统计软件包进行t检验, 以P<0.05为差异有统计学意义, 用Kaplan-Meier法计算患者生存率及中位生存期.
给予腹腔化疗后患者原发病灶肿瘤体积明显缩小, 由治疗前的72.4±22.4 cm3缩小到化疗后的7.23±2.4 cm3, 两组间比较有统计学差异(t = 2.946, P<0.01).
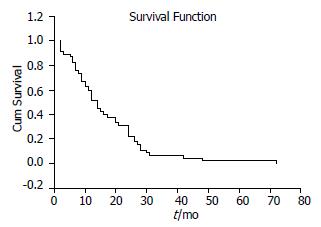
本组患者存活时间为2-72 mo, 中位生存期为14.0±1.4 mo, 其半年生存率为86.7%(39/45), 1年生存率为62.2%(28/45), 2年生存率为31.1%(14/45), 生存曲线见图1.
本组45例患者中, 治疗前有腹水者27例, 腹腔化疗后腹水消退情况: 完全缓解3例, 部分缓解13例, 轻度缓解4人, 稳定7人, 近期有效率为59%.
化疗后组患者白细胞、中性粒细胞、血小板较化疗前有所下降, 各组间差异有统计学意义. 但腹腔化疗对患者血红蛋白没有影响, 化疗前组与化疗后组血红蛋白差异无统计学意义.
将腹腔化疗前肝功能中AST/ALT比值与化疗后AST/ALT比值进行比较, 两组间无统计学差异(P>0.05). 化疗后血清TBIL有所升高, 与化疗前相比其差异有统计学意义(P<0.01). 腹腔化疗后患者血清BUN及Cr较化疗前略有升高, 其差异有统计学意义(P<0.05).
腹腔化疗后的主要不良反应为脱发30例(67%)、口腔炎32例(71%), 便秘9例(20%), 血尿7例(16%), 周围神经炎1例(2%), 腹腔化疗前后两组患者心功能、肺毒性症状、蛋白尿、腹胀、腹泻、神志改变、皮肤等方面比较没有统计学差异(P>0.05).
腹腔化疗常用于胃癌、结肠癌术后的辅助治疗, 术中或术后早期应用腹腔化疗能有效防止肿瘤切除术后肿瘤细胞在腹腔脏器表面或腹膜表面种植, 杀灭已存在的微小转移灶, 控制癌性腹水增长, 延缓病情进展[7]. 有学者对胃癌腹腔化疗方法进行连续性、多中心、随机、双盲的Meta分析后得出以下结论: 对胃癌术后患者进行腹腔化疗是有益的[8].
本实验发现胃癌腹腔化疗后患者胃癌肿瘤体积明显缩小、腹水明显消退, 这与腹腔化疗独特的药代动力学有直接关系, 系由于存在血浆-腹膜屏障, 腹腔内化疗药物高浓度、长时间存在, 能更好的抑制腹腔内胃癌肿瘤的生长. Marchettini研究发现通过ip给予多烯紫杉醇(Docetaxel)90 min后, 腹水中多烯紫杉醇的药物浓度是静脉给药时药物浓度的2500倍, 腹水中药物时间曲线下面积(AUC)是血浆AUC的976倍, 腹腔给药后腹壁、胃、结肠组织中的药物浓度也明显高于静脉给药时的浓度[9]. Miyagi et al[10]实验发现用ip和静脉注射两种不同的方式给予卡铂后, 24 h时腹腔给药的AUC值比静脉给药的AUC高17倍. 此外, 化疗药物经毛细血管和淋巴管吸收后, 通过门静脉进入肝脏, 增加门静脉内药物浓度, 作用于门脉系统中癌细胞和肝实质内的微小转移灶, 抑制肿瘤生长[11].
本实验中应用的多西紫杉醇被认为是胃癌的治疗药物中最有希望的药物之一, 其单独用药或联合用药均有较好疗效. Yonemura et al[12]研究表明给裸鼠种植具有高腹膜转移性的MKN-45细胞后, 再ip多西紫杉醇能明显延长小鼠的生存期. Ⅱ期临床试验表明多西紫杉醇与顺铂联合应用能提高反应率[13]. 目前DCF方案(多西紫杉醇、顺铂、氟尿嘧啶)是美国FDA及欧洲批准的进展期胃癌的一线治疗方案[14]. Cntosem et al将CF方案与现有治疗胃癌的标准DCF方案进行Ⅲ期临床试验比较, 结果发现DCF方案能显著提高反应率, 明显延长中期生存时间[15].
本实验中多烯紫杉醇和顺铂联合腹腔化疗的主要不良反应包括骨髓抑制、白细胞减少、口腔炎、脱发等. 骨髓抑制一般较轻, 可通过给予集落细胞刺激因子提高白细胞水平. 实验还发现, 胃癌患者腹腔化疗前后一过性心、肺、肾功能、腹胀、腹泻、便秘、神志改变、周围神经炎、皮肤等不良反应发生率低, 且两组间差异没有统计学意义, 这可能与化疗药物通过肝脏的首过消除效应后, 代谢成为无毒或低毒形式再进入体循环, 能减轻全身不良反应、提高机体耐受能力有关. 经笔者多年研究发现, 为了预防化疗后的不良反应, 在载体液中加入适量利多卡因能起到局部麻醉作用, 加入地塞米松能减少化疗药对腹膜的刺激、预防肠黏连、减轻胃肠道反应.
腹腔化疗作为胃癌一种新辅助治疗手段越来越受到人们的重视, 其药代动力学方面的优势特点显示了其独特的优越性. 该方法操作简单安全, 全身毒性作用小, 并发症少, 联合应用多烯紫杉醇及顺铂对预防和减少胃癌术后腹腔内复发和转移、有效控制癌性腹水和提高患者生存率方面有一定价值.
腹腔内化疗是近年新出现的一种高选择性局部化疗方法, 作为进展期胃癌的辅助治疗手段已逐渐应用于临床.
唐晓鹏, 教授, 中南大学肝病研究所/中南大学湘雅二医院感染科
Xu et al通过连续、多中心、随机、双盲的Meta分析后得出以下结论: 对胃癌术后患者进行腹腔化疗是有益的.
腹腔化疗操作简单安全, 全身毒性作用小, 并发症少, 联合应用多烯紫杉醇及顺铂在预防和减少胃癌术后腹腔内复发和转移、控制癌性腹水和提高患者生存率方面有一定价值.
本研究内容立足临床, 实用性较强, 立题新颖, 有一定的学术价值.
编辑: 李军亮 电编:郭海丽
| 1. | Ajani JA. Evolving chemotherapy for advanced gastric cancer. Oncologist. 2005;10 Suppl 3:49-58. [PubMed] [DOI] |
| 2. | Zhu JS, Song MQ, Chen GQ, Li Q, Sun Q, Zhang Q. Molecular mechanisms of paclitaxel and NM-3 on human gastric cancer in a severe combined immune deficiency mice orthotopic implantation model. World J Gastroenterol. 2007;13:4131-4135. [PubMed] |
| 3. | Sugarbaker PH. Adjuvant intraperitoneal chemotherapy for advanced primary gastric cancer. Scand J Surg. 2006;95:270-273. [PubMed] |
| 4. | Sastre J, Garcia-Saenz JA, Diaz-Rubio E. Chemotherapy for gastric cancer. World J Gastroenterol. 2006;12:204-213. [PubMed] |
| 5. | Allal AS, Zwahlen D, Brundler MA, de Peyer R, Morel P, Huber O, Roth AD. Neoadjuvant radiochemotherapy for locally advanced gastric cancer: long-term results of a phase I trial. Int J Radiat Oncol Biol Phys. 2005;63:1286-1289. [PubMed] [DOI] |
| 6. | Chan DC, Liu YC, Chen CJ, Yu JC, Chu HC, Chen FC, Chen TW, Hsieh HF, Chang TM, Shen KL. Preventing prolonged post-operative ileus in gastric cancer patients undergoing gastrectomy and intra-peritoneal chemotherapy. World J Gastroenterol. 2005;11:4776-4781. [PubMed] |
| 7. | Sugarbaker PH, Yu W, Yonemura Y. Gastrectomy, peritonectomy, and perioperative intraperitoneal chemotherapy: the evolution of treatment strategies for advanced gastric cancer. Semin Surg Oncol. 2003;21:233-248. [PubMed] [DOI] |
| 8. | Xu DZ, Zhan YQ, Sun XW, Cao SM, Geng QR. Meta-analysis of intraperitoneal chemotherapy for gastric cancer. World J Gastroenterol. 2004;10:2727-2730. [PubMed] |
| 9. | Marchettini P, Stuart OA, Mohamed F, Yoo D, Sugarbaker PH. Docetaxel: pharmacokinetics and tissue levels after intraperitoneal and intravenous administration in a rat model. Cancer Chemother Pharmacol. 2002;49:499-503. [PubMed] [DOI] |
| 10. | Miyagi Y, Fujiwara K, Kigawa J, Itamochi H, Nagao S, Aotani E, Terakawa N, Kohno I. Intraperitoneal carboplatin infusion may be a pharmacologically more reasonable route than intravenous administration as a systemic chemotherapy. A comparative pharmacokinetic analysis of platinum using a new mathematical model after intraperitoneal vs. intravenous infusion of carboplatin--a Sankai Gynecology Study Group (SGSG) study. Gynecol Oncol. 2005;99:591-596. [PubMed] [DOI] |
| 11. | Newman E, Potmesil M, Ryan T, Marcus S, Hiotis S, Yee H, Norwood B, Wendell M, Muggia F, Hochster H. Neoadjuvant chemotherapy, surgery, and adjuvant intraperitoneal chemotherapy in patients with locally advanced gastric or gastroesophageal junction carcinoma: a phase II study. Semin Oncol. 2005;32:S97-S100. [PubMed] [DOI] |
| 12. | Yonemura Y, Endou Y, Bando E, Kuno K, Kawamura T, Kimura M, Shimada T, Miyamoto K, Sasaki T, Sugarbaker PH. Effect of intraperitoneal administration of docetaxel on peritoneal dissemination of gastric cancer. Cancer Lett. 2004;210:189-196. [PubMed] [DOI] |
| 13. | Roth AD, Ajani J. Docetaxel-based chemotherapy in the treatment of gastric cancer. Ann Oncol. 2003;14 Suppl 2:ii41-ii44. [PubMed] [DOI] |
| 14. | Van Cutsem E, Moiseyenko VM, Tjulandin S, Majlis A, Constenla M, Boni C, Rodrigues A, Fodor M, Chao Y, Voznyi E. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol. 2006;24:4991-4997. [PubMed] [DOI] |
| 15. | Ajani JA, Moiseyenko VM, Tjulandin S, Majlis A, Constenla M, Boni C, Rodrigues A, Fodor M, Chao Y, Voznyi E. Clinical benefit with docetaxel plus fluorouracil and cisplatin compared with cisplatin and fluorouracil in a phase III trial of advanced gastric or gastroesophageal cancer adenocarcinoma: the V-325 Study Group. J Clin Oncol. 2007;25:3205-3209. [PubMed] [DOI] |