修回日期: 2008-05-22
接受日期: 2008-05-27
在线出版日期: 2008-07-18
目的: 探讨survivin表达情况与食管鳞癌原发灶的放化疗反应的关系.
方法: 用免疫组化法检测112例食管鳞癌中survivin的表达情况, 回顾性分析胞质和胞核的survivin表达与放化疗近期疗效及放化疗后降期情况的关系.
结果: survivin的表达可见于肿瘤细胞的胞质或/和胞核内, 其中胞核表达率为67.8%, 胞质表达率为65.2%; 胞质survivin表达与近期疗效无明显关系, 而胞核survivin阴性者放化疗的中期有效率明显高于阳性者(80.6% vs 46.1%, P = 0.026). 术前放化疗组中, 核survivin阳性者与阴性者放化疗后降期的比例分别为7/17和4/4.
结论: 检测核survivin的表达情况可能作为预测食管鳞癌对放化疗疗效的有效参考指标.
引文著录: 黄伟钊, 刘孟忠, 胡祎, 杨弘, 郑斌, 王耿, 罗孔嘉, 文静, 傅剑华. 食管鳞癌survivin表达与放化疗近期疗效的关系. 世界华人消化杂志 2008; 16(20): 2295-2299
Revised: May 22, 2008
Accepted: May 27, 2008
Published online: July 18, 2008
AIM: To investigate the relationship between survivin expression and the chemoradiotherapy (CRT) response in esophageal squamous cell carcinoma (ESCC).
METHODS: The expression of survivin in 112 cases of ESCC tissues were detected using immunohistochemistry (IHC). Relation between survivin expression (including nucleus and cytoplasm expression) and short-term response as well as its relationship with downstage rate of CRT were analyzed retrospectively.
RESULTS: Survivin expression was noted in ESCC cytoplasm and nucleus with 65.2% and 67.8% expression rates respectively. Survivin expressed in cytoplasm was not correlated to short-term response, but the response of patients with nuclear survivin expression was significantly lower than that with nuclear negative expression (46.1% vs 80.6%, P = 0.026). In neoadjuvant CRT group, downstage rates of patients with positive and negative nuclear survivin were 7/17 and 4/4 respectively.
CONCLUSION: Assessment of nuclear survivin could provide additional information to identify ESCC patients with poor chances of response to CRT and candidates for more individualized treatment.
- Citation: Huang WZ, Liu MZ, Hu Y, Yang H, Zheng B, Wang G, Luo KJ, Wen J, Fu JH. Relationship between survivin expression and chemoradiotherapy response in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2295-2299
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2295.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2295
食管鳞癌是我国常见的恶性肿瘤之一. 新辅助性和根治性的同期放化疗都已经成为食管鳞癌标准治疗中的重要组成部分. 但不同的患者对放化疗的敏感性也不同, 仅对放化疗有反应的患者才能从中获益, 所以, 寻找分子生物学指标作为个体化治疗的依据, 至关重要. survivin是近年发现的一种新的凋亡抑制蛋白, 与多种肿瘤的预后相关[1-3], 还与肿瘤的放化疗敏感性有关, 可能成为肿瘤诊断和治疗的新靶点[4]. 本研究旨在通过对接受同期放化疗的一组食管鳞癌病例进行回顾性研究, 从临床疗效和病理学改变两个层面探讨survivin表达情况与食管鳞癌原发灶的放化疗反应之间的关系.
收集中山大学肿瘤医院2001-01/2006-06连续收治的接受同期放化疗的食管鳞癌病例, 入选病例共112例, 其中接受根治性放化疗91例, 术前放化疗+手术21例. 其中男性98例, 女性14例, 男: 女为7:1; 年龄37-76(平均年龄为56.6±9.1)岁; 肿瘤位于颈段15例, 胸上段34例, 胸中段51例, 胸下段7例, 多发病灶5例; 高分化16例, 中分化58例, 低分化38例; 治疗前临床分期Ⅱa期24例, Ⅱb期2例, Ⅲ期64例, Ⅳ期22例(其中Ⅳa期7例, Ⅳb期15例, 均为非区域淋巴结转移). 病例选择标准: A: 经病理学确诊为食管鳞癌的初治患者; B: 无远处器官转移(包括非区域淋巴结转移者); C: 治疗前均行食管镜活检, 标本符合实验检测的要求; D: 按既定方案完成治疗计划, 并可评价疗效; E: 既往无使用放化疗增敏剂.
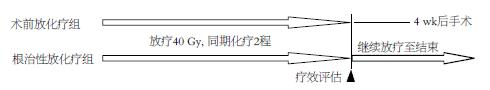
全组病例均行两程化疗, 同期放疗, 常规分割, 连续放疗. 其中根治性同期放化疗91例, 化疗均采用PF方案(DDP 20 mg/(m2·d), D1-D5, D22-D26; 5-FU 800 mg/(m2·d) D1-D3, D22-D24). 原发灶实际放疗剂量54-70 Gy, 平均63.5±4.3 Gy. 术前放化疗并手术21例, 化疗采用PF方案(同根治性放化疗组); 原发灶实际放疗剂量均为40 Gy. 放化疗结束后4 wk进行手术, 手术均采用经右胸、上腹食管大部分切除、食管胃左颈吻合术(三切口), 并常规行二野淋巴结清扫, 均为根治性切除(图1).
1.2.1 疗效评估: 于放疗剂量达到40 Gy及完成两程化疗后进行疗效评价, 本研究中称为中期疗效, 此时两组患者接受的放化疗剂量相等, 故予以合并分析. 通过检查食管吞钡、CT检查, 采用RECIST(response evaluation criteria in solid tumors, RECIST)标准[5]进行评价. 具体标准如下: 完全缓解(CR): 食管吞钡示原发灶消失, 食管壁柔软, 钡剂通过顺利, 胸部CT扫描食管壁厚度<5 mm, 原肿大淋巴结消失, 无新病灶出现; 部分缓解(PR): 根据食管吞钡、胸部CT扫描测得食管原发灶基线最长径减少≥30%; 疾病稳定(SD): 根据食管吞钡、胸部CT扫描测得食管原发灶基线减少未达PR, 或增大未达PD; 疾病进展(PD): 根据食管吞钡、胸部CT扫描测得食管原发灶基线最长径总和增大≥20%, 或出现一个或多个新病灶.
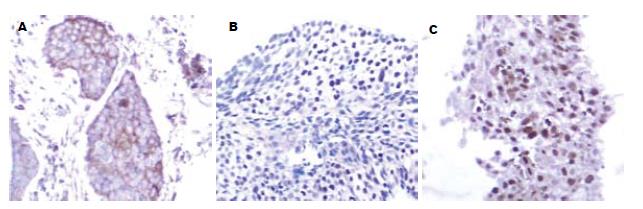
1.2.2 免疫组化方法: 取治疗前肿瘤原发灶的活检标本; 一抗采用survivin兔抗人mAb, 购自北京中杉公司编号: ZA-0458. 通用型SP系列工作液试剂盒(北京中杉生物技术公司, 编号: SP-9000). 采用SP免疫组化方法, 主要步骤: 石蜡切片, 常规脱蜡水化, 微波修复抗原15 min, 3% H2O2浸泡10 min, 3%正常羊血清孵育20 min, 依次加一抗4℃过夜, 二抗(生物素标记)37℃ 30 min, 三抗(辣根酶标记链霉卵白素)30 min, DAB显色, 苏木精复染, 脱水封片. 病理玻片由有经验的病理科医师负责, 并在不清楚患者临床资料的情况下阅片. 用PBS代替第Ⅰ抗体作为阴性对照. 由于survivin蛋白在肿瘤细胞的胞质和胞核均有表达, 为研究需要, 阅片时分别对胞质和胞核的表达情况做单独记录, survivin表达的肿瘤细胞数超过5%者, 视为阳性表达.
统计学处理 统计学分析采用SPSS13.0 for Windows软件包. 不同组间的疗效情况比较采用χ2检验或Fisher's精确检验; 分析影响食管鳞癌放化疗反应的相关因素采用Logistic回归分析; P<0.05时认为有统计学差异.
中期临床疗效评估CR 8例, PR 56例, SD 45例, PD 3例, 总有效率(CR+PR)为57.1%.
survivin的表达可见于肿瘤细胞的胞质或/和胞核内(图2), 其中胞核内表达阳性73例(67.8%), 胞质表达阳性76例(65.2%, 表1).
| 胞核 | 合计 | |||
| 阳性 | 阴性 | |||
| 胞质 | 阳性 | 46 | 27 | 73(65.2%) |
| 阴性 | 30 | 9 | 39 | |
| 合计 | 76(67.8%) | 36 | 112 | |
胞核survivin阴性者对放化疗的有效率明显较阳性者高(P = 0.026, 表2); 胞质survivin表达阴性者和阳性者的放化疗有效率无统计学差异(P>0.05, 表3).
| 胞核survivin | 中期疗效 | 合计 | 有效率(%) | |
| CR/PR | SD/PD | |||
| 阴性 | 26/29 | 10/7 | 36 | 80.6 |
| 阳性 | 38/35 | 38/41 | 76 | 46.1 |
| 合计 | 64 | 48 | 112 | 57.1 |
| 胞质survivin | 中期疗效 | 合计 | 有效率(%) | |
| CR/PR | SD/PD | |||
| 阴性 | 23 | 16 | 39 | 58.9 |
| 阳性 | 41 | 32 | 73 | 56.2 |
| 合计 | 64 | 48 | 112 | 57.1 |
以中期疗效作为应变量, 把年龄、性别、肿瘤长度、肿瘤部位、分化程度、治疗前T、N、M状态、临床分期、survivin的核表达及胞质表达等参数作为Logistic回归分析. 结果显示, 与食管鳞癌放化疗反应相关的独立因素为肿瘤的分化程度和核survivin表达情况(表4).
| 变量 | P值 | 风险比 | 95% CI |
| 性别 | 0.189 | 2.803 | 0.603-13.032 |
| 年龄 | 0.556 | 2.046 | 0.213-19.691 |
| 肿瘤部位 | 0.594 | 0.876 | 0.539-1.424 |
| 肿瘤长度 | 0.512 | 0.936 | 0.769-1.140 |
| 分化程度 | 0.046 | 0.243 | 0.061-0.972 |
| T分期 | 0.774 | 1.356 | 0.170-10.802 |
| N分期 | 0.530 | 0.643 | 0.162-2.554 |
| M分期 | 0.911 | 0.874 | 0.083-9.188 |
| 临床分期 | 0.758 | 1.312 | 0.233-7.380 |
| 胞质survivin | 0.774 | 1.356 | 0.170-10.802 |
| 胞核survivin | 0.000 | 6.589 | 2.306-18.821 |
| 常数 | 0.399 | 0.098 |
survivin可以单独或同时表达于肿瘤细胞的胞质和胞核内. 目前认为, survivin表达在不同的部位, 可能有不同的临床意义, 故本研究把胞质和胞核的survivin表达情况分别记录和研究. 本研究中, survivin在胞质的表达率为65.2%, 在胞核的表达率为67.8%, 与文献[6-9]报道基本相符.
survivin的3个异构体的不同细胞定位, 可能是造成其核内表达与胞质内表达的临床意义存在差别的原因之一. 本研究结果表明, survivin对放化疗的影响作用与他在细胞内的不同定位有关, 核内survivin阳性表达者放化疗有效率较低, 而胞质survivin表达与否对放化疗的疗效无明显影响. 由于人类survivin基因的不同转录方式, 可能产生3种survivin的异构体[10], 包括全长survivin、survivin-2B和survivin-ΔEx-3, 前二者主要定位于细胞内, 后者存在于胞核内, 但目前对于三种异构体各自的功能和定位的认识仍然是非常有限. 本研究采用免疫组化的方法检测survivin蛋白的表达情况, 虽然不能明确区分三种异构体, 但从细胞定位上发现核survivin表达对食管癌的放化疗更具临床意义, 可能与三种异构体的不同细胞定位有关, 有必要采取更精确地方法对三种异构体进行深入的研究, 以便明确其细微作用.
survivin表达与多种肿瘤的放化疗的敏感性有密切关系. 本研究组的一项研究[11]表明: 靶向survivin siRNA可以有效抑制人大细胞肺癌多药耐药株H460/cDDP的survivin表达, 并使其Taxol IC50值减少35.70%(8.51±0.935 mg/L, P = 0.006), 有效提高H460/cDDP对Taxol的敏感性. Rödel et al[12]研究两个放疗抵抗的直肠癌细胞株SW480和HCT-15, 干扰其survivin mRNA的表达后, 两个细胞株的放疗后的凋亡指数显著升高. 而食管癌中则尚无相关研究. 本研究分别从放化疗的临床疗效和病理学改变两个层面上探讨survivin表达与食管癌放化疗反应的关系, 发现核survivin的表达是影响食管鳞癌放化疗反应的因素之一. 核survivin阴性者放化疗的中期有效率为80.6%, 而阳性者有效率仅为46.1%, 差异有统计学意义; 术前放化疗组中, 4例核survivin阴性者放化疗后肿瘤的分期均有所下降, 且其中3例为pCR, 而17例核survivin阳性者中, 得到降期者仅占41.2%(7/17), 由于该组病例数较少, 未能得出统计学差异(P = 0.09), 但已显示一定趋势. 这提示核survivin阳性者可能对放化疗的敏感性较低. 理论上, survivin具有抑制细胞凋亡和调节细胞周期及细胞分裂的双重功能, 当其过度表达时, 肿瘤细胞出现异常增殖, 对正常凋亡信号的刺激不敏感, 肿瘤细胞局部浸润和远处转移的能力增强. 核survivin表达, 可能使肿瘤细胞对放疗和化疗所诱导的凋亡信号不敏感, 以致放化疗的疗效下降.
Urschel et al[13]及Fiorica et al[14]两个Meta分析的结果表明, 同期放化疗并手术的治疗模式较单纯手术能有效提高食管癌的远期生存率. Brücher et al[15]报道一组接受术前同期放化疗并手术的食管鳞癌病例, 预后分析结果表明, 放化疗后的组织学反应是影响食管鳞癌预后的独立因素, 组织学反应明显者, 预后较好. 临床上, 检测survivin的表达情况有助于对患者治疗的正确选择和预后的准确评估. 对局部晚期的食管鳞癌病例, 核survivin阴性者的放化疗有效率明显较高, 从术前放化疗中获益的机会较大, 可考虑接受术前放化疗后再行手术治疗; 反之, 提示对放化疗的反应率低, 从术前放化疗中获益的机会较小, 应更倾向于争取根治性的手术治疗.
总之, survivin对放化疗的影响作用与他在细胞内的不同定位有关, 核内的survivin表达, 提示食管鳞癌可能对放化疗反应较差. 检测核survivin的表达情况可能作为预测食管鳞癌对放化疗疗效的有效参考指标.
目前新辅助性和根治性的同期放化疗都已经成为食管癌标准治疗中的重要组成部分. 但食管癌对放化疗的反应存在明显的异质性, 仅是对放化疗有反应的患者才能真正获益. 故寻找分子生物学指标预测放化疗反应, 作为个体化治疗的依据, 至关重要. survivin是近年发现的一种新的凋亡抑制蛋白, 与多种肿瘤的预后及放化疗敏感性有关, 可能成为肿瘤诊断和治疗的新靶点.
谭群友, 副教授, 中国人民解放军第三军医大学大坪医院全军胸外科中心
目前survivin与食管癌放化疗敏感性的研究主要是来源于实验室的研究以及个别小样本的临床研究, 有一定提示作用, 但临床意义仍不明确, 需更多的临床研究去深入探讨. survivin在食管癌和正常食管黏膜中的表达存在明显差异, 可能成为有效预测食管癌放化疗敏感性的分子生物学指标.
目前有关细胞学的研究已报道, 采用RNA干扰技术, 沉默survivin蛋白的表达, 能有效提高包括肺大细胞癌、腺癌以及直肠癌等细胞株的放疗、化疗敏感性. 在食管癌中, 为数不多的研究表明核survivin的表达是食管鳞癌预后的不良因素, 胞质survivin表达则与预后无明显相关性. 至于survivin表达与食管癌放化疗敏感性关系的研究则鲜有报道.
本研究采用免疫组化的方法检测survivin蛋白的表达情况, 虽然不能明确区分三种异构体, 但从细胞定位上发现核survivin表达对食管癌的放化疗更具临床意义, 可能与三种异构体的不同细胞定位有关; 另外, 本研究分别从放化疗的临床疗效和病理学改变两个层面上探讨survivin表达与食管癌放化疗反应的关系, 对survivin的价值有更全面的评价.
本研究结果表明, survivin对放化疗的影响作用与他在细胞内的不同定位有关, 核内的survivin表达, 提示食管鳞癌可能对放化疗反应较差. 临床上, 检测核survivin的表达情况可能作为预测食管鳞癌对放化疗疗效的有效参考指标, 有助于对患者治疗的正确选择和预后的准确评估.
RECIST(response evaluation criteria in solid tumors)标准: 1998年欧洲癌症研究与治疗协会(EORTC)、美国国立癌症研究所(NCI)及加拿大国立癌症研究所(NCIC)提出抗肿瘤药对实体肿瘤客观疗效评定新标准(RECIST), RECIST采用单径测量的原则, 即仅以肿瘤的最大长径评价肿瘤的变化, 最大长径缩小30%以上为PR, 增加30%以上(多个靶病变最大径之和增加20%以上)为PD.
本研究统计学处理与结果可靠, 讨论较充分, 结论明确, 具有一定的临床指导意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Okada E, Murai Y, Matsui K, Isizawa S, Cheng C, Masuda M, Takano Y. Survivin expression in tumor cell nuclei is predictive of a favorable prognosis in gastric cancer patients. Cancer Lett. 2001;163:109-116. [PubMed] [DOI] |
| 2. | Kennedy SM, O'Driscoll L, Purcell R, Fitz-Simons N, McDermott EW, Hill AD, O'Higgins NJ, Parkinson M, Linehan R, Clynes M. Prognostic importance of survivin in breast cancer. Br J Cancer. 2003;88:1077-1083. [PubMed] [DOI] |
| 3. | Lehner R, Lucia MS, Jarboe EA, Orlicky D, Shroyer AL, McGregor JA, Shroyer KR. Immunohistochemical localization of the IAP protein survivin in bladder mucosa and transitional cell carcinoma. Appl Immunohistochem Mol Morphol. 2002;10:134-138. [PubMed] [DOI] |
| 5. | Therasse P, Arbuck SG, Eisenhauer EA, Wanders J, Kaplan RS, Rubinstein L, Verweij J, Van Glabbeke M, van Oosterom AT, Christian MC. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst. 2000;92:205-216. [PubMed] [DOI] |
| 6. | Mega S, Miyamoto M, Li L, Kadoya M, Takahashi R, Hase R, Kaneko H, Shichinohe T, Kawarada Y, Itoh T. Immunohistochemical analysis of nuclear survivin expression in esophageal squamous cell carcinoma. DisEsophagus. 2006;19:355-359. [PubMed] [DOI] |
| 7. | Grabowski P, Kühnel T, Mühr-Wilkenshoff F, Heine B, Stein H, Höpfner M, Germer CT, Scherübl H. Prognostic value of nuclear survivin expression in oesophageal squamous cell carcinoma. Br J Cancer. 2003;88:115-119. [PubMed] [DOI] |
| 8. | Rosato A, Pivetta M, Parenti A, Iaderosa GA, Zoso A, Milan G, Mandruzzato S, Del Bianco P, Ruol A, Zaninotto G. Survivin in esophageal cancer: An accurate prognostic marker for squamous cell carcinoma but not adenocarcinoma. Int J Cancer. 2006;119:1717-1722. [PubMed] [DOI] |
| 9. | 高 思海, 赵 金平, 潘 铁成, 李 军. 凋亡抑制基因survivin 在食管鳞癌中的表达及其与p53基因表达相关性研究. 世界华人消化杂志. 2004;12:1468-1470. [DOI] |
| 10. | Mahotka C, Wenzel M, Springer E, Gabbert HE, Gerharz CD. Survivin-deltaEx3 and survivin-2B: two novel splice variants of the apoptosis inhibitor survivin with different antiapoptotic properties. Cancer Res. 1999;59:6097-6102. [PubMed] |
| 11. | Yang H, Fu JH, Hu Y, Huang WZ, Zheng B, Wang G. [Relationship between survivin expression and chemosensitivity of human lung cancer cells]. Zhonghua Yixue Zazhi. 2007;87:1934-1937. [PubMed] |
| 12. | Rödel F, Hoffmann J, Distel L, Herrmann M, Noisternig T, Papadopoulos T, Sauer R, Rödel C. Survivin as a radioresistance factor, and prognostic and therapeutic target for radiotherapy in rectal cancer. Cancer Res. 2005;65:4881-4887. [PubMed] [DOI] |
| 13. | Urschel JD, Vasan H. A meta-analysis of randomized controlled trials that compared neoadjuvant chemoradiation and surgery to surgery alone for resectable esophageal cancer. Am J Surg. 2003;185:538-543. [PubMed] [DOI] |