修回日期: 2008-05-01
接受日期: 2008-05-12
在线出版日期: 2008-07-18
目的: 建立胆固醇结石实验动物模型, 探讨胆囊收缩素(cholecystokinin, CCK)对胆固醇结石豚鼠离体胆囊肌条收缩的影响, 并研究胆道动力因素在胆固醇结石形成中的作用.
方法: 喂养致石饲料构建豚鼠胆固醇结石模型. 采用灌流法加药, 利用张力换能器记录豚鼠离体胆囊肌条张力的变化, 观察10-9、10-8、10-7 mol/L的CCK-8对正常豚鼠离体胆囊肌条(A组)、喂养致石饲料4 wk(B组)、8 wk(C组)豚鼠离体胆囊肌条及正常豚鼠损伤Cajal间质细胞(interstitial cell of cajal, ICC)后离体胆囊肌条(D组)的影响.
结果: A组无结石发生, B组及C组共有13例结石发生; A组、B组及C组加入CCK后收缩振幅均增加, 呈浓度依赖性; B、C两组振幅加入CCK后的效应值同A组相比变小, 起作用时间慢(P<0.05); 损伤胆囊ICC后, 收缩幅度增加不明显, 与CCK浓度无显著差异, 而与A组相比效应值有显著性差异(10-9 mol/L: 0.461±0.071 vs 1.461±0.252; 10-8 mol/L: 0.608±0.118 vs2.484±0.283; 10-7 mol/L: 0.641±0.129 vs 3.312±0.311, 均P<0.01).
结论: 离体胆囊肌条肌张力降低及对CCK的效应性降低在胆囊结石病的发生发展中有重要作用; 而损伤ICC后, 胆囊离体肌条对CCK的效应性明显降低, ICC可能在胆囊结石等胆囊动力性疾病中发生作用.
引文著录: 肖勇, 余保平, 吴志轩, 余志. 胆囊收缩素对胆固醇结石豚鼠离体胆囊肌条的影响. 世界华人消化杂志 2008; 16(20): 2280-2284
Revised: May 1, 2008
Accepted: May 12, 2008
Published online: July 18, 2008
AIM: To establish an animal model of cholesterol stone and to explore the effects of cholecystokinin (CCK) on gallbladder muscle stripes of guinea pigs with cholesterol stone in vitro as well as to investigate the role of biliary kinetics in cholesterol stone formation.
METHODS: The animal model of cholesterol stone was established by feeding guinea pig with stone-leading forage. The guinea pigs were assigned to four groups: group A (the normal guinea pigs), group B (stone-leading forage for 4 wk), group C (stone-leading forage for 8 wk), and group D (the normal guinea pigs with injury of interstitial cell of cajal (ICC). Effects of 10-9, 10-8 and 10-7 mol/L cholecystokinin (CCK) on gallbladder muscle stripes of guinea pigs in vitro among the four groups were recorded and analyzed.
RESULTS: No cholesterol stone was observed in group A, and a total of 13 cases of cholesterol stone were observed in group B and C. The amplitude of contraction showed a dose-independent relationship with CCK-8 in groups A, B and C. Compared with group A, there was statistically significant diffference in group B and group C (P < 0.05). The contraction of smooth muscle was nearly abolished when interstitial cells of Cajal were destroyed using methylene blue incubation and intensive illumination. Although CCK was administered, there was no significant difference in the amplitude of the contraction of smooth muscle strip in group D (10-9 mol/L: 0.461 ± 0.071 vs 1.461 ± 0.252; 10-8 mol/L: 0.608 ± 0.118 vs 2.484 ± 0.283; 10-7 mol/L: 0.641 ± 0.129 vs 3.312 ± 0.311, all P < 0.01).
CONCLUSION: Muscular tension is significantly inhibited following injury of interstitial cells of Cajal. The damage of interstitial cells of Cajal may be an important factor related to cholelithiasis.
- Citation: Xiao Y, Yu BP, Wu ZX, Yu Z. Effects of cholecystokinin on gallbladder muscle stripes of guinea pigs with cholesterol gallstone in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2280-2284
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2280.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2280
胆囊动力障碍在胆石症等疾病中有着重要的作用[1], 贯穿胆囊结石形成的全过程. 现已证实, Cajal间质细胞(interstitial cell of Cajal, ICC)在胆囊中存在[2-3], 但是关于ICC及胆囊动力障碍与胆囊动力疾病间的作用机制尚不清楚. 本研究通过构造胆固醇结石模型, 观察胆固醇结石豚鼠胆囊平滑肌肌条及去ICC胆囊平滑肌肌条对胆囊收缩素(cholecystokinin, CCK)的反应, 并初步探讨其在胆石症的发生发展中的作用. 现报告如下.
健康成年豚鼠40只, 体质量250-350 g, ♂, 由武汉大学人民医院动物中心提供. 实验用胆固醇购自武汉亚法生物技术有限公司, 鱼肝油及白糖购自武汉老百姓大药房. 8肽胆囊收缩素购自Sigma(Fisher Scientific)公司. Tyrode液成分包括(mmol/L); NaCl 147.0, KCl 4.0, CaCl2 2.0, MgCl2 1.05, Na2HPO4 1.81, NaH2PO4 0.42, 葡萄糖5.5, 用NaOH调pH至7.35-7.45. 50 mmol/L的亚甲蓝用Tyrode液配置. 张力换能器, RM6240多道生理信号采集处理系统购自成都仪器厂.
将40只豚鼠随机分为Ⅰ、Ⅱ两个组; Ⅰ组为正常豚鼠饲养组(20只), 喂养正常豚鼠饲料; Ⅱ组为胆固醇结石模型构造组(20只), 喂养致石饲料. 致石饲料参照卫志明 et al[4]方法喂养高胆固醇饲料. 其中Ⅰ组随机均分为两组; 正常豚鼠胆囊平滑肌组(A组)和损伤ICC胆囊平滑肌组(D组); Ⅱ组同样随机均分为喂养致石饲料4 wk(B组)、8 wk(C组). 豚鼠分笼饲养, 每笼2-3只, 豚鼠可随意获取饲料和水, 每2-3 d补充一次青菜; 饲养环境为: 温度20-25℃, 湿度40%-60%.
离体胆囊肌条的制备方法参照周吕 et al[5]的方法, 沿胆囊纵轴将胆囊制备成长8 mm, 宽3 mm肌条, 每条胆囊取3条肌条, 将肌条与张力换能器相连, 浸没于37±0.5℃ Tyrode液中, 给胆囊肌条1.0 g前负荷, 待肌条出现规律的自发节律性收缩并稳定60 min后记录机械收缩信号. 将1.0 g前负荷规定为0 g. 用化学药物亚甲蓝50 mmol/L+光照50 mW/cm2选择性破坏ICC. 光源采用可调聚光灯, 为可见光, 光波长532.0 nm, 照射在距光源3-5 cm的组织表面, 照射时间为5 min, 光照强度用数字测光表测出. 该方法只破坏ICC结构而不破坏肌间神经网及平滑肌细胞[6].
胆固醇结石模型的鉴定: 豚鼠致石饲料喂养时间到后进行标本采集. 肉眼观察胆囊、胆管内有无结石存在. 细针抽净胆囊胆汁, 观察胆汁性状及有无沉淀物. 取两滴胆汁偏振光显微镜下观察胆汁有无胆固醇结晶.
CCK-8干预方法; 观察胆囊肌条对CCK-8(10-7、10-8、10-9 mol/L)的反应. 使用微量进样器添加, 每种单一浓度CCK-8作用后, Tyrode液冲洗肌条3次.
统计学处理 以给药前2 min胆囊肌条的张力和收缩波平均振幅作为对照值, 每次给药后2 min的数值为效应值(CCK-8作用前后的变化程度). 实验结果均以mean±SD表示, A组、B组、C组三组间的比较采用单因素方差分析, A、D两组采用配对t检验, 多通道生物信号采集分析系统数据软件和统计软件SPSS13.0进行统计学分析. P<0.05为差异有统计学意义.
豚鼠胆囊结石的发生情况; Ⅰ组正常豚鼠饲养组有1例发生胆囊结石, 无死亡状况发生; Ⅱ组结石模型构造组中共死亡1例, 为致石饲料8 wk组; 胆囊结石发生情况共有13例, 其中致石饲料4 wk 5例(5/10), 致石饲料8 wk 8例(8/10), 结石成石率显著高于对照组(P<0.01, 表1).
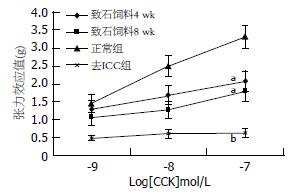
正常组(A组)、致石饲料喂养4 wk(B组)及致石饲料喂养8 wk(C组)加入10-9、10-8、10-7 mol/L各浓度CCK-8后振幅明显增加. 正常组(A)中加入各浓度CCK-8后离体胆囊肌条收缩振幅分别增加1.461±0.252 g、2.484±0.283 g、3.312±0.311 g; B组分别增加1.292±0.239 g、1.685±0.272 g、2.081±0.288 g; C组分别增加1.071±0.208 g、1.263±0.238 g、1.782±0.263 g. B、C两组同A组相比, 效应值有显著性差异(P<0.05, 表2, 图1).
胆石症(cholelithiasis or gallstone disease)是由存在于胆道系统(包括肝内、外胆管及胆囊)内的结石所引起的一组疾病. 其发病机制尚未完全明了, 除了"胆汁内胆固醇过饱和、成核理论"和"胆固醇磷脂泡理论"外, 胆囊自身的因素(如胆囊运动功能障碍)也很重要. 本实验中Ⅱ组成石率明显高于Ⅰ组, 同时饲养8 wk也高于饲养致石饲料4 wk, 表明高胆固醇饮食是构造胆固醇结石模型的有效途径. 高胆固醇饮食可增加肠黏膜胆固醇的合成, 并且增加胆固醇的摄取和分泌. 喂养胆固醇饲料后, 胆囊上皮分泌大量蛋白, 增加胆汁糖蛋白的含量, 胆固醇和胆红素含量升高及总蛋白质质量的增加促进成核.
由于离体胆囊已去神经支配, 不受高位神经中枢影响, 并且Brotschi et al[7]发现采用胆囊肌条研究可以部分乃至完全消除肠神经系统(entericnervous system, ENS)对胆囊运动的影响. CCK是促进胆囊收缩的主要激素. 传统观点认为, CCK可以通过神经机制来调节胆囊收缩, 其作用于突触前神经元, 增加乙酰胆碱的释放, 影响平滑肌的收缩. CCK 还可直接收缩胆囊平滑肌, 其信号通路主要为与胆囊平滑肌上的CCK-A受体特异性结合, 通过G-蛋白耦联激活磷脂酶C(PLC), PLC水解PIP2并产生IP3和DAG, IP3能引起细胞内钙的释放并活化钙调蛋白, DAG能激活蛋白激酶C, 最终均引起胆囊平滑肌收缩[8].
我们实验显示, 在离体胆囊平滑肌肌条对CCK-8反应的实验中, 与正常对照组相比, 喂养致石饲料4 wk和8 wk两个胆囊结石模型组明显降低(效应值变小), 模型组中肌条对CCK-8的效应性降低; 同时喂养致石饲料4 wk和8 wk两个胆囊结石模型组之间胆囊肌条对CCK-8反应(效应值)也有差异, 说明随致石饲料的喂养时间增长, 肌条对CCK-8的效应性降低, 结石的发生率增高. 有研究显示胆固醇孵育肌条后, 肌条的静息肌张力和对CCK的反应性均降低, 胆囊平滑肌自发性动作电位的幅度和频率也都明显减弱[9]. 这说明在喂养高胆固醇致石饲料后, 胆汁内先有胆固醇的增高, 之后出现肌条对CCK的敏感性下降, 导致胆囊运动功能障碍, 促进胆囊结石的形成. Sato et al[10]对CCK-8受体基因敲除小鼠的研究也发现, CCK-A受体缺乏和效应性的降低与胆结石的形成相关.
ICC是胃肠运动的起搏细胞, 是胃肠道平滑肌慢波电位的起搏者和传导者, 并最终调节平滑肌的收缩活动[11], 在胃肠电及动力障碍机制上具有重要的作用. 近来关于胆囊动力的电生理研究表明, 胆囊有类似肠道慢波电位的节律性变化, 电活动与机械活动一致, 并略先于机械活动. 胆囊平滑肌具有自发性动作电位, 胆囊的节律性兴奋是多位点的, 能被兴奋性激动剂同步化[12]. Lavoie et al[3]研究还发现, 缝隙连接阻断剂和c-kit抑制剂能减少ICC的钙锋和动作电位. 这些都提示胆囊ICC在胆囊自发性节律的产生和传播中可能具有重要的作用. 我们发现, CCK对ICC遭特异性破坏的豚鼠离体胆囊肌条的兴奋作用几乎消失, 也证实了ICC可能是CCK对胆囊平滑肌的兴奋途径中的一个中间环节, CCK可能通过ICC来影响胆囊的收缩功能.
总之, 本实验可以证实豚鼠离体胆囊肌条肌张力降低及对CCK-8敏感性的降低等胆囊动力学障碍在胆囊结石病的发生发展中有重要作用; 而损伤ICC后, CCK对离体胆囊肌条几无作用, CCK可能是通过ICC来引起胆囊离体肌条的收缩, ICC可能在胆囊结石等胆囊动力性疾病中发生作用.
胆囊结石是消化系统的常见病, 而胆固醇结石在其中占较大比例. 胆囊动力减弱是胆石发生发展过程中的重要病理生理学特点.
黄恒青, 主任医师, 福建省第二人民医院 消化内科
胆道系统动力减弱, 胆汁淤滞是胆石症重要的病理生理特点, 胆囊中ICC是存在的, 二者之间的关系仍需大量研究.
近年来, 胆固醇结石模型的构造已成熟; 亚甲蓝+光照破坏ICC的方法也已证实可行.
在研究离体肌条收缩对胆石形成的影响的基础上, 进一步探讨ICC在其中的作用.
目前研究发现胆石症中胆石的形成常常伴有动力异常、胆石淤滞. 因此探讨胆囊收缩素对胆囊动力的影响对于阐明胆石症可能的病理生理机制具有现实意义.
本研究证实胆固醇结石豚鼠离体胆囊肌条收缩对胆囊收缩素的敏感性下降, 但未能证明胆道动力因素在胆固醇结石形成中的作用, 建议进一步研究.
编辑: 李军亮 电编:郭海丽
| 1. | Portincasa P, Di Ciaula A, vanBerge-Henegouwen GP. Smooth muscle function and dysfunction in gallbladder disease. Curr Gastroenterol Rep. 2004;6:151-162. [PubMed] [DOI] |
| 2. | Sun X, Yu B, Xu L, Dong W, Luo H. Interstitial cells of Cajal in the murine gallbladder. Scand J Gastroenterol. 2006;41:1218-1226. [PubMed] [DOI] |
| 3. | Lavoie B, Balemba OB, Nelson MT, Ward SM, Mawe GM. Morphological and physiological evidence for interstitial cell of Cajal-like cells in the guinea pig gallbladder. J Physiol. 2007;579:487-501. [PubMed] [DOI] |
| 5. | 周 吕, 柯 美云. 胃肠动力学. 第1版. 北京: 科学出版社 1999; 293-303. |
| 6. | Liu LW, Thuneberg L, Huizinga JD. Selective lesioning of interstitial cells of Cajal by methylene blue and light leads to loss of slow waves. Am J Physiol. 1994;266:G485-G496. [PubMed] |
| 7. | Brotschi EA, Pattavino J, Williams LF Jr. Intrinsic nerves affect gallbladder contraction in the guinea pig. Gastroenterology. 1990;99:826-830. [PubMed] |
| 8. | Shaffer EA. Review article: control of gall-bladder motor function. Aliment Pharmacol Ther. 2000;14 Suppl 2:2-8. [PubMed] [DOI] |
| 9. | Jennings LJ, Xu QW, Firth TA, Nelson MT, Mawe GM. Cholesterol inhibits spontaneous action potentials and calcium currents in guinea pig gallbladder smooth muscle. Am J Physiol. 1999;277:G1017-G1026. [PubMed] |
| 10. | Sato N, Miyasaka K, Suzuki S, Kanai S, Ohta M, Kawanami T, Yoshida Y, Takiguchi S, Noda T, Takata Y. Lack of cholecystokinin-A receptor enhanced gallstone formation: a study in CCK-A receptor gene knockout mice. Dig Dis Sci. 2003;48:1944-1947. [PubMed] [DOI] |
| 11. | Sanders KM, Koh SD, Ward SM. Interstitial cells of cajal as pacemakers in the gastrointestinal tract. Annu Rev Physiol. 2006;68:307-343. [PubMed] [DOI] |
| 12. | Balemba OB, Salter MJ, Heppner TJ, Bonev AD, Nelson MT, Mawe GM. Spontaneous electrical rhythmicity and the role of the sarcoplasmic reticulum in the excitability of guinea pig gallbladder smooth muscle cells. Am J Physiol Gastrointest LiverPhysiol. 2006;290:G655-G664. [PubMed] [DOI] |