修回日期: 2008-06-10
接受日期: 2008-06-17
在线出版日期: 2008-07-18
目的: 探讨中药复方补肾柔肝方对二甲基亚硝胺(dimethylnitrosamine, DMN)诱导大鼠肝纤维化后肝脏组织结缔组织生长因子(connective tissue growth factor, CTGF) mRNA的表达影响, 以了解其对肝纤维化的治疗作用和分子机制.
方法: ♂Wistar大鼠40只, 随机分为正常对照组(n = 10)、模型组(n = 15)及治疗组(n = 15). 模型组和治疗组以10 mg/kg的剂量腹腔注射DMN, 每天1次, 每周连续3 d, 共4 wk. 模型组在造模结束后给予生理盐水ig, 而治疗组在造模结束后给补肾柔肝方ig进行治疗干预, 用药4 wk. 第8周末处死全部大鼠, 用放射免疫试剂盒方法检测血清胶原成分HA、LN及Ⅳ-C的含量; 用HE和天狼猩红染色法观察肝组织的炎症及纤维增生情况. 并采用RT-PCR半定量方法, 探讨大鼠肝组织CTGF mRNA的表达水平.
结果: 治疗组大鼠一般状态明显好于模型组; 正常组大鼠无死亡, 模型组死亡率为40%, 治疗组死亡率20%. 模型组血清胶原成分HA、LN及Ⅳ-C的含量较正常组显著增高, 治疗组较模型组显著下降(HA: 319.75±63.23 pg/L vs 434.44±98.81 pg/L; LN: 44.83±4.09 pg/L vs 70.67±6.32 pg/L; Ⅳ-C: 52.79±5.71 pg/L vs 79.39±10.52 pg/L, 均P<0.01). DMN可以成功诱导大鼠肝纤维化, 模型组肝组织CTGF mRNA表达明显增强, 中药复方治疗组与模型组相比明显减弱(CTGF/β-actin: 0.76±0.10 vs 1.08±0.17, P<0.01), 而正常对照组表达较少.
结论: CTGF mRNA的表达可能与肝纤维化的发生密切相关, 中药复方补肾柔肝方具有较好的抗肝纤维化作用, 可以显著抑制大鼠肝组织CTGF mRNA的表达.
引文著录: 张斌, 王灵台. 补肾柔肝方对二甲基亚硝胺诱导大鼠肝纤维化后CTGF mRNA表达的影响. 世界华人消化杂志 2008; 16(20): 2224-2228
Revised: June 10, 2008
Accepted: June 17, 2008
Published online: July 18, 2008
AIM: To investigate effects of kidney-tonifying liver-emoliating formula (KTLEF) on expression of connective tissue growth factor (CTGF) mRNA in dimethylnitrosamine-induced hepatic fibrosis rats and thereby to elucidate its therapeutic effects and its underlying molecular mechanism.
METHODS: Forty male Wistar rats were randomly assigned to normal control group (n = 10), model group (n = 15) and KTLEF-treated group (n = 15). Except the normal control group, all the rats received intraperitoneal DMN injection once a day for 3 successive days for 4 wk. Then only the model group was given KTLEF for anther 4 wk. Rats were all executed at week 8. The serum liver fibrosis markers, such as HA, LN and Ⅳ-C, were measured using ELISA and RIA. The Hepatic inflammatory necrosis and collagen deposition were determined by HE staining and Sirius red staining, and CTGF mRNA expression was detected using RT-PCR.
RESULTS: The rat model of liver fibrosis induced by DMN was successfully constructed. Serum HA, LN and Ⅳ-C levels were significantly declined in BSRGF-treated group compared with those in the model-group (HA: 319.75 ± 63.23 pg/L vs 434.44 ± 98.81 pg/L; LN: 44.83 ± 4.09 pg/L vs 70.67±6.32 pg/L; Ⅳ-C: 52.79 ± 5.71 pg/L vs 79.39 ± 10.52 pg/L, all P < 0.01). The expression level of CTGF mRNA was lower in the KTLEF-treated group than that in the fibrosis model group (CTGF/β-actin: 0.76 ± 0.10 vs 1.08 ± 0.17, P < 0.01), and the least in the normal control group.
CONCLUSION: The expression of CTGF mRNA is increased in the hepatic fibrosis rats, and is supposed to be one possible mechanism of hepatic fibrosis. KTLEF can significantly inhibit CTGF mRNA expression and then effectively counteract hepatic fibrosis.
- Citation: Zhang B, Wang LT. Effects of kidney-tonifying liver-emoliating formula on connective tissue growth factor mRNA expression in hepatic fibrosis rats. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2224-2228
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2224.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2224
胃肝纤维化是肝脏对各种原因所致肝损伤的创伤愈合反应, 表现为肝内结缔组织增生与沉积. 细胞因子促进肝纤维化的作用已较明确, 尤其是转化生长因子β(transforming growth factor β, TGF-β)、金属蛋白酶组织抑制因子1(tissue inhibitor of metalloproteinase-1, TIMP-1)和血小板源性生长因子(platelet derived growth factor, PDGF)等, 他们可直接作用于肝星状细胞(hepatic stellate cell, HSC)和肝细胞等, 使其增殖和活化[1-7]. 尽管如此, 人们对肝纤维化的形成机制仍没有清楚. 结缔组织生长因子(connective tissue growth factor, CTGF)是转化生长因子(transforming growth factor, TGF)的下游效应介质, 可诱导纤维母细胞细胞外基质成分基因的表达, 多数学者认为与肝纤维化关系密切[8-10], 但是也有学者持不同意见[11], 为此, 我们运用二甲基亚硝胺(dimethylnitrosamine, DMN)诱导大鼠肝纤维模型, 观察CTGF在肝纤维化大鼠肝组织内的表达状况, 并运用补肾柔肝方(kindney-tonifyis liver-emoliating formula, KTLEF)进行治疗, 以观察中药复方抗肝纤维化的疗效, 并分析其作用机制.
♂Wistar大鼠40只, 清洁级, 体质量150±10 g, 购于中科院上海实验动物中心. 补肾柔肝方(主要成分为仙灵脾、炙鳖甲及黄芪等多种中药), 由上海中医药大学附属曙光医院制剂室提供, 制备成含生药1.6 kg/L的流浸膏灌胃液; DMN, 购自日本东京化成工业株式会社; 透明质酸(HA)、层黏连蛋白(LN)及Ⅳ胶原检测试剂盒购自上海海军医学研究所生物技术中心. 高氯酸(批号: 19880907), 分析纯, 上海桃浦化工厂提供. 柠檬酸钠、无水乙酸钠, 分析纯, 购自上海化学试剂有限公司. AA-200分析天平, Densere仪器公司; 日立7020自动生化分析仪、轮转切片机(RM2035)、冰冻切片机(CMl850)、H11220烤片机、H11210恒温水浴, 均购自德国Leica公司.
1.2.1 造模及分组: Wistar大鼠随机分组, 正常对照组10只, 模型组和治疗组分别15只, 对模型组和治疗组进行DMN造模, 采取每周连续3 d, 每天ip DMN 10 mg/kg, 共4 wk, 治疗组在造模4 wk后给予补肾柔肝方ig, 剂量10 mL/(kg·d), 共治疗4 wk. 研究过程的第8周末处死全部大鼠, 留取血清及肝组织标本.
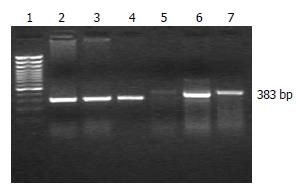
1.2.2 RT-PCR半定量检测肝组织CTGF mRNA表达: 分别取正常组、模型组和治疗组各3个肝组织进行研究, CTGF引物(由中国南方基因中心合成, 产物383 bp): 上游5'-CTAAGACCTGTGGA ATGGGC-3'; 下游5'-CTCAAAGATGTCATT GTCCCC-3'; β-肌动蛋白(β-actin)引物(内参照物, 由中国南方基因中心合成, 产物300 bp), 上游 5'-TCACCCACACTGTGCCCATCTACGA-3'; 下游5'-TCACCCACACTGTGCCCATCTACGA-3'. TRIzol抽提肝组织RNA, 进行RT-PCR扩增. PCR反应体系为20 μL, 扩增条件: 94℃预变性3 min; 94℃变性30 s, 54℃退火30 s, 72℃复性30 s, 共30-35个循环, 最后72℃延伸7 min. 每次PCR反应均以无菌双蒸水代替cDNA模板作为阴性对照. 取7 μL PCR产物在15 g/L琼脂糖凝胶中进行电泳, 紫外线下观察结果, 并在凝胶电泳分析系统下拍照. 求出每条带的密度值, 以β-actin PCR产物作为内参照. 求出每条目的条带与β-actin条带的比值, 进行统计学处理.
1.2.3 生化指标检测以及病理组织观察: 大鼠氯胺酮麻醉后, 下腔静脉采血, 离心分离血清. 放射免疫试剂盒方法检测血清胶原成分HA、LN及Ⅳ-C的含量. HE染色观察肝组织炎症活动情况, 天狼猩红染色观察肝组织纤维化程度, 并按照改良Knodell HAI[12]对纤维化程度进行判断.
统计学处理 实验数据以mean±SD表示, 应用SPSS10.0统计软件进行t检验及方差分析.
正常组大鼠生长状态良好, 体质量增加显著, 皮毛光滑, 二便如常; 模型组活动少, 精神萎靡, 胡须下垂, 喜睡少动, 体重增加减少, 甚至较前下降, 皮毛欠光滑, 尿色黄, 有腹泻; 治疗组一般状态明显好于模型组. 在第8周的治疗过程中, 正常大鼠无死亡, 而模型大鼠死亡率为40%(6/15), 治疗组死亡率为20%(3/15), 所有大鼠经过解剖发现, 正常大鼠无腹水, 模型组大鼠腹水发生率为60%(9/15), 治疗组大鼠腹水发生率为33.33%(5/15). 可见, 治疗组与模型组有显著性差异(P<0.01).
模型组血清胶原成分HA、LN及Ⅳ-C的含量均较正常组显著增高, 分别为正常组的分别为正常组的1.72、1.86、3.71倍, 表现出明显的肝纤维化特征. 药物治疗组HA、LN、Ⅳ-C均较模型组显著下降, 分别为正常组的1.26、1.18、2.47倍(表1).
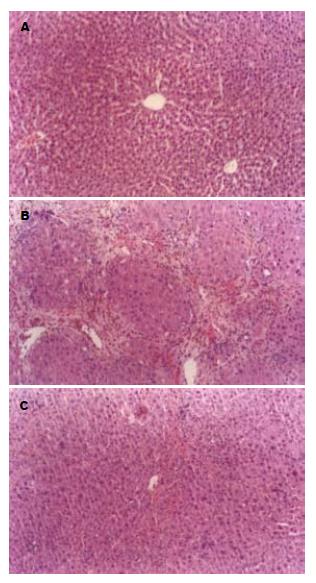
正常组: 肝小叶结构正常, 无界面性炎症及纤维化; 肝条索排列规整, 以中央静脉为中心呈反射状排列, 肝细胞无变性、坏死. 模型组: 肝内纤维化间隔增多增宽, 自汇管区和中央静脉区向周围延伸, 小叶内中央静脉偏离或消失; 肝细胞索排列紊乱, 少数细胞肿胀, 散在不同程度的小叶内坏死、碎屑坏死、桥接坏死. 治疗组: 增生纤维细菲薄, 肝小叶未被完全分割; 肝细胞排列接近正常, 肝细胞变性明显减轻, 偶见点状坏死, 有再生肝细胞, 汇管区有炎症细胞浸润(图1). 根据天狼猩红染色结果进行纤维化程度判断: 各组大鼠肝组织胶原纤维增生程度比较(表2), 其中治疗组结果要显著好于模型组(P<0.05).
| 分组 | n | 纤维化分级 | Ridit分析 | ||||
| - | + | ++ | +++ | ++++ | |||
| 正常组 | 10 | 10 | P<0.01 | ||||
| 模型组 | 9 | 0 | 0 | 4 | 2 | 3 | |
| 治疗组 | 12 | 0 | 0 | 6 | 5 | 1 | P<0.05 |
模型组CTGF/β-actin的比值为1.08±0.17, 治疗组为0.76±0.10, 两者有显著性差异(P<0.01), 而正常组仅为0.28±0.03. CTGF mRNA基因扩增电泳结果如图2所示.
DMN是一种具有肝毒性、细胞毒性和免疫毒性的药物, 可用于大鼠肝纤维化模型的制作, 其给药途径为ip, 其造模机理主要与毒性产物引起核酸和蛋白质的甲基化从而导致肝细胞坏死有关, 形成的纤维化相对稳定而不易吸收, 此模型与人类肝硬化早期改变及胶原纤维沉积相似, 可作为筛选抗肝纤维化药物的方便模型[13-17]. 缺点是不容易掌握剂量, 因为小剂量不易形成肝纤维化, 大剂量应用可致大鼠肝细胞坏死后肝纤维化. 另外还存在死亡率高和容易出血等不足. 本研究中尽管造模是成功的, 但是仍存在死亡率偏高的情况, 考虑与DMN剂量偏高或造模时间偏长有关, 有关造模的最佳条件, 还需要做进一步深入研究.
细胞因子作为促进肝纤维化的重要调节因子的作用已较明确, 尤其是TGF-β、TIMP-1和PDGF等在肝纤维化形成过程中的作用比较明确[18-22], 但是许多其他细胞因子的作用也引起人们的高度重视, 其中CTGF在肝纤维化形成过程中的作用也引起需要学者的高度重视[23-25]. CTGF是高度保守的CCN多肽家族成员之一, 分子质量38 kDa, 含349个氨基酸, 富含半胱氨酸, 具有明显的丝裂原性和趋化性, 能诱导成纤维细胞增殖和分泌细胞外基质, 参与调节细胞增生、分化、胚胎发育以及伤口愈合, Li et al[26]研究认为CTGF具有有促进炎症和纤维化形成的作用. George et al[27]运用DMN诱导老鼠肝纤维化的模型后发现模型组肝组织的CTGF和TGF-β表达均显著提高, 通过运用针对CTGF的小干扰RNA(siRNA)后进行干预, 发现可以下调CTGF和TGF-β的表达, 有抑制肝纤维化的形成和发展的作用. Weng et al[28]研究认为CTGF具有上调TGF-β活性的作用, 从而促进肝纤维化的形成和发展, 其机制可能与纤维化发生过程中的细胞信号转导激活有关, 其中Smad3、Smad7等信号蛋白参与其发病的过程. Hora et al[29]研究发现, 在丙型肝炎患者, CTGF是促进肝纤维化的炎症介质, 可能是通过提高瘦素(leptin)水平来实现的. 本研究结果显示, 运用补肾柔肝方进行治疗后, 大鼠肝细胞的变性和坏死程度得到显著改善, 肝纤维化有显著减轻. 基因半定量研究结果表明, 他可以显著减少肝组织CTGF mRNA的基因表达水平. 以上表明补肾柔肝方对肝纤维化具有较好的疗效, 其抗肝纤维的分子机制可能与下调CTGF有关, 可以使HSC的活化得到抑制, 从而减少肝纤维化的发生和发展.
中医中药治疗肝胆疾病, 如黄疸、臌胀、胁痛等, 已有悠久的历史, 大量临床实践也证实其疗效. 补肾柔肝方攻补兼施, 攻而不破, 补而不腻, 攻补力量较为平均, 其以仙灵脾、枸杞、鳖甲等以补肾而软坚散结; 黄芪、白术等健脾, 以益气生血, 以丹参等补血活血, 诸药合用, 共奏补肾健脾活血软坚之功, 是治疗慢性肝病肝纤维化脾肾亏虚较为严重, 瘀血内阻较为明显的安全、有效的中药处方. 其独到之处在于注重肾在肝病发病过程中的调节, 认为肝纤维化发生与机体正气亏虚有关, 提出"从肾治肝, 扶助正气"的治肝观点, 这是治疗的一个创新, 符合中医基础理论中的"肝肾同源"的原理, 在先前的研究中也证实具有良好的抗肝纤维化作用[30-31]. 本研究表明, 治疗组可以使HA、LN、Ⅳ-C均较模型组显著下降, 显示补肾柔肝方对DMN诱导的肝纤维化形成和发展具有良好的治疗作用. 其良好的抗肝纤维化作用也得到了病理学研究的证实, 与正常对照组比较, 模型组和治疗组的肝组织有显著的肝细胞炎症、水肿和出血, 有显著的肝纤维化表现, 同时治疗组与模型组比较其程度有不同的减轻. 本研究对补肾柔肝方的抗肝纤维化的疗效及机制进行了初步研究, 为中医药防治肝纤维化提供新的思路和方法.
肝纤维化是慢性肝病向肝硬化发展的必经之路, 目前认为肝纤维化通过积极治疗是可以逆转的, 但关键是早期得到及时诊断和治疗. 补肾柔肝方能显著降低肝纤维化大鼠血清纤维化相关指标, 改善肝组织病理学损害, 有效的干预大鼠肝纤维化.
张声生, 教授, 首都医科大学附属北京中医医院消化中心
本课题组前期研究证实, 补肾柔肝方可以有效的改善肝纤维化大鼠的肝功能、抑制肝纤维化的发生和发展, 提高大鼠的生存率.
本研究运用二甲基亚硝胺诱导大鼠肝纤维化, 对大鼠肝组织中的结缔组织生长因子的表达水平进行研究, 有助于进一步阐明肝纤维化的发病机制, 同时也有助于阐明补肾柔肝方抗肝纤维化的疗效机制.
DMN: 一种具有肝毒性、细胞毒性和免疫毒性的药物, 可用于大鼠肝纤维化模型的制作, 其给药途径为腹腔注射, 其造模机理主要与毒性产物引起核酸和蛋白质的甲基化从而导致肝细胞坏死有关, 形成的纤维化相对稳定而不易吸收.
本研究采用较成熟的肝纤维化的造模方法, 观察中药复方补肾柔肝方对大鼠模型血肝纤指标和肝脏组织结缔组织生长因子(CTGF) mRNA的表达影响, 研究方法较规范, 取得了较好的结果; 行文表达较流畅, 具有较好的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Murata K, Kamata Y, Munakata H, Sugai M, Sasaki M. Immunohistochemical study on liver fibrosis in biliary atresia. Hepatogastroenterology. 2008;55:179-183. [PubMed] |
| 2. | Chen HN, Fan S, Weng CF. Down-regulation of TGFbeta1 and leptin ameliorates thioacetamide-induced liver injury in lipopolysaccharide-primed rats. J Endotoxin Res. 2007;13:176-188. [PubMed] [DOI] |
| 3. | Meindl-Beinker NM, Dooley S. Transforming growth factor-beta and hepatocyte transdifferentiation in liver fibrogenesis. J Gastroenterol Hepatol. 2008;23 Suppl 1:S122-S127. [PubMed] [DOI] |
| 4. | Brocks B, Kraft S, Zahn S, Noll S, Pan C, Schauer M, Krebs B. Generation and optimization of human antagonistic antibodies against TIMP-1 as potential therapeutic agents in fibrotic diseases. Hum Antibodies. 2006;15:115-124. [PubMed] |
| 5. | Sentíes-Gómez MD, Gálvez-Gastélum FJ, Meza-García E, Armendáriz-Borunda J. [Hepatic fibrosis: role of matrix metalloproteases and TGFbeta]. Gac Med Mex. 2005;141:315-322. [PubMed] |
| 6. | Garcíade León Mdel C, Montfort I, Tello Montes E, López Vancell R, Olivos García A, González Canto A, Nequiz-Avendaño M, Pérez-Tamayo R. Hepatocyte production of modulators of extracellular liver matrix in normal and cirrhotic rat liver. Exp Mol Pathol. 2006;80:97-108. [PubMed] |
| 7. | Campbell JS, Hughes SD, Gilbertson DG, Palmer TE, Holdren MS, Haran AC, Odell MM, Bauer RL, Ren HP, Haugen HS. Platelet-derived growth factor C induces liver fibrosis, steatosis, and hepatocellular carcinoma. Proc Natl Acad Sci U S A. 2005;102:3389-3394. [PubMed] [DOI] |
| 8. | Zhang C, Zhu Y, Wan J, Xu H, Shi H, Lu X. Effects of Ginkgo biloba extract on cell proliferation, cytokines and extracellular matrix of hepatic stellate cells. Liver Int. 2006;26:1283-1290. [PubMed] [DOI] |
| 9. | Rachfal AW, Brigstock DR. Connective tissue growth factor (CTGF/CCN2) in hepatic fibrosis. Hepatol Res. 2003;26:1-9. [PubMed] [DOI] |
| 10. | Gressner AM, Yagmur E, Lahme B, Gressner O, Stanzel S. Connective tissue growth factor in serum as a new candidate test for assessment of hepatic fibrosis. Clin Chem. 2006;52:1815-1817. [PubMed] [DOI] |
| 11. | Gressner OA, Lahme B, Demirci I, Gressner AM, Weiskirchen R. Differential effects of TGF-beta on connective tissue growth factor (CTGF/CCN2) expression in hepatic stellate cells and hepatocytes. J Hepatol. 2007;47:699-710. [PubMed] [DOI] |
| 12. | Brunt EM. Grading and staging the histopathological lesions of chronic hepatitis: the Knodell histology activity index and beyond. Hepatology. 2000;31:241-246. [PubMed] [DOI] |
| 13. | He JY, Ge WH, Chen Y. Iron deposition and fat accumulation in dimethylnitrosamine-induced liver fibrosis in rat. World J Gastroenterol. 2007;13:2061-2065. [PubMed] |
| 14. | Saha JK, Xia J, Sandusky GE, Chen YF, Gerlitz B, Grinnell B, Jakubowski JA. Study of plasma protein C and inflammatory pathways: biomarkers for dimethylnitrosamine-induced liver fibrosis in rats. Eur J Pharmacol. 2007;575:158-167. [PubMed] [DOI] |
| 15. | Wu JW, Lin LC, Hung SC, Lin CH, Chi CW, Tsai TH. Hepatobiliary excretion of silibinin in normal and liver cirrhotic rats. Drug Metab Dispos. 2008;36:589-596. [PubMed] [DOI] |
| 16. | Gauldie J, Bonniaud P, Sime P, Ask K, Kolb M. TGF-beta, Smad3 and the process of progressive fibrosis. Biochem Soc Trans. 2007;35:661-664. [PubMed] [DOI] |
| 17. | Kim EY, Kim EK, Lee HS, Sohn Y, Soh Y, Jung HS, Sohn NW. Protective effects of Cuscutae semen against dimethylnitrosamine-induced acute liver injury in Sprague-Dawley rats. Biol Pharm Bull. 2007;30:1427-1431. [PubMed] [DOI] |
| 18. | Chen MH, Chen SH, Wang QF, Chen JC, Chang DC, Hsu SL, Chen CH, Sheue CR, Liu YW. The molecular mechanism of gypenosides-induced G1 growth arrest of rat hepatic stellate cells. J Ethnopharmacol. 2008;117:309-317. [PubMed] [DOI] |
| 19. | Wynn TA. Cellular and molecular mechanisms of fibrosis. J Pathol. 2008;214:199-210. [PubMed] [DOI] |
| 20. | Seki E, De Minicis S, Osterreicher CH, Kluwe J, Osawa Y, Brenner DA, Schwabe RF. TLR4 enhances TGF-beta signaling and hepatic fibrosis. Nat Med. 2007;13:1324-1332. [PubMed] [DOI] |
| 21. | Zhang LJ, Zheng WD, Chen YX, Huang YH, Chen ZX, Zhang SJ, Shi MN, Wang XZ. Antifibrotic effects of interleukin-10 on experimental hepatic fibrosis. Hepatogastroenterology. 2007;54:2092-2098. [PubMed] |
| 22. | Hu YB, Li DG, Lu HM. Modified synthetic siRNA targeting tissue inhibitor of metalloproteinase-2 inhibits hepatic fibrogenesis in rats. J Gene Med. 2007;9:217-229. [PubMed] [DOI] |
| 23. | Yuhua Z, Wanhua R, Chenggang S, Jun S, Yanjun W, Chunqing Z. Disruption of connective tissue growth factor by short hairpin RNA inhibits collagen synthesis and extracellular matrix secretion in hepatic stellate cells. Liver Int. 2008;28:632-639. [PubMed] |
| 24. | Li GM, Li DG, Xie Q, Shi Y, Jiang S, Zhou HJ, Lu HM, Jin YX. [Effect of silencing connective tissue growth factor on rat liver fibrosis and the accumulation of extracellular matrix.]. Zhonghua Ganzangbing Zazhi. 2008;16:188-192. [PubMed] |
| 25. | Chen A, Zheng S. Curcumin inhibits connective tissue growth factor gene expression in activated hepatic stellate cells in vitro by blocking NF-kappaB and ERK signalling. Br J Pharmacol. 2008;153:557-567. [PubMed] [DOI] |
| 26. | Li G, Xie Q, Shi Y, Li D, Zhang M, Jiang S, Zhou H, Lu H, Jin Y. Inhibition of connective tissue growth factor by siRNA prevents liver fibrosis in rats. J Gene Med. 2006;8:889-900. [PubMed] [DOI] |
| 27. | George J, Tsutsumi M. siRNA-mediated knockdown of connective tissue growth factor prevents N-nitrosodimethylamine-induced hepatic fibrosis in rats. Gene Ther. 2007;14:790-803. [PubMed] [DOI] |
| 28. | Weng HL, Ciuclan L, Liu Y, Hamzavi J, Godoy P, Gaitantzi H, Kanzler S, Heuchel R, Ueberham U, Gebhardt R. Profibrogenic transforming growth factor-beta/activin receptor-like kinase 5 signaling via connective tissue growth factor expression in hepatocytes. Hepatology. 2007;46:1257-1270. [PubMed] [DOI] |
| 29. | Hora C, Negro F, Leandro G, Oneta CM, Rubbia-Brandt L, Muellhaupt B, Helbling B, Malinverni R, Gonvers JJ, Dufour JF. Connective tissue growth factor, steatosis and fibrosis in patients with chronic hepatitis C. Liver Int. 2008;28:370-376. [PubMed] |
| 31. | Zhang B, Wan MB, Wang LT. [Therapeutic effect of Bushen Rougan Recipe on hepatic fibrosis in rats]. Zhongxiyi Jiehe Xuebao. 2005;3:132-135. [PubMed] |