修回日期: 2008-06-11
接受日期: 2008-06-17
在线出版日期: 2008-07-18
目的: 观察细胞外调节蛋白激酶(extracelluar regulated protein kinase, ERK)信号通路对胃癌细胞化疗效果的影响并探讨其机制.
方法: 足叶乙甙作用于胃癌SGC7901和BGC823细胞, 采用MTT比色法检测细胞的生存率, 采用流式细胞仪和Hoechst33258荧光染色检测细胞周期分布和凋亡, Western杂交法检测ERK1/2的磷酸化以及c-Myc和P53蛋白表达水平. 同时采用PD98059抑制ERK信号通路后观察足叶乙甙对细胞增殖、凋亡、c-Myc和P53表达的影响.
结果: 足叶乙甙呈时间-剂量依赖性抑制SGC7901和BGC823细胞的生长并明显诱导细胞的凋亡, 同时上调ERK1/2的活性(磷酸化水平), 并增强c-Myc和P53的表达, 与对照组比较, 足叶乙甙组凋亡率明显增高(19.48%±1.57% vs 5.67%±0.81%, 17.38%±1.49% vs 4.97%±0.73%, 均P<0.01), PD98059可明显增强足叶乙甙的细胞生长抑制作用并提高细胞的凋亡水平, 与足叶乙甙组比较, 足叶乙甙组+PD98059组凋亡率(34.35%±2.84%, 32.11%±3.25%)明显增加(P<0.01); 同时上调足叶乙甙诱导的P53表达, 并抑制c-Myc表达的上升趋势.
结论: 足叶乙甙可活化胃癌细胞ERK信号通路而影响胃癌细胞的化疗效果, 其机制可能是通过抑制P53并上调c-Myc的表达, 从而抑制细胞的凋亡实现.
引文著录: 刘诗权, 于红刚, 唐国都, 黄杰安, 于皆平. 细胞外调节蛋白激酶通路对胃癌细胞化疗效果的影响. 世界华人消化杂志 2008; 16(20): 2211-2216
Revised: June 11, 2008
Accepted: June 17, 2008
Published online: July 18, 2008
AIM: To investigate the relationship between the activation of mitogen-activated protein kinase (MAPK)/extracelluar regulated protein kinases (ERK) signaling pathway and chemoresistance in human gastric cancer cell lines SGC7901 and BGC823.
METHODS: Cells were exposed to etoposide with or without PD98059 (a special inhibitor of MAPK/ERK pathway). Cell cycle distribution and cell apoptosis analysis were determined using flow cytometry and Hoechst 33258 staining. Cytotoxicity was assessed by determining cell survival with 3-(4, 5-dimethyl thiazol-2-yl)-2, 5-diphenyl tetrazolium bromide (MTT). Western blotting was performed to evaluate the phosphorylation level of ERK1/2 and protein expression of c-Myc and P53.
RESULTS: Etoposide caused a time- and dose-dependent reduction of cell viability in SGC7901 and BGC823 cells. PD98059 enhanced the cell inhibitory efficiency of etoposide. Compared with control group, the apoptosis rate was elevated in etoposide group (19.48% ± 1.57% vs 5.67% ± 0.81%, 17.38% ± 1.49% vs 4.97% ± 0.73%, all P < 0.01). Cells treated with and PD98059 showed significantly higher level of apoptotic phenotype than those treated with etoposide alone. The apotosis rate was 34.35% ± 2.84% and 32.11% ± 3.25% in etoposide and PD98059 groups, respectively (P < 0.01). Phosphorylation level of ERK1/2 and expression of c-Myc were significantly induced by etoposide in a time-dependent manner, but there was slight effect on protein expression of P53. PD98059 up-regulated expression of P53 and suppressed the up-regulated c-Myc expression induced by etoposide, strikingly.
CONCLUSION: Chemotherapy agent etoposide was able to activate MAPK/ERK signaling pathway of gastric cancer cells SGC7901 and BGC823, which decrease the chemotherapy sensitivity via suppressing the expression of P53 and enhancing the expression of c-Myc. This may be one of the mechanisms responsible for gastric cancer chemoresistance.
- Citation: Liu SQ, Yu HG, Tang GD, Huang JA, Yu JP. Activation of ERK signaling pathway reduces the chemotherapy sensitivity in gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2211-2216
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2211.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2211
丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)/细胞外调节蛋白激酶(extracelluar regulated protein kinase, ERK)级联通路是细胞信号转导的重要途径, 参与调节细胞多种生理功能, 并在细胞恶性转化及演进中起重要作用[1]. ERK主要由分子质量分别为44 kDa和42 kDa的ERK1和ERK2蛋白组成. 丝裂原细胞外激酶(mitogen extracellular kinase, MEK)可使ERK1/2磷酸化而影响细胞的增殖、分化和细胞周期的进程[2]. 磷酸化的ERK(p-ERK)是其活化形式, 可介导信号由胞质向胞核传递, 作用于c-Fos、c-Myc、Elk-1等转录因子及核蛋白, 促进多种癌基因及细胞周期调节相关基因的转录与表达, 参与调节细胞的生长、发育、分化、分裂等多种生理过程, 并与细胞的恶性转化密切相关. 然而, MAPK/ERK信号通路在胃癌中的作用以及该通路与胃癌化疗的关系目前仍不清楚. 本研究应用足叶乙甙及MAPK/ERK信号通路抑制剂PD98059作用于胃癌细胞株SGC7901和BGC823, 观察其对胃癌细胞增殖、凋亡、ERK磷酸化以及P53、c-Myc表达的影响, 以了解ERK信号通路对胃癌细胞化疗效果的影响并探讨其机制.
人胃癌细胞株SGC7901和BGC823购自中国科学院上海细胞生物研究所细胞库; RPMI 1640培养基和新生小牛血清购自Gibco公司; MTT、DMSO、MEK/ERK抑制剂PD98059和β-actin抗体购自Sigma公司; P53抗体和c-Myc抗体购于Cell Signaling公司; 磷酸化ERK1/2抗体购于Promega公司; ECL化学荧光试剂盒购自Santa-cruz公司; 足叶乙甙购于Alexis Biochemical公司.
1.2.1 细胞培养: 胃癌细胞常规培养于含100 mL/L灭活新生小牛血清、100 kU/L链霉素和100 kU/L青霉素的RPMI 1640培养液中, 培养条件为37℃、50 mL/L CO2、饱和湿度, 每隔2-3天用2.5 g/L胰酶消化, 以1:3-1:5传代1次.
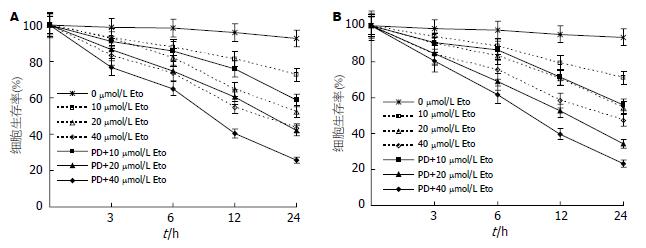
1.2.2 MTT比色法检测细胞增殖活性: 取对数生长期细胞, 接种于96孔培养板, 分成7组, 分别加入10、20、40 μmol/L足叶乙甙; 100 μmol/L PD98059预处理2 h后再加入上述不同浓度足叶乙甙, 同时以生理盐水代药物作对照组. 每组分别于足叶乙甙作用0、3、6、12、24 h进行MTT检测. 每种药物浓度-时间设立3个平行孔. 以对照组的0 h细胞存活率作为100%, 计算细胞存活率. 细胞存活率(%) = 实验孔吸光度(A)值/对照孔A值×100%.
1.2.3 流式细胞仪检测: 将对数生长期细胞分成3组, 分别加入20 μmol/L足叶乙甙; 加入100 μmol/L PD98059培养2 h后, 再加入20 μmol/L的足叶乙甙; 同时以生理盐水代药物作对照组. 足叶乙甙作用24 h后每组收集106个细胞, 冷EDTA-PBS洗二次, 乙醇固定, 离心, 冷EDTA-PBS洗二次, PBS重悬5 min后400目筛网过滤, 离心弃上清; 加入PI染色液, 并使细胞浓度调节至1×109/L, 4℃避光染色, 流式细胞仪检测并分析结果.
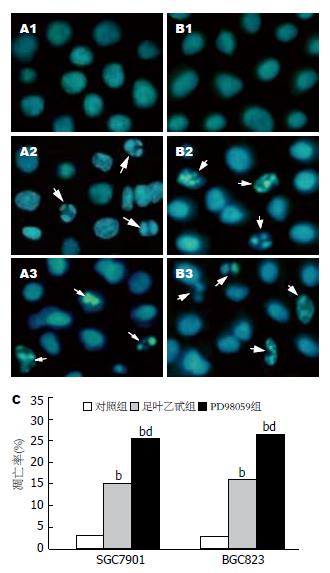
1.2.4 Hoechst33258荧光染色检测凋亡: 将对数生长期细胞以1.0×108/L密度接种于6孔培养板(内含盖玻片), 待细胞爬片后药物处理同流式细胞术检测. 足叶乙甙分别作用24 h后将培养液吸出, 固定后取出6孔板中的盖玻片, 漂洗, 室温下自然干燥. 滴加Hoechst33258染液, 37℃避光染色, 漂洗, 晾干封片, 于荧光显微镜450 nm波长处观察并拍照. 每个标本观察400个细胞, 计算其中凋亡细胞的比例, 细胞凋亡指数(AI, %) = 凋亡细胞数/400个细胞×100%.
1.2.5 Western杂交: 将对数生长期细胞分成2组, 分别加入20 μmol/L足叶乙甙; 先加入100 μmol/L PD98059培养2 h后, 再加入20 μmol/L足叶乙甙. 每组重复5瓶, 加入足叶乙甙后分别培养0、3、6、12、24 h, 加入细胞裂解液, 冰上孵育30 min. 细胞裂解物12 000 r/min低温离心10 min, 取上清液, 用Bradforde比色法测定蛋白浓度. 取30 μg加热变性的蛋白, 120 g/L的SDS-PAGE胶电泳, 然后转印至硝酸纤维素膜, 含5%脱脂奶粉的TBST液封闭, 室温振荡2 h, 加一抗4℃振荡过夜, 辣根过氧化物酶标记二抗室温振荡1 h, 采用ECL化学荧光试剂盒检测杂交信号. 然后, X线医学胶片上曝光显影.
统计学处理 以上实验均独立重复3次, 数值以mean±SD表示. 采用Gel-Pro Analyzer4.0软件对Western杂交条带进行A值分析, 以β-actin为系统内参. 所有数据均经SPSS11.0软件分析, 均数比较采用双侧t检验.
足叶乙甙时间-剂量依赖性抑制细胞的生长. PD98059可显著增强足叶乙甙对胃癌细胞的生长抑制作用(图1).
流式细胞仪检测显示足叶乙甙可诱导SGC7901和BGC823细胞G0/G1期阻滞, 合用PD98059后细胞凋亡率明显升高(表1-2). Hoechst33258荧光染色显示空白对照组凋亡细胞较少, 呈较弱的弥散均匀荧光; 足叶乙甙作用24 h后细胞核体积变小、皱缩, 其染色质呈浓染的块状或颗粒状, 聚集于核周边或裂解成碎片, 并出现凋亡小体, 凋亡细胞明显增多; 合用PD98059后细胞凋亡率较单独应用足叶乙甙明显升高(P<0.01, 图2).
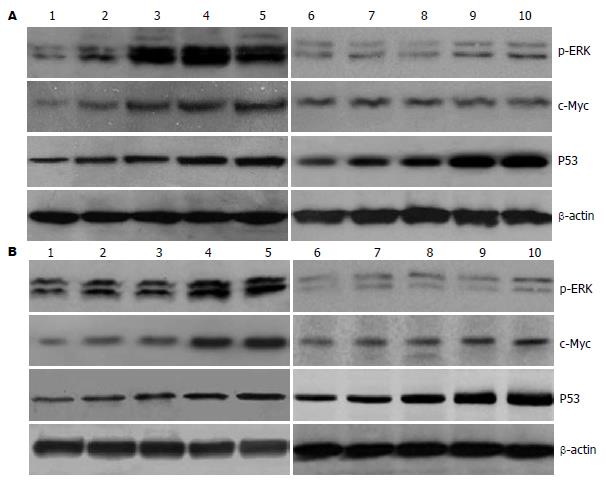
胃癌SGC7901和BGC823细胞无药物干预时有一定程度的ERK1/2磷酸化水平; 足叶乙甙作用后, 胃癌细胞的ERK磷酸化水平逐渐升高, 且呈一定的时间依赖性. 足叶乙甙作用3、6、12、24 h, SGC7901和BGC823细胞ERK磷酸化水平分别为对照组(0 h)的2.17, 8.92, 10.25, 9.92倍和1.72, 2.50, 4.83, 5.33倍; 联合应用PD98059可明显抑制ERK1/2的磷酸化(图3).
c-Myc蛋白表达水平随足叶乙甙作用时间逐渐增强, PD98059明显抑制ERK的磷酸化, 同时明显抑制足叶乙甙诱导的c-Myc蛋白的表达. 足叶乙甙作用3、6、12、24 h, SGC7901和BGC823细胞c-Myc的蛋白表达水平分别为对照组(0 h)的2.13, 3.88, 4.63, 4.88倍和2.67, 3.17, 6.50, 8.00倍; PD98059+足叶乙甙作用3、6、12、24 h, SGC7901和BGC823细胞c-Myc的表达水平分别为对照组(0 h)的1.50, 1.61, 1.34, 1.42倍和1.25, 1.50, 1.75, 2.13倍(图3).
P53蛋白表达水平随足叶乙甙作用时间逐渐增强, 但增加趋势较弱. PD98059明显抑制足叶乙甙诱导的ERK磷酸化水平, 并增强P53蛋白的表达水平. 足叶乙甙作用3、6、12、24 h, SGC7901和BGC823细胞P53的表达水平分别为对照组(0 h)的1.23, 1.54, 1.77, 1.85倍和1.47, 1.73, 2.00, 2.67倍; PD98059+足叶乙甙作用3、6、12、24 h, SGC7901和BGC823细胞P53的表达水平分别为对照组(0 h)的1.48, 2.04, 3.70, 4.26倍和1.84, 2.42, 4.11, 5.11倍(图3).
ERK是MAPK系统重要和经典的通路. 在乳腺癌、结肠癌、前列腺癌、肝癌等多种肿瘤中, ERK具有高水平的磷酸化或可被各种因素活化, 抑制ERK的磷酸化水平能抑制肿瘤细胞的生长、运动和侵润并可诱导细胞的凋亡[3-6]. 研究表明人类胃癌组织中ERK活性较相应正常组织高, CagA可以通过激活ERK1/2信号通路而促进正常胃上皮细胞的转化, 提高发生胃癌的危险性[7]. 而且, ERK的活化在幽门螺杆菌诱导的胃癌细胞的转化过程中可能起着重要的作用[8]. 抑制ERK1/2的活性, 可降低裸鼠胃癌的微血管密度, 抑制肿瘤的增长和细胞增生, 并可诱导细胞凋亡, 而激活ERK/COX-2/VEGF信号通路可促进裸鼠胃癌的生长和新血管的形成[9]. 此外, 激活ERK1/2信号通路可提高胃癌细胞的侵袭能力[10]. 总之, MAPK/ERK信号通路活化在胃癌的发生发展过程中起重要作用. 然而MAPK/ERK信号通路在胃癌细胞化疗过程中的作用还有待进一步的研究.
有研究表明ERK信号通路在小细胞肺癌中可被化疗药物激活, 从而使上述癌细胞获得对化疗药物的抵抗性[11]. 但在胃癌细胞中还没有相关的报道. 本实验中, 化疗药足叶乙甙能明显抑制胃癌细胞株SGC7901和BGC823的生长增殖并显著诱导胃癌细胞的凋亡, 同时ERK的磷酸化水平和活性也明显升高, 且呈时间依赖关系. 特异性ERK信号通路抑制剂PD098059不但抑制ERK磷酸化水平, 而且可以明显提高足叶乙甙对胃癌细胞的生长抑制作用和凋亡水平. 以上结果说明足叶乙甙可以活化ERK信号通路, 同时降低胃癌细胞的化疗敏感性. ERK信号通路可能参与了胃癌细胞化疗耐药性的产生. 然而, 其机制还有待进一步的阐明.
c-Myc和p53基因是研究较为深入的肿瘤基因. c-Myc基因为细胞增殖调控的早期反应基因, 有介导细胞增殖和诱导凋亡双重作用. 大多数肿瘤, 包括胃癌, 都检测到了c-Myc蛋白的过表达, 而且c-Myc蛋白的过表达与细胞的高增长性、肿瘤的发生、发展以及远处转移密切相关. 试验中, 足叶乙甙活化SGC7901和BGC823细胞ERK信号通路, 同时上调c-Myc蛋白的表达. PD98059可增强足叶乙甙对SGC7901和BGC823细胞的生长抑制和凋亡诱导作用, 并抑制c-Myc蛋白的表达. 表明胃癌细胞中ERK信号通路在调节c-Myc活性和表达的过程中起重要的作用. 其机制可能是阻断MAPK/ERK信号通路通过抑制c-Myc核蛋白体输入片段的活性和蛋白的表达, 阻止c-Myc磷酸化而下调c-Myc的表达和活性[12]. 阻断MAPK/ERK通路可能是通过抑制c-Myc表达, 从而抑制胃癌细胞的生长和诱导细胞的凋亡. p53基因是一种肿瘤抑制基因, 编码磷酸化的核蛋白, 对肿瘤的生长有负性调节作用, 与细胞凋亡密切相关[13]. 最近, 有研究表明乳腺癌细胞中HER2/neu基因的过表达能够通过激活Akt和ERK信号通路导致野生型P53蛋白含量减少, 可能是HER2/neu过表达乳腺癌患者预后不良及对治疗产生抗性的分子机制[14]. 另有研究表明抑制ERK可以增强p53基因的促凋亡作用[15]. 试验中, PD98059可明显增强足叶乙甙诱导的P53蛋白的表达, 并增强对SGC7901和BGC823细胞的生长抑制和凋亡诱导作用. MAPK/ERK信息通路是重要的生存通路, 阻断MAPK/ERK通路可能是通过促进P53表达, 从而抑制细胞的生长或诱导细胞的凋亡.
由此可见, 足叶乙甙一方面诱导细胞凋亡, 另一方面可活化ERK信号通路而影响胃癌细胞的化疗效果. 其机制可能是化疗药诱导MAPK/ERK信息通路的异常活化, 抑制P53蛋白并促进c-Myc蛋白的表达, 从而抑制细胞的凋亡所致. 抑制MAPK/ERK信息通路可能是抗胃癌药物发展的新途径.
丝裂原活化蛋白激酶(MAPK)级联通路是细胞信号转导的重要途径, 能将募集的多种细胞外信号通过磷酸化活化逐级转递至细胞核, 并激活多种核转录因子, 参与调节细胞多种生理功能, 并在细胞恶性转化及演进中起重要作用.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
磷酸化的ERK(p-ERK)是其活化形式, 可介导信号由胞质向胞核传递, 促进多种癌基因及细胞周期调节相关基因的转录与表达, 参与调节细胞的生长、发育、分化、分裂等多种生理过程, 并与细胞的恶性转化密切相关. 抗肿瘤药物能够引起白血病细胞和多种癌细胞中MEK/ERK信号传导系统的激活及多药耐药性的产生. 然而, MAPK/ERK信号通路在胃癌中的作用以及该通路与胃癌化疗的关系目前仍不清楚.
在乳腺癌、肝癌、结肠癌、前列腺癌、恶性间皮瘤、肺癌等多种肿瘤中, ERK可被各种因素活化, 抑制ERK的磷酸化水平能抑制肿瘤细胞的生长、运动和侵润并可诱导细胞的凋亡.
化疗药足叶乙甙可诱导胃癌细胞MAPK/ERK信号通路的异常激活, 而ERK异常激活可通过抑制P53表达并促进c-Myc的表达水平而影响胃癌化疗效果. ERK信号通路抑制剂PD98059能抑制以上通路, 从而提高胃癌的化疗敏感性.
MAPK/ERK信号通路的异常激活极可能参与胃癌细胞对化疗药物耐药性的产生, 抑制MAPK/ERK信号通路的激活可能代表着抗胃癌药物发展的新途径.
本文选题新颖, 研究方法科学, 行文流畅, 对ERK信号通路对胃癌细胞化疗效果的影响及其作用机制提供了有价值的信息, 为研究新的抗胃癌药物拓宽了思路, 具有很好的学术价值.
编辑: 李军亮 电编:郭海丽
| 1. | Reddy KB, Nabha SM, Atanaskova N. Role of MAP kinase in tumor progression and invasion. Cancer Metastasis Rev. 2003;22:395-403. [PubMed] [DOI] |
| 2. | Yoon S, Seger R. The extracellular signal-regulated kinase: multiple substrates regulate diverse cellular functions. Growth Factors. 2006;24:21-44. [PubMed] [DOI] |
| 3. | Ogunwobi OO, Beales IL. Adiponectin stimulates proliferation and cytokine secretion in colonic epithelial cells. Regul Pept. 2006;134:105-113. [PubMed] [DOI] |
| 4. | Sawhney RS, Cookson MM, Omar Y, Hauser J, Brattain MG. Integrin alpha2-mediated ERK and calpain activation play a critical role in cell adhesion and motility via focal adhesion kinase signaling: identification of a novel signaling pathway. J Biol Chem. 2006;281:8497-8510. [PubMed] [DOI] |
| 5. | Dreesen O, Brivanlou AH. Signaling pathways in cancer and embryonic stem cells. Stem Cell Rev. 2007;3:7-17. [PubMed] [DOI] |
| 6. | Fortino V, Torricelli C, Capurro E, Sacchi G, Valacchi G, Maioli E. Antiproliferative and survival properties of PMA in MCF-7 breast cancer cell. Cancer Invest. 2008;26:13-21. [PubMed] [DOI] |
| 7. | Zhu Y, Zhong X, Zheng S, Du Q, Xu W. Transformed immortalized gastric epithelial cells by virulence factor CagA of Helicobacter pylori through Erk mitogen-activated protein kinase pathway. Oncogene. 2005;24:3886-3895. [PubMed] [DOI] |
| 8. | Kacar F, Meteoglu I, Yasa H, Levi E. Helicobacter pylori-induced changes in the gastric mucosa are associated with mitogen-activated protein kinase (MAPK) activation. Appl Immunohistochem Mol Morphol. 2007;15:224-228. [PubMed] [DOI] |
| 9. | Shin VY, Wu WK, Ye YN, So WH, Koo MW, Liu ES, Luo JC, Cho CH. Nicotine promotes gastric tumor growth and neovascularization by activating extracellular signal-regulated kinase and cyclooxygenase-2. Carcinogenesis. 2004;25:2487-2495. [PubMed] [DOI] |
| 10. | Pan Y, Zhao L, Liang J, Liu J, Shi Y, Liu N, Zhang G, Jin H, Gao J, Xie H. Cellular prion protein promotes invasion and metastasis of gastric cancer. FASEB J. 2006;20:1886-1888. [PubMed] [DOI] |
| 11. | Kraus AC, Ferber I, Bachmann SO, Specht H, Wimmel A, Gross MW, Schlegel J, Suske G, Schuermann M. In vitro chemo- and radio-resistance in small cell lung cancer correlates with cell adhesion and constitutive activation of AKT and MAP kinase pathways. Oncogene. 2002;21:8683-8695. [PubMed] [DOI] |
| 12. | Lefevre G, Calipel A, Mouriaux F, Hecquet C, Malecaze F, Mascarelli F. Opposite long-term regulation of c-Myc and p27Kip1 through overactivation of Raf-1 and the MEK/ERK module in proliferating human choroidal melanoma cells. Oncogene. 2003;22:8813-8822. [PubMed] [DOI] |
| 13. | von Eyben FE. Chromosomes, genes, and development of testicular germ cell tumors. Cancer Genet Cytogenet. 2004;151:93-138. [PubMed] [DOI] |
| 14. | Kim HS, Hwang JT, Yun H, Chi SG, Lee SJ, Kang I, Yoon KS, Choe WJ, Kim SS, Ha J. Inhibition of AMP-activated protein kinase sensitizes cancer cells to cisplatin-induced apoptosis via hyper-induction of p53. J Biol Chem. 2008;283:3731-3742. [PubMed] [DOI] |
| 15. | Kojima K, Konopleva M, Samudio IJ, Ruvolo V, Andreeff M. Mitogen-activated protein kinase kinase inhibition enhances nuclear proapoptotic function of p53 in acute myelogenous leukemia cells. Cancer Res. 2007;67:3210-3219. [PubMed] [DOI] |