修回日期: 2008-06-13
接受日期: 2008-06-17
在线出版日期: 2008-07-18
目的: 研究胆碱能抗炎通路(CAP)在急性食管炎模型中对大鼠食管组织的细胞因子水平、胆碱乙酰转移酶(ChAT)、一氧化氮合成酶(NOS)的活性以及食管损伤程度的影响, 探讨CAP是否对实验性食管炎具有保护作用.
方法: 通过对大鼠食管下段持续滴注0.1 mol/L盐酸-胃蛋白酶溶液诱导制备急性食管炎模型. 成年♂SD大鼠40只, 随机分为5组: 生理盐水组(NS组), 盐酸-胃蛋白酶滴注组(AP组), 假手术组(SHAM组), 迷走神经切断组(VTM组)及迷走神经电刺激组(VNS组). 测定食管组织中肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-10(IL-10)的浓度及ChAT、NOS的活性, 并对食管的损伤程度进行肉眼及光镜下评分.
结果: 与NS组相比, 在盐酸-胃蛋白酶滴注诱导的大鼠急性食管炎组织中, 上述细胞因子的浓度及ChAT、NOS的活性均有所升高. 与假手术组相比, 通过电刺激迷走神经, 可抑制促炎细胞因子TNF-α和IL-6的升高(135.6±11.6 vs 200.0±20.5, 166.9±44.3 vs 305.6±16.5, 均P<0.05), 但对抑炎因子IL-10的水平并无影响; 并且使食管的炎症程度有所减轻. 在双侧颈部迷走神经切除后, 大鼠食管的炎症损伤程度加重, TNF-α、IL-6的水平亦明显升高(283.8±33.6 vs 200.0±20.5,P<0.05; 515.1±77.1 vs 305.6±16.5, P<0.01), 食管组织中NOS的活性下降. 各滴酸组食管下段的大体和镜下食管炎评分均明显高于NS组(P<0.01). VTM组食管组织大体及光镜评分均较SHAM组有明显升高(P<0.01及0.05). VNS组食管组织的食管炎评分比VTM组显著降低(P<0.01).
结论: 胆碱能抗炎通路通过传出迷走神经对大鼠实验性食管炎具有一定的保护作用.
引文著录: 张静, 谢鹏雁, 李慧, 帅晓玮, 王驰. 胆碱能抗炎通路对急性食管炎大鼠的保护作用. 世界华人消化杂志 2008; 16(20): 2204-2210
Revised: June 13, 2008
Accepted: June 17, 2008
Published online: July 18, 2008
AIM: To investigate the effects of cholinergic anti-inflammatory pathway (CAP) on levels of cytokines, choline acetyltransferase (ChAT) and nitric oxide synthetase (NOS) activities and on the degree of acute esophagitis in rats, and to determine whether CAP has protective effects against experimental esophagitis in rats.
METHODS: Acute esophagitis was induced by perfusion of 0.1 mol/L hydrochloric acid with pepsin in the lower part of the esophagus. Forty SD rats were randomly assigned to five groups. Group 1 served as a normal saline-treated control (NS group), while in group 2 the distal esophagus was exposed to acidified pepsin for 2 h (AP group). In the other three groups, animals were subjected to sham surgery (SHAM group) or bilateral cervical vagotomy alone (VTM group) or with electrical stimulation before and after acid perfusion (VNS group). The levels of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), interleukin-10 (IL-10) and activities of ChAT and NOS in the esophageal tissues were determined. Esophageal injury was assessed by macroscopic and microscopic examination.
RESULTS: The levels of TNF-α, IL-6, IL-10 and activities of ChAT and NOS in the esophageal tissues increased after acid perfusion. Compared to the SHAM group, vagus nerve electrical stimulation inhibited the release of TNF-α (135.6 ± 11.6 vs 200.0 ± 20.5, P < 0.05), IL-6 (166.9 ± 44.3 vs 305.6 ± 16.5, P < 0.05) and the degree of esophagitis, while the anti-inflammatory cytokine IL-10 was not affected. Conversely, vagotomy resulted in an elevated severity of esophagitis, associated with significant increase of TNF-α (283.8 ± 33.6 vs 200.0 ± 20.5, P < 0.05) and IL-6 (515.1 ± 77.1 vs 305.6 ± 16.5, P < 0.01) levels and decrease of NOS activity. The esophagitis score was significantly higher in acid treatment group than that in NS group (P < 0.01). The macroscopic and microscopic scores increased in VTM group compared with that in SHAM group (P < 0.01 and 0.05). The esophagitis score was decreased markedly in VNS group compared with that in VTM group (P < 0.01).
CONCLUSION: The results of this study provide evidence for the involvement of the cholinergic anti-inflammatory pathway in modulating inflammation and injury during experimental esophagitis.
- Citation: Zhang J, Xie PY, Li H, Shuai XW, Wang C. Protective effects of cholinergic anti-inflammatory pathway against acute esophagitis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2204-2210
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2204.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2204
胃食管反流病(gastroesophageal reflux disease, GERD)是一组由多种因素促成的上消化道常见疾病, 其发病率在世界范围内逐年上升. 在其发病机制中, 除了食管动力障碍作为重要的致病因素外, GERD的病理本质主要是胃酸、胃蛋白酶与及胆盐等反流物引起的炎症过程. 近年来, 许多研究表明[1], 多种细胞因子可通过不同的机制和途径, 在GERD的发生发展中起重要作用. 在系统和局部炎症反应的调控中, "胆碱能抗炎通路"的神经-免疫调节功能在近年来备受关注[2-5]. 本研究通过在发生急性食管炎的同时, 进行神经通路干预, 观察大鼠食管组织中细胞因子的水平和ChAT、NOS活性以及食管炎症损伤情况的变化, 探讨胆碱能抗炎通路在急性食管炎中是否具有保护作用及其可能机制.
健康♂SD大鼠40只, 由北京大学第一医院动物实验中心提供, 体质量280-350 g, 实验前在Ⅱ级动物室正常喂养1 wk. 主要试剂包括胃蛋白酶(Sigma, 美国)、氨基甲酸乙酯(北京化学试剂公司)、大鼠TNF-α、IL-6及IL-10酶联免疫吸附法(ELISA)检测试剂盒(Biosourse, 美国), ChAT、NOS检测试剂盒(南京建成生物工程研究所). 主要仪器有DDC-2A型多用电生理刺激器(南京六合无线电元件厂)、酶标仪(Bio-Rad Model 680, 美国)、紫外分光光度仪(UV2100, 日本)、光学显微镜(Nikon TE2000-S, 日本)和单道微量输液泵(浙江大学医学仪器有限公司).
1.2.1 分组: 实验动物随机分成5组: 生理盐水滴注组(NS组); 盐酸-胃蛋白酶滴注组(AP组); 假手术组(SHAM组); 迷走神经切断组(VTM组)及迷走神经电刺激组(VNS组). 每组8只.
1.2.2 造模: 通过对大鼠食管下段持续滴注0.1 mol/L盐酸溶液(含胃蛋白酶3000 kU/L, pH2.0)制备大鼠急性食管炎模型[6-7]. 实验前禁食10-12 h, 自由饮水, 氨基甲酸乙酯(1.0 g/kg)ip麻醉. 平卧位固定, 头部抬高20-30度, 切开腹壁和胃壁, 将一引流管放置在贲门下方以收集并排出经食管滴注的液体. 将一单腔灌流管(内径 0.30 mm, 外径0.50 mm)经口放置于食管内, 导管开口位于食管和胃交界处上约2.5 cm, 固定导管, 另一端与持续灌流泵相连. 按动物分组情况分别给予0.1 mol/L盐酸-胃蛋白酶溶液(37℃)食管内滴注(速度20 mL/h, 持续2 h)以及神经通路干预, 并设生理盐水滴注对照组, 滴注时间与速度同前. (1)NS组. (2)AP组. (3)SHAM组: 在食管滴酸前, 于喉头与胸骨间沿颈正中线作一长约3 cm切口, 行气管切开插管保持自主呼吸通畅. 暴露颈动脉鞘, 钝性分离双侧迷走神经干约2 cm, 但不结扎离断. (4)VTM组: 食管滴酸前, 分离双侧颈部迷走神经干后, 以4-0丝线结扎并离断. (5)VNS组: 在双侧迷走神经干离断后, 左侧迷走神经干远端与双铂电极连接, 以5 V(电压)、2 ms(脉冲宽度)、1 Hz(频率)的电流持续刺激30 min(分别在食管滴酸开始前15 min及结束后15 min)[2].
1.2.3 标本处理: 在食管滴注结束1 h后处死大鼠, 立即开腹, 取下大鼠食管下段组织约1.5-2.0 cm, 观察肉眼表现并评分. 经冰生理盐水冲洗漂净, 然后取小块食管组织置入10%甲醛溶液中固定, 标本行常规脱水、石蜡包埋、组织切片和HE染色, 光镜下观察食管组织损伤情况并评分. 食管炎的评分标准参考既往文献[6-7]. 采用双盲法观察. 剩余的食管组织保存于液氮中. 标本收集完成后, 待进行组织样本检测前, 以生理盐水(pH7.4)制备成匀浆, 4℃(3000 r/min, 15 min)离心, 取匀浆上清分装保存备检.
1.2.4 指标检测: 根据试剂盒说明操作, 通过ELISA方法检测组织匀浆中细胞因子TNF-α、IL-6及IL-10的含量, 采用Fonnum法[8-9]检测食管组织中ChAT的活力, 以及比色法测定NOS的活力. 并使用考马斯亮兰法进行组织蛋白定量.
统计学处理 应用SPSS13.0统计软件进行数据处理. 所有数据均以mean±SD表示. 多组均数比较采用单因素方差分析. 组间食管炎评分的比较采用Mann-Whitney U检验. P<0.05表示差 别具有显著性意义.
实验过程中, VTM组有3只动物在滴酸约1.5 h后死亡, 死亡原因均为食管下段穿孔. 其余动物均对食管内滴注及神经通路的干预耐受性良好.
与NS组相比, AP组食管组织中细胞因子TNF-α、IL-6及IL-10的浓度均有显著升高(P<0.05). SHAM组与AP组的组织细胞因子含量无显著性差异(P>0.05). 在行双侧颈部迷走神经切除术后(VTM组), 滴酸后的食管组织内TNF-α和IL-6的浓度明显升高(P<0.05或0.01). 而在滴酸前后进行左侧迷走神经的电刺激(VNS组), 则使促炎细胞因子TNF-α及IL-6的浓度与SHAM组相比显著下降(P<0.05). 神经通路干预对于组织内IL-10的浓度并无影响(P>0.05, 表1).
| 分组 | n | TNF-α(ng/g protein) | IL-6(ng/g protein) | IL-10(ng/g protein) | ChAT(U/g protein) | NOS(kU/g protein) |
| NS | 8 | 80.7±10.3 | 127.7±14.1 | 42.7±5.4 | 145.2±10.2 | 2.0±0.4 |
| AP | 8 | 146.3±17.5a | 262.1±30.2a | 61.2±6.3a | 225.4±13.3a | 5.5±0.4a |
| SHAM | 8 | 200.0±20.5 | 305.6±16.5 | 97.2±12.8 | 463.2±8.4h | 3.5±0.5 |
| VTM | 5 | 283.8±33.6c | 515.1±77.1d | 110.8±13.2 | 448.3±14.8 | 2.0±0.3d |
| VNS | 8 | 135.6±11.6cf | 166.9±44.3cf | 92.6±7.2 | 391.8±30.7 | 2.9±0.5 |
与NS相比, AP组食管组织内ChAT及NOS的活性均明显增加(P<0.05). SHAM组与AP组比, ChAT的活性进一步升高(P<0.01); VTM及VNS组的ChAT活性与SHAM组比无显著性差异(P>0.05). 双侧迷走神经切除术后, 滴酸后的食管组织内NOS活性并无增加, 而出现了显著降低(P<0.01); 而进一步的迷走神经电刺激对NOS的活性变化并无显著性影响(P>0.05, 表1).
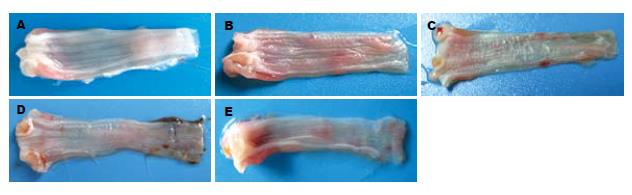
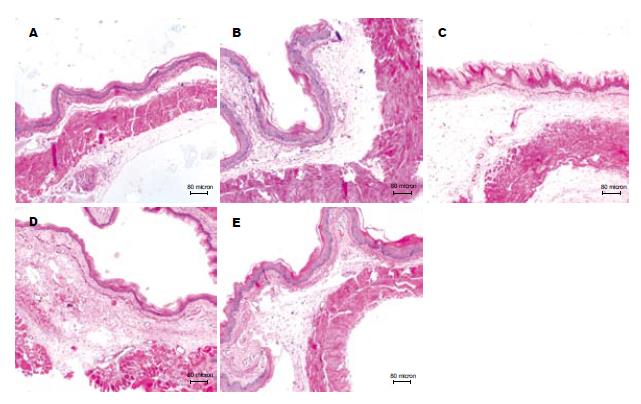
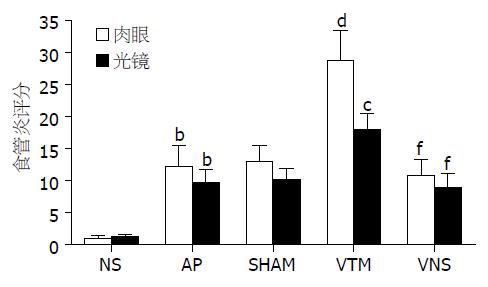
NS组大鼠下段食管在肉眼上及光镜下表现基本正常(图1A, 图2A). AP组及SHAM组食管组织损伤情况类似, 表现有不同程度的充血、水肿, 少数部位可见黏膜下出血(图1B, 图1C). 光镜下可见基底层细胞增生、核分裂等反应性上皮改变, 部分黏膜有上皮的脱失, 未见糜烂及溃疡形成; 黏膜下层表现为水肿和血管的扩张充血, 甚至出血; 无炎症细胞的浸润(图2B, 图2C). VTM组有3只大鼠在滴酸1.5 h后死亡, 取出食管后大体肉眼均可见食管下段穿孔及黏膜下大量出血, 该组其余5只大鼠与AP组、SHAM组比, 食管充血和水肿更为明显, 黏膜下出血多见(图1D). 光镜下则可见明显的上皮改变及充血、水肿, 并在黏膜下层出现了少量的中性粒细胞浸润(图2D). VNS组未出现食管穿孔, 肉眼主要表现为充血、水肿, 黏膜下出血少见(图1E). 其光镜下炎症表现也比VTM组明显减轻, 未见炎症细胞的浸润(图2E). 各组食管组织损伤情况的肉眼和光镜评分(图3)与NS组(肉眼1.0±0.5分, 光镜1.3±0.4分)比, 各滴酸组食管下段的大体和镜下食管炎评分均明显高于NS组(P<0.01). SHAM组(肉眼13.0±2.5分, 光镜10.3±1.6分)与AP组(肉眼12.3±3.2分, 光镜9.7±2.0分)食管炎评分无显著差异(P>0.05). VTM组(肉眼28.8±4.7分, 光镜18.0±2.6分)食管组织大体及光镜评分均较SHAM组有明显升高(P<0.01及0.05). VNS组(肉眼10.9±2.5分, 光镜9.0±2.1分)食管组织的食管炎评分比VTM组显著降低(P<0.01), 与AP组、SHAM组比无显著差异(图3).
反流性食管炎是在食管抗反流屏障功能减弱的基础上, 由于反流的胃和/或十二指肠内容物对食管黏膜的侵袭所造成了食管黏膜的损害. 因此, 胃食管反流病、尤其是糜烂性食管炎发生发展的病理本质, 最主要是各种攻击因子导致的炎症过程. 而细胞因子作为一大类信使蛋白, 广泛参与了机体各脏器的炎症反应. 近年来,许多研究表明, 多种细胞因子在GERD的发病过程中起了重要作用. 通过对猫酸滴注诱导食管炎模型的研究发现, 食管黏膜中IL-1β、IL-6的水平高于对照组, 并可通过抑制肠肌层的神经元释放乙酰胆碱(acetylcholine, ACh), 降低食管下端括约肌的紧张性[10-12]. IL-6和IL-10在Barrett食管组织中含量显著增加, 提示其在GERD的恶变进展过程中可能起着重要作用[13-15]. 对于TNF-α是否在食管炎组织中升高, 以往的研究结果并不一致[10,16-17]. Cao et al[11]研究表明, 在TNF-α的影响下, 食管平滑肌细胞对于电刺激或ACh作用下的收缩反应有所减弱. 本实验通过食管内盐酸-胃蛋白酶溶液的持续滴注, 诱发了下段食管肉眼及组织学的损伤, 成功制备了大鼠急性食管炎模型. 同时通过ELISA的方法检测发现促炎细胞因子IL-6、TNF-α的浓度在发生炎症的食管组织中明显增加, 二者可通过诱导中性粒细胞活化、产生活性氧族及脂质过氧化等作用, 并且进一步影响食管平滑肌的张力, 促使食管炎症的发生及恶化进展. 在本实验模型中, 内源性抑炎因子IL-10的含量在病变食管中也显著增多. 结合既往的文献报道, 考虑机体免疫系统促炎及抗炎机制的调控失衡, 可能是食管炎发生发展过程中的一个重要机制.
"胆碱能抗炎通路"的发现, 使人们对于迷走神经对炎症的神经-免疫调节功能有了新的认识. 神经系统可通过多种通路参与机体免疫反应的调节, 其中胆碱能神经通路的机制是近几年研究的新方向. 食管的神经支配主要来自于迷走神经, 其参与了食管感觉和运动的调控[18]. 而CAP是否参与食管炎的调控, 目前国内外尚未见文献报道. 本实验在诱发动物食管炎的过程中, 进行了迷走神经切断及切断后电刺激的神经通路干预, 发现VTM组动物下段食管损伤情况最为严重, 甚至导致了滴酸后的食管穿孔; 组织内促炎细胞因子TNF-α、IL-6的水平比SHAM组明显升高. 在双侧颈部迷走神经切除后再进行神经的电刺激, 与VTM组比, 食管的炎症损伤情况有明显改善; TNF-α、IL-6的水平也明显降低. 实验结果还提示, 神经通路的干预, 对于食管炎组织中抗炎细胞因子IL-10的含量无显著影响. 因此, 本实验结果表明, 迷走神经电刺激能在一定程度上减轻由盐酸-胃蛋白酶刺激引起的食管损伤, 即由迷走神经介导的胆碱能抗炎通路, 在对于大鼠急性食管炎的调控过程中具有一定的保护作用.体外细胞培养实验也证实[2], 迷走神经释放的ACh, 通过细胞内信号传导, 能抑制内毒素刺激后的巨噬细胞合成和释放促炎因子TNF-α、IL-1β、IL-6和IL-18等, 但ACh对抗炎因子IL-10的释放并无影响. 迷走神经的抗炎作用是通过免疫细胞上具有α7亚单位的烟碱型(N型)ACh受体来实现的. 传入迷走神经将外周免疫信息向中枢神经系统传递, 然后激活传出迷走神经, 释放ACh, 作用于免疫细胞, 实现其对炎症的调控. 因此, 胆碱能神经系统的功能变化在调控食管炎的发病过程中起了重要作用. 在本实验中, VNS组食管损伤情况比VTM组有明显减轻, 但VNS组与SHAM组的食管炎评分并无显著性差异, 考虑一方面是因为迷走神经的电刺激是在神经切断后进行, 迷走神经的完整性受到破坏, 对炎症程度影响较大; 另一方面, 对于观察炎症情况的时间以及电刺激强度的选择, 也会影响实验结果. 这些在今后的研究中可以作进一步的探讨.
胆碱乙酰转移酶(ChAT)广泛分布于胆碱能神经系统中, 主要在突触前神经末梢, 是神经细胞内ACh的合成酶. 以往研究发现[19-20], 在体内还存在着非神经元型胆碱能系统, 在免疫细胞、血管内皮细胞、肌纤维, 还包括消化道的上皮细胞及内分泌细胞内均有ChAT存在, 这些细胞均可合成ACh. ChAT的活力反映了胆碱能系统的功能. 本实验结果显示AP组食管组织中ChAT的活性比NS对照组明显升高, 反映了胆碱能系统功能的增强. 食管下段的酸刺激信号, 通过迷走神经的感觉传入纤维, 激活了高级神经中枢及传出迷走神经, 使ChAT的活性增加, ACh释放增多, 以进一步调节食管平滑肌的张力及发挥其胆碱能抗炎作用. 该过程提示, 在急性食管炎发生时, 可以活化由迷走神经所介导的防御机制. 但另一方面, 发生炎症反应的组织产生的促炎细胞因子如IL-1β、IL-6等, 又能反过来抑制ACh的释放[11], 削弱了迷走神经在调节食管动力和炎症反应方面的作用, 从而促使了食管炎症的加重. 既往的实验证实, 在慢性食管炎模型中, 食管肌层ChAT的活力是下降的[21]. 推测这可能与慢性炎症使胆碱能神经进一步受损有关, 具体机制仍有待研究. 我们在实验中还发现, SHAM组ChAT的活性比AP组进一步升高, 除了酸刺激因素以外, 考虑可能与假手术中对迷走神经的机械刺激有关. 而双侧迷走神经切除, 并没有使失去迷走神经支配后的食管内ChAT活性降低. 考虑ChAT活性的居高不下, 可能与食管组织中独立存在的非神经元型胆碱能系统有关; 此外, 迷走神经切除后免疫细胞产生的大量TNF-α、IL-1β等细胞因子, 也可能通过促进神经生长因子(nerve growth factor, NGF)的合成, 间接使ChAT的活性增加[22].
支配食管的迷走神经由兴奋性胆碱能神经和抑制性非肾上腺能非胆碱能(non-adrenergic non-cholinergic, NANC)神经共同组成. 一氧化氮(nitric oxide, NO)作为NANC神经的主要抑制性神经递质, 参与了食管下括约肌功能的调节[23]. 而在食管发生炎症反应时, NO对黏膜的作用具有双重性[24-26]. 一方面NO有强烈的血管扩张作用, 可增加食管黏膜血流以抵抗损伤; 还可以通过减少炎症因子间相互作用、抑制胃酸及增加黏膜层厚度等机制起黏膜保护作用. 另一方面, NO被认为是重要的炎症介质, 不适当的、过量的NO将发挥其细胞毒作用, 对组织产生损伤, 引起急、慢性炎症. NO由NOS催化产生. 在动物模型及GERD患者的实验中均发现, 食管组织内NOS的表达明显增多[27-28]. 本实验结果也证实, 与NS组比较, AP组动物食管组织内NOS的活性呈显著增加. 提示了发生急性食管炎时, NANC神经的功能也伴随着胆碱能神经活性增加而增强. 而在迷走神经切除后, VTM组的组织NOS活性明显下降, 进一步的迷走神经电刺激对NOS的活性也没有显著性影响; 则提示了发生急性炎症时,食管组织中NOS活性的增加, 可能主要是由迷走神经介导. 迷走神经切除后, NOS的活性下降, NO合成减少, 其黏膜保护作用减弱, 可能因此进一步加重了食管黏膜的炎症损害.
总之, 迷走神经可以通过胆碱能抗炎通路, 在急性食管炎发病过程中起了一定的保护作用. 因此, ACh与NO作为迷走神经所释放的最主要的兴奋性和抑制性神经递质, 不仅影响着食管的动力, 还参与了食管炎症的调控. 急性食管炎发生时, 迷走神经功能增强, ChAT和NOS的活性增加. 然而研究证实, GERD患者的迷走神经传入及传出功能均受损[29-30]. 因此, 本实验的研究结果提示: 通过合理调节迷走神经活性, 我们或许可以找到一个有效的治疗GERD的新方案.
胃食管反流病(GERD)是一组由多种因素参与促成的上消化道常见疾病. 许多研究表明, 多种细胞因子在GERD的发病过程中起重要作用. 胆碱能抗炎通路(CAP)对于全身和局部炎症的调控作用, 在近年来备受关注.
纪小龙, 教授, 中国人民解放军武警总医院纳米医学研究所; 刘连新, 教授, 哈尔滨医科大学第一临床医学院普通外科
GERD的发病机制尚未完全清楚, 其病理本质是胃和/或十二指肠反流物导致的炎症过程. 而对于CAP是否参与食管炎的调控, 目前国内外尚未见文献报道.
Borovikova et al研究提示直接电刺激迷走神经可使内毒素休克大鼠体内促炎因子TNF-α、IL-6、IL-18的释放减少, 但并不影响抑炎因子IL-10的释放, 从而阻止了血压的下降. 随后的研究中, CAP对全身和局部炎症的调控作用在失血性休克、心肌梗死、肠梗阻、胰腺炎和实验性关节炎等实验模型中均得到证实.
该研究通过对大鼠食管下段持续滴注0.1 mol/L盐酸-胃蛋白酶溶液建立了急性食管炎模型, 观察了胆碱能抗炎通路在该模型中对食管组织中的细胞因子水平、胆碱乙酰转移酶、一氧化氮合成酶的活性以及食管损伤程度的影响, 详细探讨论证CAP在实验性食管炎中的保护作用及机制.
本研究有助于深入认识GERD发病过程中的神经调节机制, 并为合理干预提供理论依据.
胆碱能抗炎通路: 指中枢神经系统的免疫调节信号通过激活传出迷走神经, 引起外周神经末梢释放乙酰胆碱, 与免疫细胞上具有a7亚单位的N型ACh受体结合, 通过细胞内信号传导抑制促炎因子的释放, 调控炎症反应. 即传出迷走神经具有对炎症反应的神经-免疫调节功能.
本文选题、动物模型的构建、立意均较新颖, 数据真实可靠, 选图精美, 论文逻辑性、可读性均较强.
编辑: 李军亮 电编:吴鹏朕
| 2. | Borovikova LV, Ivanova S, Zhang M, Yang H, Botchkina GI, Watkins LR, Wang H, Abumrad N, Eaton JW, Tracey KJ. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. Nature. 2000;405:458-462. [PubMed] [DOI] |
| 3. | Wang H, Yu M, Ochani M, Amella CA, Tanovic M, Susarla S, Li JH, Wang H, Yang H, Ulloa L. Nicotinic acetylcholine receptor alpha7 subunit is an essential regulator of inflammation. Nature. 2003;421:384-388. [PubMed] [DOI] |
| 5. | Tracey KJ. Physiology and immunology of the cholinergic antiinflammatory pathway. J Clin Invest. 2007;117:289-296. [PubMed] [DOI] |
| 6. | Lanas A, Royo Y, Ortego J, Molina M, Sáinz R. Experimental esophagitis induced by acid and pepsin in rabbits mimicking human reflux esophagitis. Gastroenterology. 1999;116:97-107. [PubMed] [DOI] |
| 7. | Eros G, Kaszaki J, Czobel M, Boros M. Systemic phosphatidylcholine pretreatment protects canine esophageal mucosa during acute experimental biliary reflux. World J Gastroenterol. 2006;12:271-279. [PubMed] |
| 8. | Waite JJ, Holschneider DP, Scremin OU. Selective immunotoxin-induced cholinergic deafferentation alters blood flow distribution in the cerebral cortex. Brain Res. 1999;818:1-11. [PubMed] [DOI] |
| 9. | Fonnum F. A rapid radiochemical method for the determination of choline acetyltransferase. J Neurochem. 1975;24:407-409. [PubMed] [DOI] |
| 10. | Cheng L, Cao W, Behar J, Biancani P, Harnett KM. Inflammation induced changes in arachidonic acid metabolism in cat LES circular muscle. Am J Physiol Gastrointest Liver Physiol. 2005;288:G787-G797. [PubMed] [DOI] |
| 11. | Cao W, Cheng L, Behar J, Fiocchi C, Biancani P, Harnett KM. Proinflammatory cytokines alter/reduce esophageal circular muscle contraction in experimental cat esophagitis. Am J Physiol Gastrointest Liver Physiol. 2004;287:G1131-G1139. [PubMed] [DOI] |
| 12. | Cao W, Cheng L, Behar J, Biancani P, Harnett KM. IL-1beta signaling in cat lower esophageal sphincter circular muscle. Am J Physiol Gastrointest Liver Physiol. 2006;291:G672-G680. [PubMed] [DOI] |
| 13. | Dvorakova K, Payne CM, Ramsey L, Holubec H, Sampliner R, Dominguez J, Dvorak B, Bernstein H, Bernstein C, Prasad A. Increased expression and secretion of interleukin-6 in patients with Barrett's esophagus. Clin Cancer Res. 2004;10:2020-2028. [PubMed] [DOI] |
| 14. | Fitzgerald RC, Onwuegbusi BA, Bajaj-Elliott M, Saeed IT, Burnham WR, Farthing MJ. Diversity in the oesophageal phenotypic response to gastro-oesophageal reflux: immunological determinants. Gut. 2002;50:451-459. [PubMed] [DOI] |
| 15. | Moons LM, Kusters JG, van Delft JH, Kuipers EJ, Gottschalk R, Geldof H, Bode WA, Stoof J, van Vliet AH, Ketelslegers HB. A pro-inflammatory genotype predisposes to Barrett's esophagus. Carcinogenesis. 2008; Jan 12[Epub ahead of print]. [PubMed] |
| 16. | Hamaguchi M, Fujiwara Y, Takashima T, Hayakawa T, Sasaki E, Shiba M, Watanabe T, Tominaga K, Oshitani N, Matsumoto T. Increased expression of cytokines and adhesion molecules in rat chronic esophagitis. Digestion. 2003;68:189-197. [PubMed] [DOI] |
| 17. | Yamaguchi T, Yoshida N, Tomatsuri N, Takayama R, Katada K, Takagi T, Ichikawa H, Naito Y, Okanoue T, Yoshikawa T. Cytokine-induced neutrophil accumulation in the pathogenesis of acute reflux esophagitis in rats. Int J Mol Med. 2005;16:71-77. [PubMed] |
| 19. | Li J, Chen HZ. [The non-neuronal cholinergic system in immunocompetent cells]. Shengli Kexue Jinzhan. 2005;36:193-198. [PubMed] |
| 20. | Jönsson M, Norrgård O, Forsgren S. Presence of a marked nonneuronal cholinergic system in human colon: study of normal colon and colon in ulcerative colitis. Inflamm Bowel Dis. 2007;13:1347-1356. [PubMed] [DOI] |
| 21. | Cao Y, Xie P, Xing Y. [Role of endogenous cholinergic nerve in esophageal dysmotility with reflux esophagitis]. Zhonghua Neike Zazhi. 2001;40:670-672. [PubMed] |
| 22. | Yoshida K, Kakihana M, Chen LS, Ong M, Baird A, Gage FH. Cytokine regulation of nerve growth factor-mediated cholinergic neurotrophic activity synthesized by astrocytes and fibroblasts. J Neurochem. 1992;59:919-931. [PubMed] [DOI] |
| 23. | Tomita R, Kurosu Y, Munakata K. Relationship between nitric oxide and non-adrenergic non-cholinergic inhibitory nerves in human lower esophageal sphincter. J Gastroenterol. 1997;32:1-5. [PubMed] [DOI] |
| 24. | Lanas AI, Blas JM, Ortego J, Soria J, Sáinz R. Adaptation of esophageal mucosa to acid- and pepsin-induced damage: role of nitric oxide and epidermal growth factor. Dig Dis Sci. 1997;42:1003-1012. [PubMed] [DOI] |
| 25. | Soteras F, Lanas A, Fiteni I, Royo Y, Jimenez P, Iñarrea P, Ortego J, Esteva F. Nitric oxide and superoxide anion in low-grade esophagitis induced by acid and pepsin in rabbits. Dig Dis Sci. 2000;45:1802-1809. [PubMed] [DOI] |
| 26. | Zicari A, Corrado G, Cavaliere M, Frandina G, Rea P, Pontieri G, Cardi E, Cucchiara S. Increased levels of prostaglandins and nitric oxide in esophageal mucosa of children with reflux esophagitis. J Pediatr Gastroenterol Nutr. 1998;26:194-199. [PubMed] [DOI] |
| 27. | Liu B, Liu X, Tang C, Liu J, Wang H, Xie P. Esophageal dysmotility and the change of synthesis of nitric oxide in a feline esophagitis model. Dis Esophagus. 2002;15:193-198. [PubMed] [DOI] |
| 28. | 黄 颖秋, 王 昕, 李 骢, 刘 丽. 胃食管反流病患者食管NOS表达及血清NO含量变化的临床意义. 胃肠病学和肝病学杂志. 2000;9:273-275. |