修回日期: 2007-12-25
接受日期: 2007-07-02
在线出版日期: 2008-01-18
目的: 研究人胃癌Runx3基因CpG岛甲基化的关键位点和演进.
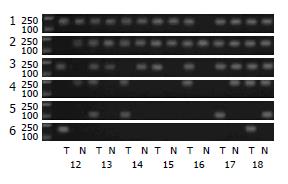
方法: 应用MSP法和Western blot法分别检测26例人胃癌和相应的癌旁正常组织标本Runx3基因CpG岛从5'区向转录起始点方向连续6个位点的甲基化状态和Runx3蛋白的表达.
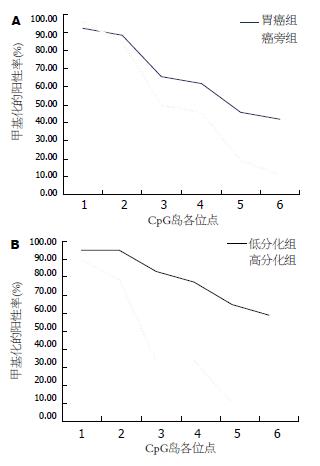
结果: 根据MSP的结果计算出上述连续6个位点的甲基化阳性率, 结果随着向转录起始点方向的演进, 各位点甲基化的阳性率逐渐降低, 胃癌组和癌旁组从第3位点开始出现差异, 至第5和第6位点差异显著(P<0.05); 按照胃癌分化程度分组, 低分化组与高分化组在3-6位点差异显著(P<0.05). 胃癌组与癌旁组Runx3蛋白表达水平(0.499±0.106 vs 0.721±0.080)以及低分化组与高分化组(0.437±0.053 vs 0.617±0.073)Runx3蛋白表达水平均存在显著差异(P<0.01).
结论: 人胃癌Runx3基因CpG岛的甲基化从5'区向转录起始点方向演进, 甲基化的演进与肿瘤的分化程度有关; 转录起始点部位可能为Runx3基因甲基化的关键位点.
引文著录: 宋军民, 刘晓梅, 李岩, 韩成波. 人胃癌Runx3基因CpG岛甲基化的关键位点和演进. 世界华人消化杂志 2008; 16(2): 212-216
Revised: December 25, 2007
Accepted: July 2, 2007
Published online: January 18, 2008
AIM: To investigate the critical regions and spreading of the Runx3 CpG island methylation in human gastric cancer.
METHODS: MSP and Western blot were used for 26 human primary gastric cancer samples and corresponding non-neoplastic gastric mucosa to detect the methylation status in successive six regions ranging from the most 5' region to the transcription start site within the Runx3 CpG island and the expression levels of Runx3 protein, respectively.
RESULTS: The methylation frequencies in the successive six regions calculated by the results of MSP decreased gradually with the regions spreading to the transcription start site. The differences between cancer group and non-neoplastic group arose in the 3rd region, and became significant in the 5th and 6th regions (P < 0.05). When the grouping was related to the differentiation extent, the differences were significant in the 3rd-6th regions between poorly differentiated group and well differentiated group (P < 0.05). As far as the expression levels of Runx3 protein were concerned, the differences were significant between gastric cancer group and non-neoplastic group (0.499 ± 0.106 vs 0.721 ± 0.080, P < 0.01), as well as between poorly differentiated group and well differentiated group(0.437 ± 0.053 vs 0.617 ± 0.073, P < 0.01).
CONCLUSION: Methylation of the Runx3 CpG island spreads from the most 5' region to the transcription start site in human gastric cancer, and the spreading is related to the differentiation extent of tumor. The transcription start site may be a critical region for the methylation of Runx3.
- Citation: Song JM, Liu XM, Li Y, Han CB. Critical regions and spreading of the Runx3 CpG island methylation in human gastric cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(2): 212-216
- URL: https://www.wjgnet.com/1009-3079/full/v16/i2/212.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i2.212
Runx3(PEBP2aC/CBFA3/AML2)是新近发现的一种抑癌基因, 属于runt结构域转录因子家族成员, 参与对细胞生长和凋亡的调控. 近年来, 大量的研究表明Runx3与多种恶性肿瘤尤其是与胃癌的关系非常密切[1-3], Runx3基因的沉默与胃癌的发生和发展有着高度的相关性, 而且也影响着胃癌的治疗效果及预后[4-5], 因而Runx3基因有望成为胃癌诊断的特异性标志物和基因治疗的靶点. 但目前国内外众多文献报道的胃癌Runx3基因甲基化阳性率差异较大, 且其与Runx3表达并不完全平行[6-7], 因此, Runx3基因启动子CpG岛各位点甲基化对于该基因沉默的作用可能不同. 本文通过检测人胃癌及相应的癌旁正常组织标本Runx3基因启动子CpG岛多位点的甲基化状态与Runx3蛋白表达的关系, 对甲基化的关键位点和演进作一推测和探讨.
2006-02/2006-12中国医科大学附属盛京医院手术切除并经病理证实的人胃癌和相应的癌旁正常组织标本各26例(所有标本均于手术切除后0.5 h内取材, 立即置于液氮中, 然后于-80 ℃保存备用, 癌旁正常组织的取材距胃癌原发灶10 cm以上), 其中男性16例, 女性10例, 年龄24-80(平均58.7)岁. 低分化(未分化或低分化)17例, 高分化(中分化或高分化)9例. 根据国际抗癌联盟分期(UICC, 1997), 早期(Ⅰ期和Ⅱ期)11例, 进展期(Ⅲ期和Ⅳ期)15例. 采用HE染色确定肿瘤组织, 主要由肿瘤细胞构成且癌旁正常组织中没有肿瘤细胞浸润.
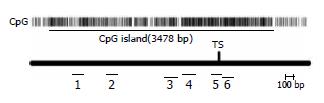
1.2.1 甲基化特异性PCR(methylation specific PCR, MSP)[8]: 取胃癌和癌旁正常组织标本各100 mg用生理盐水冲净后剪成糊状, 采用苯酚-氯仿法提取DNA. 取5 μg(10 μL)DNA, 加入3 mol/L的氢氧化钠15.5 μL和去离子水24.5 μL, 37 ℃孵育15 min, 然后加入新鲜配制的10 mmol/L的对苯二酚15 μL和3 mol/L的亚硫酸氢钠(pH5.0)280 μL, 对提取的DNA进行修饰, 50 ℃保温16-20 h. 修饰后的DNA分别在4 ℃的500 mmol/L的醋酸钠和0.5 mmol/L的对苯二酚溶液中各透析4 h, 然后在4 ℃的0.5 mmol/L的醋酸钠溶液中透析过夜, 最后经4 ℃双蒸水透析过夜. 透析完毕后加入3 mol/L的氢氧化钠5.5 μL, 室温放置10-20 min, 然后加入6 mol/L的醋酸氨40 μL和2×无水冷乙醇, 混匀后置于-20 ℃过夜; 4 ℃、12 000 r/min离心10 min弃上清得DNA沉淀, 加入700 mL/L冷乙醇1 mL, 漂洗1次, 弃上清, 加入去离子水50 μL溶解于-20 ℃保存备用. 采用Runx3基因上述各位点(图1)特异的甲基化引物和非甲基化引物(北京三博远志公司)对处理后的DNA进行扩增, 扩增引物序列参照文献[9]. 反应系统(25 μL): 10×缓冲液2.5 μL, 每种引物各0.1 μL, dNTP 2 μL, Taq聚合酶(大连宝生物公司)0.2 μL, 模板DNA 5 μL, 去离子水15.1 μL; 反应条件: 混合物加热至95 ℃, 持续15 min后, 变性为94 ℃、30 s, 退火为55 ℃(第4-6位点为58 ℃)、60 s, 延伸为72 ℃、60 s, 最后再进行72 ℃延伸10 min, 共进行35个循环. PCR产物经20 g/L琼脂糖凝胶电泳分离, 并经成像分析系统分析结果.
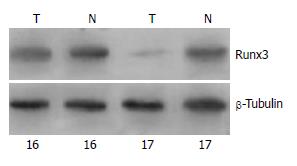
1.2.2 Western blot: 取胃癌和癌旁正常组织标本各150 mg用生理盐水冲净后剪成糊状, 加入6倍体积的组织细胞裂解液进行超声匀浆, 提取总蛋白, Lowry法蛋白定量. 取调节后的蛋白样品各40 μL加5×样品缓冲液10 μL混均, 煮沸3 min冷却后上样. 60 V稳压电泳至溴酚蓝带进入分离胶后再100 V电泳3 h, 100 V转膜40 min, 使凝胶上的蛋白转移至硝酸纤维素膜(NC膜). 用50 g/L牛血清白蛋白室温下封闭2 h, 1×TTBS洗膜两次, 加入新鲜配制的兔抗人Runx3多克隆抗体稀释液(1:400)(sc-30197, Santa Cruz公司), 4 ℃孵育过夜. 将NC膜用1×TBS洗一次, 1×TTBS洗两次, 加入新鲜配制的碱磷酶标记山羊抗兔IgG(1:1000)(北京中杉金桥公司), 室温孵育2 h. 1×TTBS洗膜两次, 1×TBS洗膜一次, 显色液中染色至条带呈现, 终止染色. β-Tubulin(华特生公司)作为内参, 分子质量为Mr 51 000, 重复上述步骤. 用凝胶图像分析系统扫描分析结果, 以Runx3蛋白的灰度值/β-Tubulin的灰度值代表Runx3蛋白的相对表达水平进行统计学分析.
统计学处理 采用SPSS14.0统计软件, 计数资料的组间比较采用χ2检验, 不符合χ2检验条件的采用Fisher确切概率法, 计量资料的结果采用mean±SD表示, 组间比较采用t检验, P<0.05为差异具有统计学意义.
见表1, 胃癌和癌旁组从第3位点开始出现差异, 至第5和第6位点差异显著(P<0.05, 图2, 图3A), 低分化组与高分化组在3-6位点差异显著(P<0.05, 图3B), 而高龄组(≥60岁)与低龄组(<60岁)、男性组与女性组以及早期组与进展期组, 上述各位点的甲基化阳性率无显著差异(P>0.05).
| 临床及病理学参数 | Runx3基因CpG岛各位点的甲基化阳性例数 | Western blot (mean±SD) | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| 标本 | 胃癌组(n = 26) | 24 | 23 | 17 | 16 | 12a | 11a | 0.499±0.106b |
| 癌旁组(n = 26) | 25 | 22 | 13 | 12 | 5 | 3 | 0.721±0.080 | |
| 性别 | 男性组(n = 16) | 14 | 14 | 10 | 9 | 6 | 7 | 0.507±0.101 |
| 女性组(n = 10) | 10 | 9 | 7 | 7 | 6 | 4 | 0.486±0.117 | |
| 年龄 | 高龄组(n = 13) | 13 | 11 | 10 | 10 | 7 | 6 | 0.494±0.114 |
| 低龄组(n = 13) | 11 | 12 | 7 | 6 | 5 | 5 | 0.504±0.101 | |
| 分化程度 | 低分化组(n = 17) | 16 | 16 | 14c | 13c | 11c | 10c | 0.437±0.053d |
| 高分化组(n = 9) | 8 | 7 | 3 | 3 | 1 | 1 | 0.617±0.073 | |
| UICC分期 | 早期组(n = 11) | 10 | 11 | 7 | 6 | 4 | 6 | 0.531±0.126 |
| 进展期组(n = 15) | 14 | 12 | 10 | 10 | 8 | 5 | 0.476±0.085 | |
Runx3蛋白的相对表达水平, 胃癌组为0.499±0.106(n = 26), 癌旁组为0.721±0.080(n = 26), 两组的蛋白表达水平存在显著差异(P<0.01). 低分化组为0.437±0.053(n = 17), 高分化组为0.617±0.073(n = 9), 两组的蛋白表达水平存在显著差异(P<0.01)(图4, 表1). 男性组与女性组、高龄组(≥60岁)与低龄组(<60岁)以及早期组与进展期组, 蛋白表达水平无显著差异(P>0.05, 表1).
胃癌是世界上最常见的恶性肿瘤之一, 他的发生与端粒酶激活、抑癌基因失活和癌基因激活等因素有关, 其中抑癌基因的失活尤为重要[10-11]. 以往研究的抑癌基因, 如E-cadherin、p53、p16、Rb、DCC和APC等, 他们与胃癌的相关性较小, 而新近发现的Runx3可能是迄今为止与胃癌关系最为密切的一种抑癌基因. DNA甲基化是一种后天发生的修饰, 引起胞嘧啶5'甲基化, 在正常机体中普遍存在, 并与年龄相关, 抑癌基因启动子CpG岛高甲基化可使其表达受抑, 与肿瘤的发生密切相关[12-13].
研究表明, Runx3基因启动子CpG岛高甲基化是该基因表达沉默的主要方式之一[1]. Kim et al[2]用MSP法检测了胃癌和各种癌前病变启动子CpG岛的甲基化状态, 结果在慢性胃炎为8.1%(n = 99), 肠化为28.1%(n = 32), 胃腺瘤为27.3%(n = 77), 胃癌为64%(n = 75), 该研究提示Runx3的甲基化阳性率随着癌前病变的演变而增加. 田筱青 et al[6]应用MSP法对17例食管鳞状细胞癌、14例贲门癌及18例胃癌及相应的癌旁正常组织进行检测, 胃癌组的甲基化阳性率为8/18(44%), 而胃癌癌旁组、食管癌组和贲门癌组的甲基化阳性率分别为1/18、0/17和3/14, 该研究提示Runx3基因甲基化对于胃癌具有较高的特异性. Nakase et al[14]应用MSP法研究了12例消化性溃疡术后残胃癌(RB组)和10例胃癌术后残胃癌(RM组)Runx3启动子的甲基化状态, 胃癌组织中Runx3的甲基化阳性率为63.6%(14/22), 癌旁组织中为27.2%(6/22), 进一步研究表明Runx3的甲基化状态与Runx3的表达明显相关, 该研究提示检测残胃Runx3的甲基化状态可以预测残胃恶变的风险. 本文通过MSP法检测了26例胃癌和相应的癌旁正常组织标本Runx3基因启动子CpG岛连续6个位点的甲基化状态, 由于两组的第1和第2位点的甲基化阳性率无差异, 第3-6位点存在差异(第5和6位点差异显著), 因此目前众多实验研究的位点很可能位于该区间, 在本研究中其甲基化阳性率为42.31%-65.38%, 与上述报道相符.
研究表明, Runx3蛋白表达下调是胃癌发生的重要机制之一. Osaki et al[15]应用Western blot法检测了6株胃癌细胞系的Runx3蛋白表达, 其中3株不同程度的表达了Runx3蛋白, 而另3株未表达Runx3蛋白. 曾超 et al[16]应用Western blot法检测25例胃癌标本Runx3蛋白的表达, 结果发现胃癌组织中的Runx3蛋白表达明显低于相应正常胃黏膜组织, 尤其是低分化胃癌更加明显, 而高分化胃癌差异并不明显, 直线相关分析显示胃癌组织中Runx3蛋白和mRNA的表达具有相关性(r = 0.820, P<0.05). Wei et al[5]应用免疫组织化学法研究了86例胃癌组织的Runx3蛋白表达, 结果与正常胃黏膜组织相比, 胃癌组织标本中的Runx3蛋白表达明显降低, 并且与生存期降低明显相关(P = 0.0005), Cox比例风险回归模型显示, Runx3蛋白的表达可独立的预测良好的生存率(P = 0.036), 因而认为Runx3蛋白是影响胃癌预后的独立因素. 本文应用Western blot法检测了26例胃癌及相应的癌旁正常组织的Runx3蛋白表达, 结果表明胃癌组Runx3蛋白表达明显低于癌旁组, 而且Runx3蛋白的表达与肿瘤的分化程度有关, 与上述报道相符.
但目前国内外众多文献报道的人胃癌组织Runx3基因的甲基化阳性率差异较大, 且与Runx3表达并不完全平行. 田筱青 et al[6]用RT-PCR方法研究了8例Runx3甲基化的胃癌标本, 结果仅3例出现mRNA的表达下调; Waki et al[7]用RT-PCR方法检测了5株胃癌细胞系Runx3 mRNA的表达, 其中1株甲基化的Runx3细胞系(KATO-Ⅲ)也表达mRNA. 上述研究表明, 甲基化的Runx3其mRNA表达水平不一定下调, 因此Runx3基因CpG岛不同位点甲基化的结局不同, 可能存在其甲基化能引起该基因表达沉默的"关键位点". 本研究的结果表明, 按性别、年龄和临床分期分组, 各位点的甲基化阳性率无显著差异, 同时该情况下Runx3蛋白的表达亦无显著差异, 而胃癌组与癌旁组以及低分化胃癌组和高分化胃癌组的甲基化阳性率存在显著差异, 同时该情况下Runx3蛋白的表达亦存在显著差异(P<0.01), 这种现象提示, 转录起始点部位(即文中第5、6位点)的甲基化很可能引起Runx3蛋白的表达下调, 因此该部位可能为Runx3基因启动子CpG岛甲基化的关键位点. 同时本研究结果表明, 从5'区向转录起始点方向连续6个位点的甲基化阳性率逐渐降低, 提示甲基化最初可能发生在Runx3基因CpG岛的5'端, 并逐渐向转录起始点方向演进, 与文献报道相符[9]; 进一步统计分析表明, 各位点的甲基化阳性率与性别、年龄和临床分期无关, 而第3-6位点的阳性率与肿瘤的分化程度有关, 提示甲基化的演进可能与肿瘤的分化程度相关, 而与性别、年龄和临床分期无关.
总之, Runx3作为新近发现的一种抑癌基因, 受到越来越多的关注和研究, 有望成为胃癌诊断的特异性标志物和基因治疗的靶点, 通过本文的研究可以确定该基因启动子CpG岛甲基化的演进方向和关键位点, 从而为基因诊断和治疗提供依据.
Runx3基因甲基化与胃癌的发生密切相关, 但目前国内外众多文献报道的人胃癌组织中Runx3基因甲基化的阳性率差异较大, 且与Runx3表达并不完全平行, 甲基化的Runx3其表达水平不一定下调, 提示各实验研究的位点不同以及不同位点甲基化的结局亦不同, 可能存在其甲基化能引起该基因表达沉默的"关键位点".
王文跃, 主任医师, 中日友好医院普通外科; 欧希龙, 副教授, 东南大学中大医院消化科
本实验通过检测人胃癌及相应的癌旁正常组织标本Runx3基因启动子CpG岛多位点的甲基化状态与Runx3蛋白表达的关系, 研究Runx3基因启动子CpG岛甲基化的演进方向和关键位点.
通过本文的研究可以确定Runx3基因启动子CpG岛甲基化的演进方向和关键位点, 从而为胃癌的基因诊断和治疗提供依据.
本实验设计合理, 研究具有一定新颖性, 讨论充分有说服力, 具有较强的临床指导意义.
编辑: 李军亮 电编:郭海丽
| 1. | Li QL, Ito K, Sakakura C, Fukamachi H, Inoue K, Chi XZ, Lee KY, Nomura S, Lee CW, Han SB. Causal relationship between the loss of RUNX3 expression and gastric cancer. Cell. 2002;109:113-124. [PubMed] |
| 2. | Kim TY, Lee HJ, Hwang KS, Lee M, Kim JW, Bang YJ, Kang GH. Methylation of RUNX3 in various types of human cancers and premalignant stages of gastric carcinoma. Lab Invest. 2004;84:479-484. [PubMed] |
| 3. | Guo WH, Weng LQ, Ito K, Chen LF, Nakanishi H, Tatematsu M, Ito Y. Inhibition of growth of mouse gastric cancer cells by Runx3, a novel tumor suppressor. Oncogene. 2002;21:8351-8355. [PubMed] |
| 4. | Guo C, Ding J, Yao L, Sun L, Lin T, Song Y, Sun L, Fan D. Tumor suppressor gene Runx3 sensitizes gastric cancer cells to chemotherapeutic drugs by downregulating Bcl-2, MDR-1 and MRP-1. Int J Cancer. 2005;116:155-160. [PubMed] |
| 5. | Wei D, Gong W, Oh SC, Li Q, Kim WD, Wang L, Le X, Yao J, Wu TT, Huang S. Loss of RUNX3 expression significantly affects the clinical outcome of gastric cancer patients and its restoration causes drastic suppression of tumor growth and metastasis. Cancer Res. 2005;65:4809-4816. [PubMed] |
| 7. | Waki T, Tamura G, Sato M, Terashima M, Nishizuka S, Motoyama T. Promoter methylation status of DAP-kinase and RUNX3 genes in neoplastic and non-neoplastic gastric epithelia. Cancer Sci. 2003;94:360-364. [PubMed] |
| 8. | Herman JG, Graff JR, Myohanen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci USA. 1996;93:9821-986. [PubMed] |
| 9. | Homma N, Tamura G, Honda T, Matsumoto Y, Nishizuka S, Kawata S, Motoyama T. Spreading of methylation within RUNX3 CpG island in gastric cancer. Cancer Sci. 2006;97:51-56. [PubMed] |
| 10. | Yasui W, Yokozaki H, Fujimoto J, Naka K, Kuniyasu H, Tahara E. Genetic and epigenetic alterations in multistep carcinogenesis of the stomach. J Gastroenterol. 2000;35 Suppl 12:111-115. [PubMed] |
| 11. | Tamura G. Alterations of tumor suppressor and tumor-related genes in the development and progression of gastric cancer. World J Gastroenterol. 2006;12:192-198. [PubMed] |
| 12. | So K, Tamura G, Honda T, Homma N, Waki T, Togawa N, Nishizuka S, Motoyama T. Multiple tumor suppressor genes are increasingly methylated with age in non-neoplastic gastric epithelia. Cancer Sci. 2006;97:1155-1158. [PubMed] |
| 13. | Roa JC, Anabalon L, Roa I, Tapia O, Melo A, Villaseca M, Araya JC. Promoter methylation profile in gastric cancer. Rev Med Chil. 2005;133:874-880. [PubMed] |
| 14. | Nakase Y, Sakakura C, Miyagawa K, Kin S, Fukuda K, Yanagisawa A, Koide K, Morofuji N, Hosokawa Y, Shimomura K. Frequent loss of RUNX3 gene expression in remnant stomach cancer and adjacent mucosa with special reference to topography. Br J Cancer. 2005;92:562-569. [PubMed] |
| 15. | Osaki M, Moriyama M, Adachi K, Nakada C, Takeda A, Inoue Y, Adachi H, Sato K, Oshimura M, Ito H. Expression of RUNX3 protein in human gastric mucosa, intestinal metaplasia and carcinoma. Eur J Clin Invest. 2004;34:605-612. [PubMed] |