修回日期: 2008-01-11
接受日期: 2008-01-14
在线出版日期: 2008-01-18
探讨CCl4大鼠肝硬化形成过程中Caspase-12蛋白表达与肝细胞凋亡的相关性.
方法: 首次CCl4 3 mL/kg sc, 以后500 mL/L CCl4橄榄油溶液2 mL/kg sc, 2次/wk, 共计12 wk制备大鼠肝硬化模型. 设4 wk、8 wk、12 wk 3个时间点, 动态观察肝细胞凋亡指数、肝组织Caspase-12免疫组织化学及蛋白表达.
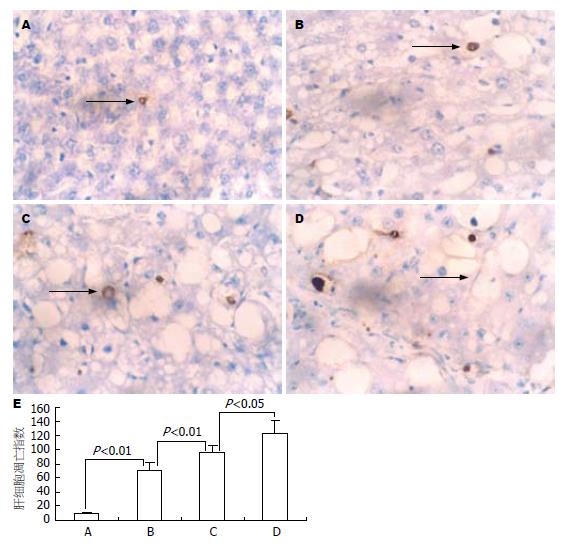
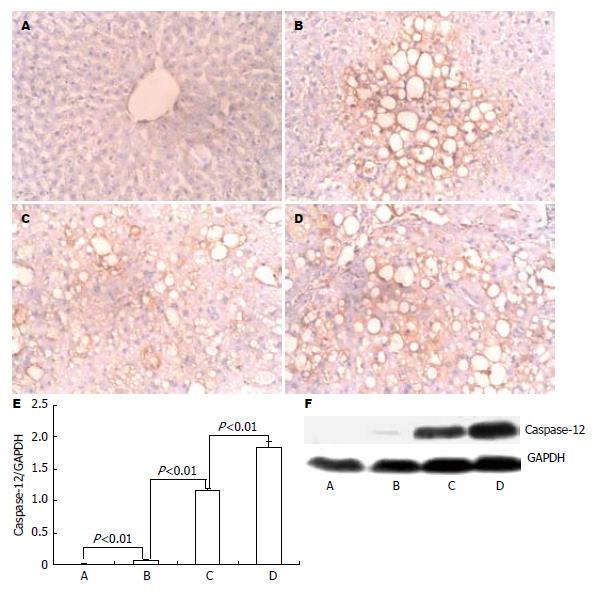
结果: 模型大鼠4 wk时呈典型的急性肝损伤改变, 8 wk时大鼠呈典型的慢性肝损伤肝纤维化的病理改变, 12 wk时已形成肝硬化; 随着肝损伤加重和肝硬化形成, 肝细胞凋亡指数显著增加, 模型对照4 wk与正常组、模型对照8 wk比较有显著差异(70.4±11.59 vs 9.6±1.14, 95.8±10.94, P<0.01), 模型对照12 wk与模型对照8 wk比较有统计学意义(122.8±17.51 vs 95.8±10.94, P<0.05). Caspase-12蛋白表达亦显著增加, 模型对照4 wk与正常组、模型对照8 wk比较有显著差异(0.071±0.014 vs 0.014±0.007, 1.172±0.028, P<0.01), 模型对照12 wk与模型对照8 wk比较亦有显著差异(1.84±0.083 vs 1.172±0.028, P<0.01); 且肝细胞凋亡指数和Caspase-12蛋白表达量之间呈正相关(r = 0.89, t = 9.125, P<0.01).
结论: 内质网凋亡通路参与CCl4大鼠肝硬化形成过程中肝细胞凋亡事件, 其关键的凋亡酶Caspase-12蛋白表达量基本能够反映肝细胞的凋亡程度.
引文著录: 慕永平, 刘平, 都广礼, 王磊, 龙爱华, 李风华. CCl4诱导大鼠肝硬化形成过程中Caspase-12蛋白表达与肝细胞凋亡的相关性. 世界华人消化杂志 2008; 16(2): 132-137
Revised: January 11, 2008
Accepted: January 14, 2008
Published online: January 18, 2008
AIM: To investigate the correlation between expression of Caspase-12 protein and apoptosis of hepatocytes during rat liver cirrhosis induced by carbon tetrachloride (CCl4).
METHODS: Liver cirrhosis in male Wistar rats was induced by subcutaneous injection of undiluted CCl4 (3 mL/kg body wt) followed by 500 mL/L CCl4-olive solution (2 mL/kg body wt) twice a week for 12 weeks. Hepatocyte apoptosis indices (TUNEL staining), immunohistochemistry and expression of Caspase-12 protein were observed dynamically at wk 4, 8, 12 during the modeling course.
RESULTS: Typical acute liver injury was observed at wk 4, typical chronic liver injury and fibrosis at wk 8 and typical cirrhosis at wk 12, respectively. When the liver injury and cirrhosis became aggravated, hepatocyte apoptotic index increased significantly in the 4-week model group, compared with normal group and 8-week model group (70.4 ± 11.59 vs 9.6 ± 1.14, 95.8 ± 10.94, P < 0.01). There were significant differences in hepatocyte apoptotic index between 12- and 8- week model groups (122.8 ± 17.51 vs 95.8 ± 10.94, P < 0.05). Caspase protein expression increased significantly in the 4-week model group, compared with the normal group and 8-week model group (0.071 ± 0.014 vs 0.014 ± 0.007 and 1.172 ± 0.028, P < 0.01). There were significant differences in Caspase-12 protein expression between 12- and 8- week model groups (1.84 ± 0.083 vs 1.172 ± 0.028, P < 0.01). Furthermore, hepatocyte apoptotic index was positively correlated to Caspase-12 protein expression (r = 0.89, t = 9.125, P < 0.01).
CONCLUSION: Endoplastic reticulum apoptosis pathway is involved in hepatocyte apoptosis during rat liver cirrhosis induced by CCl4. Expression of Caspase-12 protein, the key molecule in this pathway, represents the degree of hepatocyte apoptosis.
- Citation: Mu YP, Liu P, Du GL, Wang L, Long AH, Li FH. Correlation between expression of Caspase-12 protein and apoptosis of hepatocytes during rat liver cirrhosis induced by carbon tetrachloride. Shijie Huaren Xiaohua Zazhi 2008; 16(2): 132-137
- URL: https://www.wjgnet.com/1009-3079/full/v16/i2/132.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i2.132
长期以来, 肝纤维化的研究主要是针对纤维结缔组织的合成及降解过程, 近年来, 已开始重视保护肝实质细胞及组织支架的完整性这一始发因素以及干细胞对肝纤维化的影响, 而且可能是今后抗肝纤维化治疗研究的重要方向. 炎症反应、肝星状细胞活化及肝实质细胞凋亡是各种慢性肝病的共同特征[1], 肝细胞凋亡在肝纤维化、肝硬化的形成过程中发挥着重要的作用. 在有害刺激条件下发生的"病理性"凋亡可导致趋化性/炎症性因子的释放, 加重肝损伤并激活HSCs[2], 加速肝纤维化、肝硬化的形成, 因此, 抑制肝细胞凋亡也许是抗肝纤维化的重要策略[3]. 已有的研究显示, CCl4诱导的大鼠肝纤维化进展期存在大量的肝细胞凋亡[4], 肝脏蛋白质组差异表达研究显示, CCl4造模12 wk后模型大鼠有Caspase-12蛋白表达[5], Caspase-12是内质网凋亡通路的关键酶, 而目前关于内质网凋亡通路在肝纤维化中的作用尚未见报道. 本文重点观察了CCl4大鼠肝硬化形成过程中肝细胞凋亡和Caspase-12的动态变化, 探讨Caspase-12蛋白表达与肝细胞凋亡的相关性, 现将研究结果报告如下.
动物: 清洁级Wistar♂大鼠47只, 体质量130-150 g, 购自中国科学院上海实验动物中心, 上海中医药大学实验动物中心饲养、造模和观察, 自由饮食. CCl4(分析纯), 橄榄油购自中国医药集团上海化学试剂公司; 肝功能测定试剂盒购自卫生部上海生物制品研究所及南京建成生物工程研究所; TUNEL原位凋亡检测试剂盒购自CHEMICON公司; 山羊抗大鼠Caspase-12多克隆抗体购自Santa Cruz公司; 小鼠抗GAPDH mAb购自KangChen公司; HRP标记的兔抗山羊二抗购自北京中杉公司; HRP标记的山羊抗小鼠二抗购自CHEMICON公司.
1.2.1 模型制备: 首次sc CCl4 3 mL/kg剂量, 以后用500 mL/L的CCl4橄榄油溶液2 mL/kg剂量sc, 每周2次, 共12 wk.
1.2.2 样品的采集和处理: 造模4 wk、8 wk后, 随机抽取正常及模型大鼠各6只, 处死作动态观察. 其余模型大鼠继续造模至12 wk末. 大鼠用20 g/L戊巴比妥钠以2 mL/kg体质量剂量ip麻醉后, 仰卧位固定, 打开腹腔, 经下腔静脉采血, 4 ℃静置3 h后, 3000 r/min 30 min离心, 分离血清, 检测各项血清学指标. 摘取肝脾, 从肝右叶切取1.0 cm×0.8 cm×0.3 cm大小肝组织1块, 40 g/L中性甲醛固定, 脱水、包埋、切片, 进行HE、胶原染色及免疫组织化学观察, 留取肝组织进行羟脯氨酸(Hyp)含量测定.
1.2.3 观测指标与方法: 一般情况: 包括大鼠的死亡情况, 体质量、肝脏大体形态、肝脏及脾脏质量. 肝组织切片: HE及胶原染色, 观察肝脏组织学变化. 肝组织Hyp含量测定: 参照Jamall et al[6]的方法进行. 肝细胞原位凋亡检测: 实验步骤参考试剂盒说明书方法. 凋亡肝细胞的形态学识别参考Shi et al[4]的方法, 即对于模型组及药物干预组, 在脂肪变肝细胞中凡满足下列条件之一者确定为凋亡肝细胞: (1)核呈新月牙状; (2)核浓缩; (3)核碎裂; (4)出现凋亡小体. 每组取6个样本, 每个样本计数5个不同视野凋亡肝细胞的总数. Caspase-12免疫组织化学: 二步法. Caspase-12蛋白表达: Western blot方法, 每组取4个样本, 提取总蛋白, 测定蛋白浓度, 等量蛋白混合, 上样量为30 μg, 样品95 ℃-100 ℃变性5-10 min, SDS聚丙烯酰胺凝胶电泳, 转膜, 50 g/L脱脂奶粉室温封闭1 h, 加入一抗稀释液[Caspase-12, 1:100; GAPDH(内参照), 1:100]4 ℃孵育过夜, TTBS洗涤, 与HRP偶联的二抗室温孵育1 h, TTBS洗涤, ECL显影、曝光, FR-980生物电泳图像分析系统分析底片中的目的条带, 计算机自动读取并记录每条带的积分值, 同一张膜重新封闭, 检测GAPDH的蛋白表达, 方法同上.
统计学处理 计量资料用统计分析软件SPSS11.5中的ANOVA程序进行单因素方差分析, q检验, 并用LSD进行两两比较; 相关分析采用双侧t检验.
造模前8 wk大鼠死亡5只. 造模初期, 模型大鼠体质量仍有所增加, 3 wk后逐渐下降, 与同期正常大鼠比较均具有显著性差异(P<0.01); 肝指数8 wk呈最高, 12 wk降低的趋势, 与同期正常大鼠比较均具有显著性差异(P<0.01); 脾指数逐渐增加, 与同期正常大鼠比较均具有显著性差异(P<0.01).
HE染色显示正常大鼠肝小叶结构清晰, 肝细胞索由中央静脉向四周呈放射状排列. 与正常大鼠比较, 4 wk后模型大鼠可见以中央静脉为中心的肝细胞脂肪变性, 汇管区周围未受损的肝细胞呈孤立的岛状结构, 可见极菲薄的胶原纤维在脂肪变区域伸展. 8 wk后, 模型大鼠肝细胞脂肪变性累及整个肝小叶, 可见较细的胶原纤维形成不完全包绕, 间隔内可见较多的成纤维细胞, 少量炎性细胞浸润, 大胆管损害明显, 小胆管增生. 12 wk后, 正常肝小叶结构消失, 大量的纤维结缔组织增生, 形成大小不一的典型假小叶结构, 部分假小叶内可见新生幼稚的肝细胞, 间隔内可见大量的成纤维细胞和炎性细胞浸润, 极少见正常的胆管样结构, 小胆管增生明显.
天狼星红胶原染色显示, 正常大鼠仅在汇管区和中央静脉壁见少量胶原纤维. 4 wk模型大鼠胶原纤维呈星芒状在脂肪变区域伸展, 中央静脉管壁明显增厚. 8 wk模型大鼠纤维间隔增厚, 少数向小叶内延伸, 极少部分形成较疏松的纤维包绕肝细胞. 12 wk模型大鼠纤维间隔增宽致密, 形成大小不一的完整假小叶结构.
与正常组比较, 随着肝硬化的进展, 模型对照组大鼠ALT、AST、GGT、TBil及Hyp逐渐升高, 12 wk时达到高峰, 且12 wk时AST、GGT、TBil及Hyp显著高于4 wk、8 wk模型对照组(P<0.01); 血清Alb逐渐降低, 12 wk时显著低于4 wk、8 wk模型对照组(P<0.01)(表1).
| 分组 | n | ALT(U/L) | AST(U/L) | TBil(μmol/L) | GGT(U/L) | Alb(g/L) | Hyp(μg/g湿肝) | |
| 正常组 | 8 | 32.80±8.84b | 125.08±23.46b | 5.73±0.40df | 5.29±1.75df | 33.28±1.06b | 195.83±7.16b | |
| 模型对照组 | 4 wk | 6 | 239.58±42.08 | 261.42±24.83f | 5.81±0.97df | 6.57±2.06df | 28.90±1.85df | 312.85±70.83df |
| 8 wk | 6 | 237.30±17.56 | 267.94±57.24f | 12.20±3.19f | 32.76±9.17f | 26.48±1.85f | 461.33±51.74f | |
| 12 wk | 10 | 257.83±33.50 | 339.36±19.24 | 26.43±9.46 | 46.44±5.09 | 22.02±2.40 | 818.42±67.95 |
正常大鼠有少量肝细胞凋亡, 随着造模时间的延长, 肝细胞凋亡数目逐渐增多, 且不同时间点相互比较均具有显著性差异(P<0.05或P<0.01, 图1).
免疫组化显示, 正常大鼠肝细胞胞质内有少量Caspase-12阳性表达, 模型大鼠脂肪变肝细胞胞质内强阳性表达, 与肝细胞凋亡发生的部位相一致, 并随着模型的加重而阳性表达明显增强.
Western blot显示正常大鼠有微量Caspase-12表达, 造模4 wk时明显增加, 12 wk时达到最高, 且显著高于4 wk、8 wk模型对照组(P<0.01, 图2).
肝细胞凋亡指数和Caspase-12蛋白表达量之间的相关性分析显示, 两者之间呈显著的正相关(r = 0.89, t = 9.125, P<0.01).
Caspase蛋白酶在脊椎动物的凋亡事件中扮演着非常重要的角色[7-8], 死亡受体诱导的凋亡具有Caspase依赖性[9-10], Caspase相关的凋亡信号传导通路至少有三种, 包括线粒体/细胞色素c通路、死亡受体通路和内质网通路等[11]. 近年来, 内质网凋亡通路受到普遍关注, 内质网(endoplasmic reticulum, ER)不但在维持细胞内钙离子内环境稳定以及膜蛋白的合成、修饰和折叠方面发挥关键性作用[12], 同时也在凋亡信号处理过程中发挥重要作用. 一定程度的内质网应激(endoplasmic reticulum stress, ERS)能够激活细胞保护机制, 但当应激原强度超过细胞自身处理能力时, 保护机制便不能与损伤相抗衡, ERS即可通过Caspase-12启动特有的ER性细胞凋亡途径, 这种凋亡途径是不同于死亡受体或经线粒体介导凋亡的一种新的细胞凋亡途径, 称之为ER相关性死亡(ER associated death, ERAD)途径[13]. Caspase-12是ERS介导的细胞凋亡特异性启动蛋白酶[14], 在ERS时被激活, 是ER特有的Caspase, Caspase-12缺陷细胞较有Caspase-12表达的细胞对ERS介导的凋亡具有更强的抵抗, 而对非内质网应激介导的凋亡, 二者的敏感性相似[15-16], 表明Caspase-12与内质网应激介导凋亡的机制有关, 而与非内质网应激介导的凋亡无关. 各种损伤都会导致内质网应激诱导Caspase-12表达, 同时也诱导胞质中的Caspase-7向内质网表面迁移, Caspase-7与Caspase-12相结合并打开Caspase-12的前域使其活化, 最终加速了细胞死亡[17-19], 目前已经证实多种慢性肝病的发病机制均与ERS引起的损伤有关[20-23]. 从治疗学上讲, 尽管关于人类Caspase-12的功能还存在着不同观点和争议[24-25],
但许多研究表明在人类细胞有Caspase-12存在, 并与ERS介导的凋亡有关[15,26-28], 目前已有研究表明神经生长因子能够通过抑制Caspase-12的活性来抑制ERS所导致的细胞凋亡[29], 加之Caspase-12有很好的安全性, 因为Caspase-12基因敲除小鼠模型无明显发育或行为缺陷, 肿瘤发生率未见异常, 表明Caspase-12可能对正常发育或肿瘤形成并不重要, 因此Caspase-12有可能成为较理想的抗凋亡治疗靶标[26,30].
本实验结果显示, 肝细胞凋亡指数和Caspase-12的蛋白表达在急性肝损伤期既明显增加, 随着肝纤维化、肝硬化的形成, 肝细胞凋亡指数于4 wk、8 wk、12 wk较正常组分别增加了6.33倍、8.98倍、11.79倍; Caspase-12蛋白表达量较正常组分别增加了4.07倍、82.71倍、130.43倍. 表明对于CCl4大鼠肝硬化模型, 随着肝纤维化的进展, 肝细胞凋亡和Caspase-12蛋白表达呈递增趋势, 与肝纤维化的进展程度相一致, 且肝细胞凋亡指数和Caspase-12蛋白表达量之间有较好的相关性, 提示内质网凋亡通路参与了毒物刺激条件下肝细胞的凋亡事件和肝纤维化的进展, 其关键的凋亡酶Caspase-12基本能够反应肝细胞的凋亡程度, 并有可能成为将来抗凋亡治疗的新靶点.
肝细胞凋亡在肝纤维化、肝硬化的形成过程中发挥重要的作用, 近年来, 内质网凋亡通路受到普遍关注, 而Caspase-12在这一凋亡通路中发挥着关键作用, 但其在肝纤维化、肝硬化形成过程中的动态变化及与肝细胞凋亡的相关性尚不清楚.
黄晓东, 副主任医师, 武汉市中心医院消化内科
Caspase-12是ERS介导的细胞凋亡特异性启动蛋白酶, 而对非内质网应激介导凋亡的抵抗作用不明显, 现已证实多种慢性肝病的发病机制均与ERS有关, 并有证据表明在人类细胞有Caspase-12存在, 且与ERS介导的凋亡有关, Caspase-12的安全性及对ERS的特异性使其有可能成为较理想的抗凋亡治疗靶标.
本文重点观察了CCl4诱导肝硬化形成过程中肝细胞凋亡指数与Caspase-12蛋白表达量的动态变化以及二者之间的相关性, 提出 Caspase-12蛋白表达量的变化可能能够直接反应肝细胞的凋亡程度.
本文研究结果提示在肝硬化形成过程中Caspase-12与肝细胞凋亡密切相关, 可能成为反映慢性肝病肝细胞凋亡程度的重要指标, 加之其安全性, 有可能成为抗凋亡治疗的新靶标.
本文的科学性、创新性能较好地反映我国消化病学临床和基础研究的先进水平.
编辑: 周晓武 电编:刘勇
| 1. | Canbay A, Feldstein A, Baskin-Bey E, Bronk SF, Gores GJ. The caspase inhibitor IDN-6556 attenuates hepatic injury and fibrosis in the bile duct ligated mouse. J Pharmacol Exp Ther. 2004;308:1191-1196. [PubMed] |
| 2. | Canbay A, Friedman S, Gores GJ. Apoptosis: the nexus of liver injury and fibrosis. Hepatology. 2004;39:273-278. [PubMed] |
| 3. | Higuchi H, Gores GJ. Mechanisms of liver injury: an overview. Curr Mol Med. 2003;3:483-490. [PubMed] |
| 4. | Shi J, Aisaki K, Ikawa Y, Wake K. Evidence of hepatocyte apoptosis in rat liver after the administration of carbon tetrachloride. Am J Pathol. 1998;153:515-525. [PubMed] |
| 5. | 刘 莺, 刘 平, 刘 成海, 胡 义杨, 徐 列明, 慕 永平, 都 广礼. 细胞增殖与凋亡相关蛋白质在大鼠肝纤维化形成与消减中的动态变化. 中华肝脏病杂志. 2005;18:563-566. |
| 6. | Jamall IS, Finelli VN, Que Hee SS. A simple method to determine nanogram levels of 4-hydroxyproline in biological tissues. Anal Biochem. 1981;112:70-75. [PubMed] |
| 9. | Ashkenazi A, Dixit VM. Death receptors: signaling and modulation. Science. 1998;281:1305-1308. [PubMed] |
| 12. | Nakamura K, Bossy-Wetzel E, Burns K, Fadel MP, Lozyk M, Goping IS, Opas M, Bleackley RC, Green DR, Michalak M. Changes in endoplasmic reticulum luminal environment affect cell sensitivity to apoptosis. J Cell Biol. 2000;150:731-740. [PubMed] |
| 13. | Oyadomari S, Araki E, Mori M. Endoplasmic reticulum stress-mediated apoptosis in pancreatic beta-cells. Apoptosis. 2002;7:335-345. [PubMed] |
| 15. | Nakagawa T, Zhu H, Morishima N, Li E, Xu J, Yankner BA, Yuan J. Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-beta. Nature. 2000;403:98-103. [PubMed] |
| 16. | Mouw G, Zechel JL, Gamboa J, Lust WD, Selman WR, Ratcheson RA. Activation of caspase-12, an endoplasmic reticulum resident caspase, after permanent focal ischemia in rat. Neuroreport. 2003;14:183-186. [PubMed] |
| 17. | Nakagawa T, Yuan J. Cross-talk between two cysteine protease families. Activation of caspase-12 by calpain in apoptosis. J Cell Biol. 2000;150:887-894. [PubMed] |
| 18. | Rao RV, Peel A, Logvinova A, del Rio G, Hermel E, Yokota T, Goldsmith PC, Ellerby LM, Ellerby HM, Bredesen DE. Coupling endoplasmic reticulum stress to the cell death program: role of the ER chaperone GRP78. FEBS Lett. 2002;514:122-128. [PubMed] |
| 19. | Rao RV, Hermel E, Castro-Obregon S, del Rio G, Ellerby LM, Ellerby HM, Bredesen DE. Coupling endoplasmic reticulum stress to the cell death program. Mechanism of caspase activation. J Biol Chem. 2001;276:33869-33874. [PubMed] |
| 20. | Ji C, Kaplowitz N. Betaine decreases hyperhomo-cysteinemia, endoplasmic reticulum stress, and liver injury in alcohol-fed mice. Gastroenterology. 2003;124:1488-1499. [PubMed] |
| 21. | Rodrigues CM, Ma X, Linehan-Stieers C, Fan G, Kren BT, Steer CJ. Ursodeoxycholic acid prevents cytochrome c release in apoptosis by inhibiting mitochondrial membrane depolarization and channel formation. Cell Death Differ. 1999;6:842-854. [PubMed] |
| 22. | Pavio N, Romano PR, Graczyk TM, Feinstone SM, Taylor DR. Protein synthesis and endoplasmic reticulum stress can be modulated by the hepatitis C virus envelope protein E2 through the eukaryotic initiation factor 2alpha kinase PERK. J Virol. 2003;77:3578-3585. [PubMed] |
| 23. | Tardif KD, Mori K, Siddiqui A. Hepatitis C virus subgenomic replicons induce endoplasmic reticulum stress activating an intracellular signaling pathway. J Virol. 2002;76:7453-7459. [PubMed] |
| 24. | Saleh M, Vaillancourt JP, Graham RK, Huyck M, Srinivasula SM, Alnemri ES, Steinberg MH, Nolan V, Baldwin CT, Hotchkiss RS. Differential modulation of endotoxin responsiveness by human caspase-12 polymorphisms. Nature. 2004;429:75-79. [PubMed] |
| 25. | Fischer H, Koenig U, Eckhart L, Tschachler E. Human caspase 12 has acquired deleterious mutations. Biochem Biophys Res Commun. 2002;293:722-726. [PubMed] |
| 26. | Morishima N, Nakanishi K, Takenouchi H, Shibata T, Yasuhiko Y. An endoplasmic reticulum stress-specific caspase cascade in apoptosis. Cytochrome c-independent activation of caspase-9 by caspase-12. J Biol Chem. 2002;277:34287-34294. [PubMed] |
| 27. | Xie Q, Khaoustov VI, Chung CC, Sohn J, Krishnan B, Lewis DE, Yoffe B. Effect of tauroursodeoxycholic acid on endoplasmic reticulum stress-induced caspase-12 activation. Hepatology. 2002;36:592-601. [PubMed] |
| 28. | Bitko V, Barik S. An endoplasmic reticulum-specific stress-activated caspase (caspase-12) is implicated in the apoptosis of A549 epithelial cells by respiratory syncytial virus. J Cell Biochem. 2001;80:441-454. [PubMed] |