修回日期: 2007-12-03
接受日期: 2008-01-03
在线出版日期: 2008-01-18
目的: 研究黄芪总苷(AST)对小鼠日本血吸虫病肝纤维化和虫卵肉芽肿的影响.
方法: 以日本血吸虫尾蚴感染ICR小鼠制作肝纤维化动物模型, 5 wk末随机分为: AST高剂量组20 mg/(kg·d)、AST低剂量组10 mg/(kg·d)、阳性药护肝片组540 mg/(kg·d)和模型对照组, 各组均于感染40 d后, 吡喹酮杀虫2 d 500 mg/(kg·d). 同时设置正常对照组30只. 感染后6、10和14 wk每组随机处死10只, 观察肝脏指数, 应用HE和天狼猩红染色观察小鼠虫卵结节大小及纤维化程度; 构建组织芯片, 应用免疫组织化学方法检测虫卵结节中Ⅰ、Ⅲ型胶原蛋白的表达.
结果: 感染后10、14 wk, AST高、低剂量组与模型组相比较, 肝组织中血吸虫虫卵结节显著缩小, 纤维化程度明显减轻,Ⅰ、Ⅲ型胶原蛋白含量(MOD)明显减低(10 wk: 0.093±0.002、0.084±0.003 vs 0.134±0.004, P<0.01; 0.074±0.002、0.104±0.005 vs 0.146±0.008, P<0.05; 14 wk: 0.099±0.004、0.095±0.004 vs 0.141±0.007, P<0.01; 0.070±0.003、0.077±0.003 vs 0.101±0.004, P<0.05). 感染10 wk, AST高、低剂量组Ⅲ型胶原蛋白含量有统计学差异(P<0.01).
结论: AST通过抑制虫卵结节、减少Ⅰ、Ⅲ型胶原的合成发挥抗小鼠日本血吸虫病肝纤维化的作用.
引文著录: 丁向东, 王红群, 吴强, 汪学龙, 黄焰, 张晴, 杨枫. 黄芪总苷对小鼠日本血吸虫病肝纤维化的影响. 世界华人消化杂志 2008; 16(2): 125-131
Revised: December 3, 2007
Accepted: January 3, 2008
Published online: January 18, 2008
AIM: To investigate the effect of astrogalosides on periovular granuloma and liver fibrosis in mice with schistosomiasis japonica.
METHODS: One hundred and twenty ICR mice were infected with cercarie of Schistosoma japonicum. The infected mice were divided randomly into four groups at the end of the 5th week after infection: model group, high dose astrogaloside group (20 mg/kg per day), low dose astrogaloside group (10 mg/kg per day) and liver protection tablet (Hugan pian) group (540 mg/kg per day) as positive drug control group. Forty days after infection, the four groups were treated with praziquantel (500 mg/kg per day) for 2 days. Thirty healthy ICR mice were used in this experiment as normal control group. Ten mice in each group were sacrificed at the end of the 6th, 10th and 14th weeks, respectively. Meanwhile, the liver index, hematoxylin and eosin stain and Sirius red stain were used to evaluate the mean area of periovular nodules and the degree of liver fibrosis. Types Ⅰ and Ⅲ collagen on tissue microarray sections were detected by immunohistochemistry.
RESULTS: At the end of either the 10th or the 14th week in groups receiving two different doses of astrogalosides, the mean area of periovular nodules was decreased significantly, the degree of liver fibrosis and the expression of types Ⅰ and Ⅲ collagen (P < 0. 01 or P < 0. 05) was also reduced in comparison with those in the model group. The mean optical density values at the end of the 10th week in the high and low dose astrogaloside groups and the model group were 0.093 ± 0.002, 0.084 ± 0.003 and 0.134 ± 0.004 for type Ⅰ collagen, and 0.074 ± 0.002, 0.104 ± 0.005 and 0.146 ± 0.008 for type Ⅲ collagen, and those at the end of the 14th week in the three groups were 0.099 ± 0.004, 0.095 ± 0.004 and 0.141 ± 0.007 for type Ⅰ collagen, and 0.070 ± 0.003, 0.077 ± 0.003 and 0.101 ± 0.004 for type Ⅲ collagen. Meanwhile, there was a significant difference in the protein expression of type Ⅲ collagen between the high and low dose astrogaloside groups at the end of the 10th week (P < 0.01). However, at the end of the 6th week, there were not any differences in all the above parameters among the different groups.
CONCLUSION: Astrogaloside exerts its effects on hepatic fibrosis in ICR mice with schistosomiasis japonica by inhibiting periovular granuloma and reducing the synthesis of types Ⅰ and Ⅲ collagen.
- Citation: Ding XD, Wang HQ, Wu Q, Wang XL, Huang Y, Zhang Q, Yang F. Effect of astrogalosides on liver fibrosis in mice with schistosomiasis japonica. Shijie Huaren Xiaohua Zazhi 2008; 16(2): 125-131
- URL: https://www.wjgnet.com/1009-3079/full/v16/i2/125.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i2.125
日本血吸虫病肝纤维化是导致门静脉高压、腹水和上消化道出血的主要原因, 也是日本血吸虫病患者死亡的主要原因. 针对血吸虫病肝纤维化的发生发展过程, 抗血吸虫药物主要针对杀虫、抑制虫卵肉芽肿和延缓甚至阻止肝纤维化发展三个关键环节, 但杀虫药在有效杀虫后, 肝组织内的虫卵结节及纤维化仍能继续发展[1-2], 国内外尚无理想的抗血吸虫病肝纤维化药物. 黄芪总苷(astrogalosides, AST)是一种新的有效的抗肝纤维化药物, 研究表明AST具有显著的抗炎、抗损伤、抗肝纤维化和免疫调节作用, 而且毒副作用小[3-7]. 目前除本实验室一篇体外AST抗血吸虫病肝纤维化报道外[3], 尚未见AST抗血吸虫病肝纤维化报道. 本文采用ICR小鼠制作血吸虫病肝纤维化模型, 并给予AST ig, 观察小鼠肝组织中虫卵结节大小、纤维化程度及Ⅰ型、Ⅲ型胶原蛋白合成的变化, 研究AST对小鼠日本血吸虫病肝纤维化的影响.
清洁级ICR小鼠150只, 购自安徽省实验动物中心, 雌雄各半, 6-8周龄, 体质量31±2 g, 中国大陆株日本血吸虫阳性钉螺购自江苏省血吸虫病防治所, AST由合肥工业大学生物学院张宵翔教授提供, 吡喹酮为南京制药厂有限公司生产, 护肝片为哈尔滨葵花药业有限公司产品, 多克隆兔抗小鼠胶原Ⅰ抗体(浓缩液200 mg/L, BA0326, 武汉博士德生物构成有限公司, 工作滴度1:50), 多克隆山羊抗小鼠胶原Ⅲ抗体(浓缩液200 mg/L, Sc-25974, Santa Cruz, 工作滴度1:50), 通用型PV免疫组化试剂盒购于北京中杉生物技术有限公司.
1.2.1 小鼠肝纤维化模型的建立: 将钉螺孵育后逸出的中国大陆株日本血吸虫尾蚴, 以盖玻片法经小鼠腹部皮肤攻击感染, 总计感染120只ICR小鼠, 每只小鼠感染30±1条日本血吸虫尾蚴[8].
1.2.2 实验分组及给药: 实验小鼠造模35 d后, 随机分为4组: AST高剂量20 mg/(kg·d)组, AST低剂量10 mg/(kg·d)组, 护肝片540 mg/(kg·d)组和模型对照组, 每组30只, ig给药1次/d. 实验小鼠均于日本血吸虫尾蚴感染40 d后, 吡喹酮500 mg/(kg·d)治疗2 d. 药物均以5 g/L羧甲基纤维素钠作为溶媒, 10 mL/(kg·d) ig. 正常对照组为30只健康鼠, 模型组和正常组以等量5 g/L羧甲基纤维素钠ig. 感染后第6、10和14 wk分别取小鼠肝组织作病理学检测和免疫组织化学分析.
处死前隔夜禁食, 称体质量, 颈椎脱臼法处死, 迅速摘取肝脏并称湿质量, 观察肝脏大体标本, 取肝脏右叶组织1块, 40 g/L中性甲醛溶液固定, 用于组织学研究. 按此公式计算肝脏指数: 肝脏指数 = 肝脏湿质量/体质量×100%.
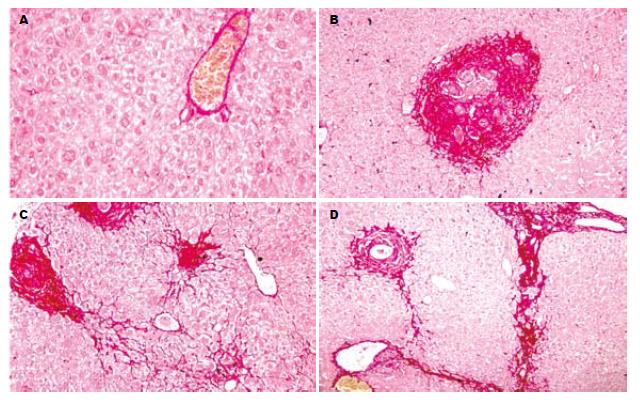
1.2.3 病理学检查: 肝组织常规石蜡包埋, 4 μm连续切片, 作HE和天狼猩红染色. HE染色切片光镜观察肝脏虫卵结节的大小, 天狼猩红染色切片观察肝纤维化程度. 肝纤维化程度判定标准[9]: 0级20 = 1, 正常; Ⅰ级21 = 2胶原纤维包绕肉芽肿周围并插入其中; Ⅱ级22 = 4汇管区有大量纤维, 小叶间仅有少量纤维; Ⅲ级23 = 8纤维组织大量延伸至小叶间.
1.2.4 组织芯片的构建: HE染色切片, 光镜下定位器定位标记病变区域, 使用内径2 mm取样针从供体蜡块取样, 每个蜡块取样3个, 并放入事先制备的7×6点阵的模型蜡块中, 经二次包埋后制成组织芯片, 4 μm厚连续切片, 分别作HE和免疫组化染色.
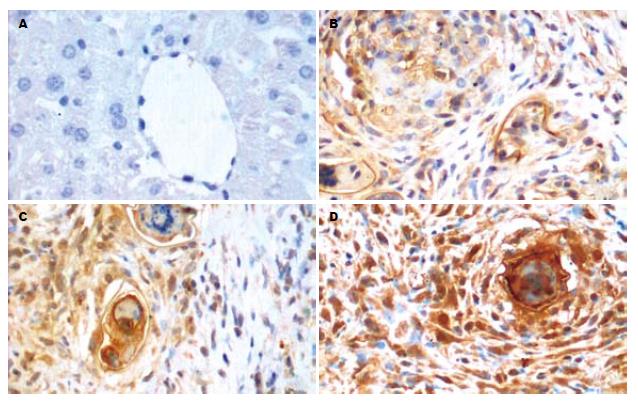
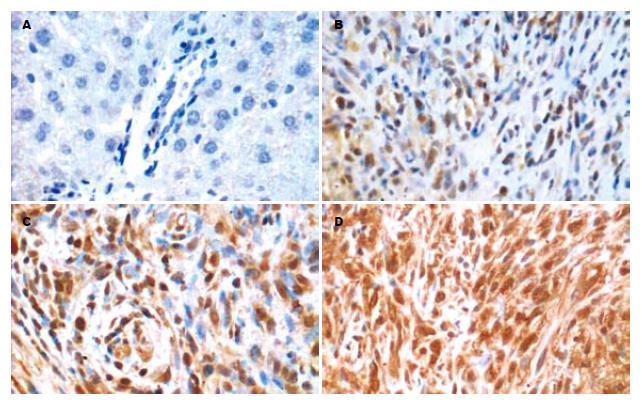
1.2.5 Ⅰ、Ⅲ型胶原的免疫组织化学检测: 免疫组化染色操作按抗体及试剂盒说明书进行. 每例均拍摄病变组织5个高倍视野照片, 采用Image-pro plus图像分析软件, 计算平均光密度(mean optical density, MOD).
统计学处理 计量资料用mean±SD表示, 采用SPSS13.0软件进行单因素方差分析.
6、10和14 wk时, AST两个剂量组及模型组的肝脏指数均高于正常组(P<0.01), AST高、低剂量组和模型组之间无明显差异(表1).
正常组小鼠肝组织的小叶结构完整, 可见中央静脉及放射状肝细胞索, 汇管区见少量胶原纤维(图1A). 6 wk时AST高、低剂量组和模型组之间的一般组织形态学无显著差异, 病变主要是散在的急性虫卵结节, 汇管区有大量淋巴细胞及嗜酸性粒细胞浸润, 可见肝组织灶性坏死, 部分汇管区见虫卵聚集成簇, 虫卵结节周围可见少量胶原纤维(图1B). 10 wk时主要表现为慢性虫卵结节, 虫卵周围可见梭形的成纤维细胞和胶原纤维包绕, 亦可见少量急性虫卵结节. AST两个剂量组的虫卵结节面积均明显低于模型组(P<0.01, P<0.05); 虫卵结节和小静脉周围的胶原纤维增生, 部分向肝小叶间延伸(图1C). 14 wk时主要为纤维化结节, 可见胶原纤维沿汇管区延伸并相互连接, 部分肝细胞间亦可见少量胶原纤维(图1D), AST高低剂量组虫卵结节面积及纤维化程度均明显低于模型组(P<0.01). 模型组虫卵结节和肝纤维化程度在10 wk时均高于6 wk和14 wk. 14 wk AST两剂量组虫卵结节和肝纤维化程度显著低于10 wk, 肝纤维化程度与6 wk时的水平相近(表2).
| 分组 | 虫卵结节大小(×104 μm2) | 肝纤维化程度 | ||||
| 6 wk | 10 wk | 14 wk | 6 wk | 10 wk | 14 wk | |
| 模型对照组 | 8.51±1.13 | 13.84±0.77 | 10.45±0.90 | 3.80±0.20 | 6.80±0.61 | 5.20±0.61 |
| AST低剂量 | 8.68±1.30 | 11.16±0.88a | 7.97±0.50a | 3.90±0.38 | 4.80±0.53a | 4.20±0.69a |
| AST高剂量 | 9.38±0.87 | 10.32±0.57b | 6.76±0.59b | 3.60±0.30 | 4.40±0.65b | 3.60±0.58b |
| 葵花护肝片 | 9.37±0.37 | 9.75±0.64 | 6.72±0.43 | 3.80±0.55 | 5.20±0.61 | 4.60±0.60 |
免疫组化染色结果显示(图2-3), 正常小鼠肝内胶原表达很弱, 主要分布在汇管区. 血吸虫感染后, 各组(AST高、低剂量组及模型组)肝组织内Ⅰ、Ⅲ型胶原含量均不同程度增加, 主要见于汇管区及虫卵结节. 模型组小鼠随着感染时间的延长, Ⅰ型胶原含量逐渐增加, 10-14 wk维持在相对较高的水平. Ⅲ型胶原在10 wk时含量最高, 14 wk时已下降至6 wk水平, 各时间点模型组与正常组相比较均有显著差异(P<0.01). 各时间点AST高、低剂量组相比较显示, 小鼠肝组织Ⅰ、Ⅲ型胶原蛋白含量随着时间的延长稳定在相对较低的水平或略有减少, 与相应时间点模型组相比较均有显著差异(P<0.01). 10 wk时AST高剂量组的Ⅲ型胶原含量明显低于AST低剂量组(P<0.01). 6 wk时各实验组之间的胶原含量差异无统计学意义(表3).
| 分组 | 胶原Ⅰ | 胶原Ⅲ | ||||
| 6 wk | 10 wk | 14 wk | 6 wk | 10 wk | 14 wk | |
| 正常组 | 0.025±0.002 | 0.028±0.003 | 0.024±0.002 | 0.030±0.003 | 0.037±0.004 | 0.032±0.003 |
| 模型组 | 0.086±0.003f | 0.134±0.004f | 0.141±0.007f | 0.102±0.006f | 0.146±0.008f | 0.101±0.004f |
| AST低剂量 | 0.081±0.003 | 0.084±0.003b | 0.095±0.004b | 0.098±0.005 | 0.104±0.005bd | 0.077±0.003b |
| AST高剂量 | 0.089±0.004 | 0.093±0.002b | 0.099±0.004b | 0.092±0.005 | 0.074±0.002b | 0.070±0.003b |
| 护肝片 | 0.086±0.004 | 0.101±0.005 | 0.102±0.007 | 0.101±0.004 | 0.120±0.002 | 0.078±0.003 |
血吸虫病肝纤维化是在虫卵肉芽肿基础上产生的, 其核心机制是在可溶性虫卵抗原刺激下, 巨噬细胞与淋巴细胞产生PDGF和TGFβ1等各种细胞因子刺激肝星状细胞(hepatic stellate cell, HSC)活化、增殖、转化为肌纤维母细胞, 并与其他来源的成纤维细胞一起合成以Ⅰ和Ⅲ型胶原为主的细胞外基质(extracellular matrix, ECM). 目前国内外肝病学者普遍认为, 肝纤维化是可逆转的[10-16], 抑制HSC活化、增殖和合成胶原已成为抗肝纤维化治疗的重要对策[17-26].
针对肝纤维化发展的机制, 近年来抗肝纤维化药物的研究取得了很大发展, 大量研究资料表明, 中医中药在抗肝纤维化方面独树一帜[27-32]. 在众多抗肝纤维化中药复方中, 黄芪频频出现[33-34], 但除本实验室一篇AST体外抗血吸虫病肝纤维化的报道外[3], 未见其他报道. 本研究动态观察黄芪总苷干预小鼠血吸虫病肝纤维化的过程, 结果显示, 6 wk时各组虫卵周围均有大量嗜酸性粒细胞为主的炎细胞浸润, 构成以虫卵为中心的、嗜酸性脓肿为主要表现的急性虫卵结节, 此时血吸虫肝病组织中已有胶原纤维的增多, 但各组结节的大小、Ⅰ型、Ⅲ型胶原蛋白表达均无统计学差异. 10 wk时主要为慢性虫卵肉芽肿, 其虫卵周围包绕较多的成纤维细胞和胶原纤维. AST高、低剂量组与模型组之间的Ⅰ、Ⅲ型胶原含量、虫卵结节大小及肝纤维化程度均显著差异, 且AST两剂量组之间, Ⅲ型胶原的表达亦有明显差异. 14 wk时虫卵肉芽肿纤维化形成纤维性虫卵结节, 各组结节均变小, 结节中细胞数也明显减少. 其中AST高、低剂量组与模型组之间, Ⅰ、Ⅲ型胶原含量和虫卵结节大小均明显降低, 肝脏纤维化程度显著减轻, 但AST两剂量组无统计学差异. 提示AST对血吸虫病肝纤维化有明显的抑制作用, 但AST的剂量在持续性干预中的效果可能没有剂量依赖性. 各组不同时间点虫卵结节大小、肝纤维化程度和Ⅰ、Ⅲ型胶原表达结果提示AST抑制了Ⅰ、Ⅲ型胶原蛋白的合成, 使胶原蛋白处于相对稳定的低水平表达, 从而抑制了血吸虫病肝纤维化的进程, 表现为虫卵结节缩小, 肝纤维化减轻. 同时积极的进行大剂量AST的干预可能使胶原蛋白的合成较早稳定在较低的表达水平. AST抗血吸虫病肝纤维化的机制是否与AST减少虫卵结节中成纤维细胞的数量和合成胶原纤维活性有关, 我们将做进一步研究.
日本血吸虫病肝纤维化是日本血吸虫病患者死亡的主要原因. 抗血吸虫药物有效杀虫后, 肝组织内的虫卵结节及纤维化仍能继续发展. 而黄芪总苷是一种新的有效的抗肝纤维化药物, 研究表明其具有显著的抗炎, 抗损伤, 抗肝纤维化和免疫调节作用, 本文研究了其对日本血吸虫病肝纤维化和虫卵肉芽肿的影响.
陈治水, 主任医师, 中国人民解放军第211医院
目前的研究主要集中于阻滞肝星状细胞活化途径的相关细胞因子, 从而逆转或延缓肝纤维化的进程, 但国内外至今无理想的抗肝纤维化药物.
本文研究黄芪总苷可通过缩小虫卵结节、减少胶原合成发挥抗血吸虫肝纤维化作用.
血吸虫病肝纤维化: 血吸虫虫卵沉积于肝脏汇管区后, 在虫卵抗原的刺激下形成虫卵结节, 结节周围纤维组织增生, 沿着汇管区延伸, 形成干线型肝纤维化.
本文研究内容新颖, 设计合理, 数据可信, 但在阳性对照组选择上欠妥.
编辑: 李军亮 电编:何基才
| 1. | Singh KP, Gerard HC, Hudson AP, Boros DL. Expression of matrix metalloproteinases and their inhibitors during the resorption of schistosome egg-induced fibrosis in praziquantel-treated mice. Immunology. 2004;111:343-352. [PubMed] |
| 2. | Gryseels B, Polman K, Clerinx J, Kestens L. Human schistosomiasis. Lancet. 2006;368:1106-1118. [PubMed] |
| 3. | Wu Q, Zhu H, Yuan XS, Wang XL, Shen JL. Effect of astragalosides on schistosomal hepatic fibrosis in vitro. Shock. 2006;26 suppl 1:26-27. |
| 4. | Zhang ZC, Li SJ, Yang YZ. Effect of astragaloside on myocardial fibrosis in chronic myocarditis. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2007;27:728-731. [PubMed] |
| 5. | Hu JY, Huang YS, Song HP, Zhang DX, Xiang F, Zhu ZG, Teng M, Zhang Q. Protective effects of Astragaloside and Quercetin on rat myocardial cells after hypoxia. Zhonghua Shao Shang Za Zhi. 2007;23:175-178. [PubMed] |
| 6. | Xu XL, Ji H, Gu SY, Shao Q, Huang QJ, Cheng YP. Modification of alterations in cardiac function and sarcoplasmic reticulum by astragaloside IV in myocardial injury in vivo. Eur J Pharmacol. 2007;568:203-212. [PubMed] |
| 8. | Coutinho EM. Malnutrition and hepatic fibrosis in murine schistosomiasis. Mem Inst Oswaldo Cruz. 2004;99:85-92. [PubMed] |
| 10. | Jin B, Alter HJ, Zhang ZC, Shih JW, Esteban JM, Sun T, Yang YS, Qiu Q, Liu XL, Yao L. Reversibility of experimental rabbit liver cirrhosis by portal collagenase administration. Lab Invest. 2005;85:992-1002. [PubMed] |
| 11. | Moreira RK. Hepatic stellate cells and liver fibrosis. Arch Pathol Lab Med. 2007;131:1728-1734. [PubMed] |
| 12. | Kumar M, Sarin SK. Is cirrhosis of the liver reversible? Indian J Pediatr. 2007;74:393-399. [PubMed] |
| 13. | Helmy AH, Abdel-Hady AA, el-Shanawany F, Hammam O, Abdel-Hady A. The pharmacological approach to reverse portal hypertention and hepatic schistosomal fibrosis in Egypt, control experimental study. J Egypt Soc Parasitol. 2005;35:731-750. [PubMed] |
| 14. | O'Connell MA, Rushworth SA. Curcumin: potential for hepatic fibrosis therapy? Br J Pharmacol. 2007;. [PubMed] |
| 15. | Zhang WC, Mao YF. Re-understanding of liver cirrhosis induced by Schistosomiasis japonica. Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. 2006;24:382-384. [PubMed] |
| 16. | Zou WL, Yang Z, Zang YJ, Li DJ, Liang ZP, Shen ZY. Inhibitory effects of prostaglandin E1 on activation of hepatic stellate cells in rabbits with schistosomiasis. Hepatobiliary Pancreat Dis Int. 2007;6:176-181. [PubMed] |
| 17. | Nara T, Iizumi K, Ohmae H, Sy OS, Tsubota S, Inaba Y, Tsubouchi A, Tanabe M, Kojima S, Aoki T. Antibody isotype responses to paramyosin, a vaccine candidate for schistosomiasis, and their correlations with resistance and fibrosis in patients infected with Schistosoma japonicum in Leyte, The Philippines. Am J Trop Med Hyg. 2007;76:384-391. [PubMed] |
| 18. | Bartley PB, Ramm GA, Jones MK, Ruddell RG, Li Y, McManus DP. A contributory role for activated hepatic stellate cells in the dynamics of Schistosoma japonicum egg-induced fibrosis. Int J Parasitol. 2006;36:993-1001. [PubMed] |
| 19. | Reiman RM, Thompson RW, Feng CG, Hari D, Knight R, Cheever AW, Rosenberg HF, Wynn TA. Interleukin-5 (IL-5) augments the progression of liver fibrosis by regulating IL-13 activity. Infect Immun. 2006;74:1471-1479. [PubMed] |
| 20. | Wilson MS, Mentink-Kane MM, Pesce JT, Ramalingam TR, Thompson R, Wynn TA. Immunopathology of schistosomiasis. Immunol Cell Biol. 2007;85:148-154. [PubMed] |
| 21. | Pesce J, Kaviratne M, Ramalingam TR, Thompson RW, Urban JF Jr, Cheever AW, Young DA, Collins M, Grusby MJ, Wynn TA. The IL-21 receptor augments Th2 effector function and alternative macrophage activation. J Clin Invest. 2006;116:2044-2055. [PubMed] |
| 22. | Abath FG, Morais CN, Montenegro CE, Wynn TA, Montenegro SM. Immunopathogenic mechanisms in schistosomiasis: what can be learnt from human studies? Trends Parasitol. 2006;22:85-91. [PubMed] |
| 24. | 徐 进梅, 吴 海玮, 吴 观陵. 血吸虫病肝纤维化中细胞因子的网络作用. 国外医学寄生虫病分册. 2004;31:150-153. |
| 25. | Chatterjee S, Vrolix G, Depoortere I, Peeters T, Van Marck E. The therapeutic effect of the neuropeptide hormone somatostatin on Schistosoma mansoni caused liver fibrosis. BMC Infect Dis. 2005;5:45. [PubMed] |
| 26. | Zhang BB, Jiao YW, Cai WM, Tao J, Liu RH. Influence of interferon gamma treatment on expression of TGF-beta1 and its receptors in liver fibrosis of mice with schistosomiasis japonica. Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. 2004;22:340-343. [PubMed] |
| 27. | Ji G, Wang L, Zhang SH, Liu JW, Zheng PY, Liu T. Effect of Chinese medicine Qinggan Huoxuefang on inducing HSC apoptosis in alcoholic liver fibrosis rats. World J Gastroenterol. 2006;12:2047-2052. [PubMed] |
| 28. | Song SL, Gong ZJ, Zhang QR, Huang TX. Effects of Chinese traditional compound, JinSanE, on expression of TGF-beta1 and TGF-beta1 type II receptor mRNA, Smad3 and Smad7 on experimental hepatic fibrosis in vivo. World J Gastroenterol. 2005;11:2269-2276. [PubMed] |
| 29. | He SX, Luo JY, Wang YP, Wang YL, Fu H, Xu JL, Zhao G, Liu EQ. Effects of extract from Ginkgo biloba on carbon tetrachloride-induced liver injury in rats. World J Gastroenterol. 2006;12:3924-3928. [PubMed] |
| 33. | 易 文龙, 陈 建明. 水蛭、桃仁、黄芪及当归合剂对小鼠血吸虫性肝纤维化的影响. 中国寄生虫学与寄生虫病杂志. 2004;22:62. |