修回日期: 2008-05-31
接受日期: 2008-06-02
在线出版日期: 2008-07-08
目的: 探讨血红素氧化酶-1 mRNA(HO-1 mRNA)在砷暴露肝损伤小鼠肝组织中表达的意义.
方法: 40只♂小鼠被随机分成对照组和亚砷酸钠组(iAs3+组). 10 mo后处死小鼠, 肝功能检查血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、球蛋白(GLB); 部分肝组织作HE染色观察病理变化; TRIzol-酚-氯仿一步法提取肝组织总RNA, 紫外分光光度法测定总RNA及纯度, 实时荧光定量PCR法测定肝组织中HO-1 mRNA的表达, 以18S基因作为质控.
结果: iAs3+组小鼠血清ALT、AST、GLB值高于对照组(61.5±5.5 U/L vs 38.0±5.6 U/L, 530.9±39.0 U/L vs 118.3±9.1 U/L, 27.15±4.1 g/L vs 20.9±0.6 g/L, 均P<0.05); 肝组织病理检查有明显的炎症细胞浸润和肝细胞坏死, 纤维组织增生; 小鼠肝组织HO-1 mRNA基因表达在iAs3+组增高, 与对照组比较有统计学意义(t = 5.393, P<0.05).
结论: 小鼠亚砷酸钠长期暴露诱导的HO-1高表达, 可能参与了肝损伤肝纤维化发生机制.
引文著录: 罗天永, 吴君, 张韵, 欧兵, 程明亮, 杨勤. HO-1 mRNA在砷暴露肝损伤小鼠肝组织中的表达. 世界华人消化杂志 2008; 16(19): 2161-2165
Revised: May 31, 2008
Accepted: June 2, 2008
Published online: July 8, 2008
AIM: To study the expression of Heme oxidase-1 (HO-1) mRNA and its significance in hepatic tissues in arsenic exposed mice.
METHODS: Forty male mice were randomly assigned to control group and sodium arsenite group (iAs3+ group). The iAs3+ group was given sodium arsenite per day. The mice were sacrificed after 10 mo for liver function and pathologic examination. The RNA was extracted by the TRIzol-Phenol-Chlorofor method from the other part of the liver tissues. Then, its density and purity was determined using ultraviolet spectrophtonetric method. The expression of HO-1 mRNA was detected using real time fluorescence quantitative PCR, and the result was controlled with 18S gene.
RESULTS: The serum levels of ALT, AST and GLB in the iAs3+ group were higher than those of the control group (61.5 ± 5.5 U/L vs 38.0 ± 5.6 U/L, 530.9 ± 39.0 U/L vs 118.3 ± 9.1 U/L, 27.15 ± 4.1 g/L vs 20.9 ± 0.6 g/L, all P < 0.05). Pathologic examination indicated notable inflammatory cell invasion and liver cell necrosis involved in arsenic group. The mRNA expression of HO-1 increased in the iAs3+group compared with the control group and a statistically significant difference was detected (t = 5.393, P < 0.05).
CONCLUSION: High expression of HO-1 induced by long-term exposure to sodium arsenite may lead to excessive stress response, thereby participate in liver injury and liver fibrosis.
- Citation: Luo TY, Wu J, Zhang Y, Ou B, Cheng ML, Yang Q. Expression of HO-1 mRNA in hepatic tissues in arsenic exposed mice. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2161-2165
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2161.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2161
砷是一种严重危害人类健康的环境毒物和已知的人类致癌物[1-2]. 砷中毒是一种地球化学性疾病[3], 慢性砷中毒以皮肤病变为主并累及机体诸多器官和组织, 近年来动物实验和人群流行病学调查均表明砷进入机体后, 主要蓄积于肝脏, 他可引起不同程度的肝损伤、肝纤维化、肝硬化及肝癌[4-9], 严重危害人体健康. 尽管砷中毒导致的肝损伤、肝纤维化、肝硬化及肝癌的防治研究已逐渐成为目前国内外研究的热点, 但仍缺乏长期、系统、多中心、大规模的人群流行病学的研究及成熟的砷中毒肝损伤、尤其是慢性肝损伤肝纤维化动物模型, 对其肝脏损伤机制亦尚无成熟完善的理论解释[10]. 血红素氧化酶(HO)是血红素降解的限速酶, 其同工酶HO-1是诱导型血红素氧化酶, 是一种应激反应蛋白, 对于氧化应激十分敏感, 能够被多种刺激或应激因素所诱导, 如重金属、内毒素、细胞因子等, 该诱导作用被认为是机体对各种氧化应激刺激的一种适应性保护反应[11-12], 目前对长期水砷暴露肝损伤与HO-1的关系研究甚少.本实验拟建立慢性水砷暴露小鼠肝脏损伤的动物模型, 并探讨HO-1在慢性水砷暴露所导致肝损伤中表达的意义.
iAs3+(亚砷酸钠, NaAsO2, iAs3+)(购自美国Sigma公司; HO-1及18S引物、SYBR Green I 荧光染料、TRIzol试剂、随机引物(Oligo dT)、 4种脱氧核苷(dNTPs)、RNA酶抑制剂(RNase Inhibitor)、MMLV逆转录酶、PCR引物(根据美国国立生物技术信息中心基因银行中鼠的HO-1、PCNA、18S cDNA序列进行设计)均由美国国立卫生研究院癌症/环境卫生研究所刘杰博士惠赠. 紫外分光光度仪(Mastercycler gradient、德国Eppendorf公司), 5700荧光定量PCR仪(Applied Biosystems美国ABI公司), 核酸蛋白分析仪(Ultrospec 2100 pro、美国Amersham Biosciences公司), 台式冷冻离心机(5810R、德国Eppndorf公司), 全自动生化分析仪(AEROSET2000、美国Abbott公司).
1.2.1 分组及造模: ♂昆明种小白鼠40只, 体质量20±3 g, 由贵阳医学院实验动物中心提供. 将小鼠随机分成对照组和iAs3+组, n = 20. 对照组饮用自来水, iAs3+组饮用NaAsO2水(300 mg/L). 两组小鼠自由饮用, 食用普通饲料. 在本次实验前, 我们采用iAs3+砷溶液150 mg/L以自由饮用的方式喂养小鼠, 17 wk后小鼠未出现死亡.根据该实验结果, 本研究砷溶液浓度调整为300 mg/L. 造模10 mo后, 两组小鼠因自然因素和/或不能耐受实验而死亡, 但死亡只数不等. 两组小鼠随机选用各10只, 采用眼球取血方式处死. 取血清送生化科查肝功能; 肝组织100 mg, 迅速放入1 mL TRIzol试剂中, 立即提取肝组织总RNA; 余肝组织放100 g/L中性甲醛溶液中固定, 石蜡包埋、切片、HE染色.
1.2.2 血清肝功能生化指标检测: 血清丙氨酸转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、球蛋白(GLB)测定采用全自动生化分析仪.
1.2.3 实时荧光定量PCR检测: (1)引物: HO-1 GenBank Accession Number: M33203; 上游引物5'-CCTCACTGGCAGGAAATCATC-3', 下游引物5'-CCTCGTGGAGACGCTTTACATA-3'; 内参18S GenBank Accession Number: X56974; 上游引物5'-CGAACGTCTGCCCTATCAACTT-3', 下游引物5'-CCGGAATCGAACCCTGATT-3'. (2)总RNA的提取: 取小鼠肝组织100 mg, 加入TRIzol试剂1 mL中, 用小玻璃研磨器捣匀肝组织, 用标准TPIzol-酚-氯仿一步法提起小鼠肝组织总RNA, 紫外分光光度法测定总RNA浓度及纯度. (3)逆转录酶合成cDNA: 经MMLV逆转录酶催化合成cDNA, 以此为模板在PCR扩增仪上完成PCR扩增. 逆转录反应体系100 μL: 包括总RNA 1000 ng, 25 mmol/L MgCl2 22 μL, 10×PCR BufferⅡ 10 μL, 10 mmol/L dNTPs 20 μL, 10 μmol/L OligodT 5 μL, 20×1012 U/L RNase Inhibitor 2 μL, 50 ×1012 U/L MMLV逆转录酶2.5 μL, RNase-free-H2O补充体积(18.5 μL). 循环参数设置; 25℃ 10 min, 48℃ 60 min, 95℃ 5 min, 4℃保存, 置-20℃备用. (4)实时荧光定量PCR(RT-PCR)扩增检测HO-1 mRNA的表达: PCR反应体系20 μL, 包括逆转录产物4 μL, 100 μmol/L上、下游引物各0.5 μL, 2×Buffer SYBR Green 10 μL, RNase-free-H2O 5 μL. PCR扩增条件: 预变性94℃ 5 min, 然后执行如下反应条件: 94℃变性45 s, 退火55℃ 60 s, 72℃延伸60 s, 共30个循环, 最后72℃延伸10 min.
统计学处理 计量资料用mean±SD表示, 各组间比较采用t, 应用SPSS11.5统计学软件处理数据.
iAs3+组血清ALT、AST、GLB均高于对照组, 差异有统计学意义(P<0.05, 表1).
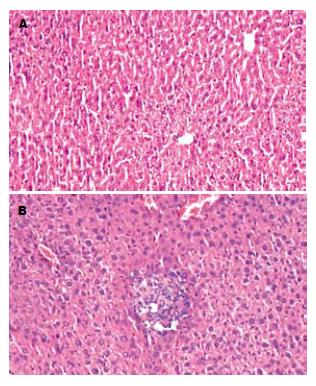
对照组小鼠肝脏病理见肝小叶结构完整,无变性、坏死、炎性细胞浸润及纤维组织增生(图1A). iAs3+组见肝细胞水样变性, 脂肪样变性, 气球样变性, 肝细胞液化坏死, 炎性细胞浸润, 肝细胞再生, 汇管区纤维增生, 纤维条索形成(图1B).
HO-1 mRNA的测定: 对照组为29.80±10.54, iAs3+组为236.19±84.55, 两组比较, iAs3+组HO-1 mRNA表达增高(t = 5.393, P<0.05).
有资料显示, 人群长期水砷暴露造成的砷中毒发病率、严重程度, 与砷暴露时间及水砷含量等多种因素呈正相关[13-14]. 砷的慢性肝损伤模型报道较少.曾有报道自由饮砷水的肝损伤动物模型, 给予的水砷浓度较低, 造模周期较长, 大多在造模6 mo才出现轻度肝细胞损伤, 15 mo才可见少许肝纤维化[15]. 本研究前预实验选用iAs3+溶液150 mg/L自由饮用的方式喂养小鼠, 17 wk小鼠未死亡. 因此, 结合给药方式、实验目的和小鼠耐受情况, 我们选定300 mg/L亚砷酸钠溶液作为本次实验的染毒溶液, 结果显示水砷暴露小鼠血清学检测: ALT、AST、GLB: iAs3+组较对照组均升高; 肝组织病理: iAs3+组肝细胞有变性, 坏死, 再生, 汇管区纤维增生, 纤维条索形成. 说明成功建立了亚砷酸钠慢性水砷暴露小鼠肝损伤动物模型.
国内外动物实验和人群流行病学调查均表明砷进入人体后, 主要在肝组织中蓄积, 通过甲基化过程、脂质过氧化、基因损伤、直接损伤肝细胞等多种途径引起不同程度的肝损伤、肝纤维化、肝硬化甚至肝癌. 砷的毒理作用机制与其诱发活性氧自由基(ROS)的产生以及抑制抗氧化物的活力从而导致氧化损伤关系密切[16-17].
HO-1是一种急性应激反应蛋白, 对机体有保护作用[18-19]. 在肝缺血再灌注, 酒精性非酒精性脂肪性肝炎, 梗阻性黄疸等多种损伤因素所致的急性、亚急性肝损伤文献中, HO-1能通过以急性应激反应为主的多环节发挥肝脏保护作用[20-26]. HO-1在砷对肝损伤方面的研究少有报道, 有动物实验研究显示, NaAsO2是HO-1蛋白的强烈和特异性诱导剂, 能够诱导大鼠和小鼠肝脏、肾脏HO-1高表达,与组织中的无机砷含量具有高度相关性[27]. 本实验显示, HO-1 mRNA在iAs3+组肝组织中表达明显升高, iAs3+暴露对肝细胞HO-1 mRNA的诱导很可能也表现为砷介导的一种特异性细胞应激反应. 该应激反应在慢性砷暴露中的是否也是应激保护作用, 有待进一步探索. 在我们系列研究中发现, 砷暴露肝损伤纤维化过程中促炎症因子TNF-α、IL-6、COX-2和促肝纤维化因子Col-Ⅰ、Col-Ⅲ均有高表达, 缺乏MT保护作用, GSH-Pi表达低下、GSH-Px无明显变化导致抗氧化系统失衡等[28-31], 与本实验中iAs3+组肝组织明显损伤, 同时HO-1 mRNA也高表达的结果, 用应激保护作用不好完美解释. 该实验模型为长期暴露亚砷酸钠水所致慢性肝损伤动物模型, HO-1 mRNA呈持续高表达, 在肝组织应激反应中可能发挥了损伤作用而非保护作用, 有可能参与了砷致肝损伤、肝纤维化的发生机制. 曾有文献报道, 组织细胞HIF-1与Bach-1的特异性可决定HO-1的表达, 并认为增高表达的HO-1可催化血红素分解出高浓度胆红素、CO和铁具有细胞毒性作用[32-33]; 另有文献报道, 慢性阻塞性肺病患者肺泡巨噬细胞中HO-1表达下降[34]. 抑制小鼠HO-1的高表达, 可减少肺部反应铁和铁相关蛋白的生成, 降低NAD-PH细胞色素P450还原酶的活性, 使肺过氧化物酶的活性也有所下降, 从而减轻氧化应激造成的肺损伤[35].
总之, 砷暴露肝损伤纤维化过程中, 早期HO-1的表达, 作为急性应激反应可能发挥保护反应; 慢性砷暴露后, 砷介导特异性诱导的HO-1持续高表达, 可能参与了肝损伤、肝纤维化的过程, 成为其可能的机制之一, 有待进一步研究.
砷可引起不同程度的肝损伤、肝纤维化、肝硬化及肝癌, 未完全阐明的发病机制已成为关注的热点. 慢性砷暴露肝损伤肝纤维化动物模型的建立, 对肝损伤机制的理论解释极为重要. HO-1的研究在多病因肝损伤中具有保护作用, 慢性砷暴露所导致肝损伤时HO-1的表达研究甚少.
秦成勇, 教授, 山东省立医院消化内科
尚未完全阐明的慢性砷中毒肝损伤发病机制的研究已成为重点, HO-1在慢性砷暴露肝损伤氧化应激过程中所发挥作用正在被认识中.
苏丽琴 et al报道砷中毒发病率、严重程度与砷暴露时间及水砷含量等多种因素呈正相关; Santra et al给低浓度砷水造模15 mo见少许肝纤维化; 吴刚等报道HO-1能通过以急性应激反应为主的多环节发挥肝脏保护作用; Kitamuro et al报道, 组织细胞HIF-1与Bach-1的特异性可决定HO-1的表达, 并认为增高表达的HO-1可催化血红素分解出高浓度胆红素、CO和铁具有细胞毒性作用.在慢性砷暴露肝损伤中, HO-1对肝脏保护作用还是损伤作用有待进一步研究.
本研究成功建立慢性砷暴露肝损伤肝纤维化模型, 并进一步探讨了HO-1在慢性砷中毒肝损伤氧化应激反应中可能的损伤机制.
HO-1在慢性砷暴露肝损伤肝纤维化发生机制的进一步阐明必将为防治提供重要的科学依据.
本研究设计合理, 得出了有参考价值的结论, 可读性能反映我国胃肠病学基础研究的先进水平.
编辑: 李军亮 电编:吴鹏朕
| 1. | Brown KG, Ross GL. Arsenic, drinking water, and health: a position paper of the American Council on Science and Health. Regul Toxicol Pharmacol. 2002;36:162-174. [PubMed] [DOI] |
| 6. | Liu J, Liu Y, Goyer RA, Achanzar W, Waalkes MP. Metallothionein-I/II null mice are more sensitive than wild-type mice to the hepatotoxic and nephrotoxic effects of chronic oral or injected inorganic arsenicals. Toxicol Sci. 2000;55:460-467. [PubMed] [DOI] |
| 11. | 李 瑶, 王 小明, 吴 其夏. 缺氧与血红素氧化酶-1的表达. 国外医学·生理、病理科学与临产分册. 2005;25:238-241. |
| 15. | Santra A, Maiti A, Das S, Lahiri S, Charkaborty SK, Mazumder DN. Hepatic damage caused by chronic arsenic toxicity in experimental animals. J Toxicol Clin Toxicol. 2000;38:395-405. [PubMed] [DOI] |
| 18. | 刘 烈刚, 严 红, 邹 立君, 姚 平, 章 锡平, 宋 方方, 郝 丽萍, 杨 雪锋. 诱导血红素氧化酶表达对乙醇所致人原代肝细胞氧化损伤的保护作用. 中国药理学与毒理学杂志. 2004;18:203-207. |
| 22. | 冯 志杰, 陈 湘萍. 血红素氧合酶对大鼠肝脏缺血再灌注损伤的保护作用. 中华医学会第七次全国消化病学术会议论文汇编(下册). 2007;844. |
| 27. | Hirano S, Cui X, Li S, Kanno S, Kobayashi Y, Hayakawa T, Shraim A. Difference in uptake and toxicity of trivalent and pentavalent inorganic arsenic in rat heart microvessel endothelial cells. Arch Toxicol. 2003;77:305-312. [PubMed] |
| 32. | Kitamuro T, Takahashi K, Ogawa K, Udono-Fujimori R, Takeda K, Furuyama K, Nakayama M, Sun JY, Fujita H, Hida W. Bach1 functions as a hy-poxia-inducible repressor for the heme oxygenase-1 gene in human cells. J Biol Chem. 2003;278:9125-9133. [DOI] |
| 33. | Udono-Fujimori R, Takahashi K, Takeda K, Furuyama K, Kaneko K, Takahashi S, Tamai M, Shibahara S. Expression of heme oxygenase-1 is repressed by interferon-gamma and induced by hypoxia in human retinal pigment epithelial cells. Eur J Biochem. 2004;271:3076-3084. [PubMed] [DOI] |
| 34. | Maestrelli P, Paska C, Saetta M, Turato G, Nowicki Y, Monti S, Formichi B, Miniati M, Fabbri LM. Decreased haem oxygenase-1 and increased inducible nitric oxide synthase in the lung of severe COPD patients. Eur Respir J. 2003;21:971-976. |
| 35. | Dennery PA, Visner G, Weng YH, Nguyen X, Lu F, Zander D, Yang G. Resistance to hyperoxia with heme oxygenase-1 disruption: role of iron. Free Radic Biol Med. 2003;34:124-133. [PubMed] [DOI] |