修回日期: 2008-04-17
接受日期: 2008-04-21
在线出版日期: 2008-07-08
目的: 探讨IL-10对大鼠肝星状细胞(hepatic stellate cells, HSC)表达CTGF的影响及其抗纤维化的可能机制.
方法: 体外培养大鼠肝星状细胞系rHSC-99, 分别用不同浓度的IL-10、TGF-β1干预和两者共同干预48 h后, 采用半定量 RT-PCR法检测各组肝星状细胞中CTGF mRNA表达水平.
结果: TGF-β1单独干预HSC, CTGF mRNA表达水平与对照组比较均明显增强(P<0.05); 不同浓度的IL-10单独干预HSC, 各目的基因表达与对照组比较无明显统计学意义; 不同浓度的IL-10与TGFβ1共同干预HSC, CTGF mRNA表达水平与TGF-β1组比较均明显降低(P<0.05).
结论: IL-10可显著抑制由TGF-β1诱导的CTGF mRNA的表达, 这可能是其抗纤维化的机制之一.
引文著录: 杨悦杰, 黄芬, 胡静, 马力, 李智伟. IL-10对TGF-β1诱导的大鼠肝星状细胞CTGF表达的影响. 世界华人消化杂志 2008; 16(19): 2154-2157
Revised: April 17, 2008
Accepted: April 21, 2008
Published online: July 8, 2008
AIM: To investigate the effect of interleukin-10 (IL-10) on the expression of connective tissue growth factor (CTGF) in hepatic stellate cells (HSC) and its possible antifibrogenic mechanism.
METHODS: Hepatic stellate cells (rHSC-99) cultured in vitro was exposed to various concentrations of IL-10 and/or TGF-β1 for 48 h and then expression level of CTGF mRNA was measured by semi-quantitative reverse-transcription polymerase chain reaction (RT-PCR).
RESULTS: The expression level of CTGF mRNA, compared with control group, markedly increased when HSC was only exposed to TGF-β1 (P < 0.05); when HSC was only exposed to various concentrations of IL-10, target gene expression showed no significance; the expression level of CTGF mRNA markedly decreased when HSC was exposed to TGF-β1 in combination with different concentrations of IL-10 (P < 0.05).
CONCLUSION: IL-10 remarkably inhibits TGF-β1-induced CTGF mRNA expression, which is thought to be one possible antifibrogenic mechanism.
- Citation: Yang YJ, Huang F, Hu J, Ma L, Li ZW. Effect of interleukin-10 on TGF-β1-induced CTGF expression in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2154-2157
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2154.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2154
肝星状细胞(hepatic stellate cells, HSC)是肝纤维化时细胞外基质(extracellular matrix, ECM)过多产生和沉积的主要细胞来源, HSC的激活、增殖在肝纤维化过程中起核心作用. 转化生长因子β1(transforming growth factor β1, TGF-β1)是强有力的致纤维化的细胞因子, 在肝纤维化时表达明显增多, 促进HSC增殖活化, 合成大量ECM, 在纤维化进程中起重要作用[1]. 结缔组织生长因子(connective tissue growth factor, CTGF)是近年来新发现的一种细胞因子, 肝纤维化时肝组织内与血清中CTGF明显增高, 其程度与肝纤维化的病理进展水平呈平行相关关系, CTGF可能是TGFβ的下游效应介质, 可以介导TGFβ的促细胞外基质效应, 而不影响TGFβ免疫抑制和抗细胞增殖效应,是具有多种生理功能的细胞因子, 近年来成为研究热点之一[2]. 白介素-10(interleukin-10, IL-10)是一种炎症抑制因子, 临床和动物实验表明, IL-10可减轻肝脏炎症, 抑制肝纤维化的发展, 可望发展为抗肝纤维化药物, 但其作用机制尚未明确. 我们用IL-10及TGFβ1干预和共干预体外培养的大鼠肝星状细胞系γ-HSC99, 采用半定量RT-PCR法检测各组CTGF mRNA表达, 进一步探讨IL-10抗肝纤维化的作用机制.
γ-HSC99细胞系[3], 为活化的大鼠肝脏星状细胞, 由北京大学附属医院人民医院肝胆外科实验室冷希圣教授惠赠; TGFβ1及重组大鼠IL-10购自Peprotech公司; 逆转录试剂盒和Taq酶购自大连宝生物公司; 引物由Invitrogen公司合成; 总RNA提取试剂(TRIzol)购自Invitrogin公司; DEPC和琼脂糖购自Sigma公司; DNA marker购自MBI公司; DMEM培养基购自Gibco公司.
1.2.1 细胞培养: 将γ-HSC99细胞复苏后接种于25 cm2培养瓶中, 每瓶加入5 mL含100 mL/L胎牛血清的DMEM培养液, 置37℃、50 mL/L恒温CO2培养箱中, 细胞为贴壁生长, 每1-2 d以2.5 g/L胰蛋白酶消化传代.
1.2.2 实验分组: A: 对照组加磷酸盐缓冲液; B: TGFβ1 8 mg/L组; C: IL-10 10 mg/L组; D: IL-10 20 mg/L组; E: IL-10 40 mg/L组; F: TGFβ1 8 mg/L+IL-10 10 mg/L组; G: TGFβ1 8 mg/L+IL-10 20 mg/L组; H: TGFβ1 8 mg/L+IL-10 40 mg/L组.
1.2.3 RT-PCR法检测CTGF mRNA的表达: 用 TRIzol试剂提取细胞总RNA; 用分光光度法测定RNA含量及纯度, A260:A280比值均在在1.8-2.0之间. 采用两步法RT-PCR技术, 设置GAPDH为内参照. 引物序列: CTGF 5'-CTAAGACCTGTGGAATGGGC-3'(上游), 5'-CTCAAAGATGTCATTGTCCCC-3'(下游); GAPDH 5'-TGGGACGATATGGAGAAGAT-3'(上游), 5'-ATTGCCGATAGTGATGACCT-3'(下游). 用RNA PCR Kit(AMV)Ver. 310试剂盒进行逆转录聚合酶链式反应, cDNA合成和预变性: 30℃ 10 min, 42℃ 30 min, 99℃ 5 min, 5℃ 5 min进行1次循环, CTGF PCR扩增条件: 94℃ 2 min进行1次循环, 94℃ 30 s、55℃ 30 s、72℃ 50 s进行32次循环. 取RT-PCR产物在12 g/L琼脂糖凝胶上电泳(100 V, 30 min), 用GDS凝胶成像系统拍摄电泳结果, 各带用计算机图像分析系统扫描定量.
统计学处理 数据以mean±SD表示, 各组之间是否存在显著性差异分析采用One-way ANOVA分析. 进一步各实验组与对照组的比较采用最小显著差值法LSD-t检验. P<0.05确定差异有无显著意义.
以细胞总RNA为模板, 进行RT-PCR反应, 扩增产物经凝胶电泳可见分别于383 bp(CTGF)及452 bp(GAPDH)处的清晰扩增条带(图1).
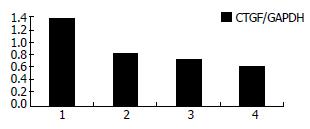
A-H组CTGF/GAPDH分别为1.02±0.12, 1.38±0.07, 1.05±0.09, 1.01±0.10, 1.01±0.11, 0.82±0.03, 0.72±0.04, 0.62±0.06. TGFβ1组HSC细胞CTGF mRNA表达明显升高, 与空白对照组(A组)比较, 差别有统计学意义(P<0.05); IL-10各浓度组(C-E组)与空白对照组比较, 基因表达差别无明显统计学意义; 同时加入TGFβ1及不同浓度的IL-10(F-H组)与TGFβ1组(B组)比较, CTGF mRNA表达均明显降低, 差别有统计学意义(P<0.05), 并呈剂量依赖效应, 说明IL-10对TGFβ1诱导的CTGF表达有明显的抑制作用(图2).
肝纤维化是肝组织内ECM过度增生和沉积, 降解相对不足的病理过程, HSC的激活和增殖在肝纤维化过程中起核心作用, 以HSC为靶向的研究是近年来抗纤维化机制方面的研究热点. 多项研究表明, TGFβ1是强有力的致纤维化细胞因子, 在肝纤维化是表达明显增多, 可促进HSC的增殖和活化, 使ECM成分合成增多, 降解减少, 并存在正反馈放大效应, 促进肝纤维化的进程[4-7]. CTGF是近年来新发现的一种细胞因子, 是具有高度保守性的即刻早期基囚CNN家族成员之一. CTGF与肝纤维化有密切的关系[8]. 人类慢性肝病、肝纤维化及实验性肝纤维化发生发展过程中均与CTGF表达有关, 主要是HSC-CTGF mRNA的表达上调, Crean et al[9]用抗CTGF的中和抗体可阻断TGFβ1引起的促纤维化效应. Mori et al[10]在小鼠皮肤纤维化模型中, TGFβ1可引起短期纤维组织增生, 若同时注射CTGF则可引起持续稳定的纤维组织增生. 进一步研究发现, CTGF启动子中存在TGF-β反应元件, 提示这可能是TGF-β选择性上调CTGF基因表达的分子基础. CTGF可能是TGF-β下游信号效应分子, 特异地介导TGF-β促纤维化效应[11-12], 而不影响TGF-β1免疫抑制和抗细胞增殖效应. 因此, 作为组织器官纤维化形成过程中的重要介质, CTGF的发现可能为防治肝纤维化提供一个新的靶标. 目前, 抗纤维化药物仍存在其局限性, 进一步研究肝纤维化的机制, 有助于开发研究新药物控制或延缓肝纤维化的发展. 最近文献资料显示, IL-10与慢性肝损害发生发展关系密切, 且具有抗纤维化效应, 可望成为治疗肝纤维化的药物. IL-10是由Th2细胞、巨噬细胞和活化的B细胞产生一种细胞因子. 是一类抑制性免疫调节因子, 具有强大的抑制炎症和巨噬细胞功能的作用. 采用CCl4构建肝纤维化模型, IL-10基因敲除小鼠较野生型小鼠肝纤维化程度明显加重[13-14], 提示内源性IL-10对肝纤维化起抑制作用. Nelson et al[15]临床试验显示外源性IL-10可减轻患者及动物模型的肝纤维化程度, 但其作用机制尚不明确. 我们建立了TGFβ1与IL-10干预和共干预体外培养的HSC细胞模型, 采用半定量RT-PCR法检测CTGF mRNA的表达, 结果显示HSC经TGFβ1进一步诱导活化, 表达CTGF mRNA明显增多, 这与以往的研究结果一致; IL-10单独干预, IL-10各浓度组与空白对照组比较, 差别无统计学意义, 说明单用 IL-10对HSC CTGF mRNA表达无明显作用; IL-10与TGFβ1共同干预, 与TGFβ1组比较, CTGF mRNA表达明显减少, 且以IL-10 40 mg/L+TGFβ1 8 mg/L组抑制作用最明显, 差别有统计学意义, 说明IL-10对TGFβ1诱导的CTGF mRNA表达有明显的抑制作用. 因此我们推断, IL-10可通过抑制TGFβ1诱导的CTGF基因表达而发挥抗纤维化效应, 这可能是IL-10抗纤维化机制之一.
肝纤维化是由众多因素参与复杂的病理过程. 肝星状细胞(HSC)的活化在肝纤维化过程中起核心作用, 在各种因素刺激下, HSC增殖, 移行, 表达各种细胞外信号转导通路蛋白, 产生大量以胶原为主的细胞外基质(ECM)成分和细胞因子, 促进肝纤维化的发生发展. TGF-β1是强有力的致纤维化的细胞因子, 促进HSC增殖活化, 合成大量ECM, 在纤维化进程中起重要作用. 目前, 抗纤维化药物仍存在其局限性, 进一步研究肝纤维化的机制, 有助于开发研究新药物控制或延缓肝纤维化的发展.
党双锁, 副教授, 西安交通大学第二医院感染科; 张明辉, 副主任医师, 河北医科大学第一医院肝病中心(传染病)
采用CCl4构建肝纤维化模型, IL-10基因敲除小鼠较野生型小鼠肝纤维化程度明显加重, 提示内源性IL-10对肝纤维化起抑制作用. 临床试验显示外源性IL-10可减轻患者及动物模型的肝纤维化程度, 但其作用机制尚不明确.
最近研究显示, IL-10与慢性肝损害发生发展关系密切, 且具有抗纤维化效应, 可望成为治疗肝纤维化的药物, 但其作用机制尚不明确. CTGF是近年来新发现的一种细胞因子, 可能是TGF-β下游信号效应分子, 特异地介导TGF-β促纤维化效应, 而不影响TGF-β免疫抑制和抗细胞增殖效应. 因此, 作为组织器官纤维化形成过程中的重要介质, CTGF的发现可能为防治肝纤维化提供一个新的靶标.
本研究发现IL-10可显著抑制由TGF-β1诱导的CTGF mRNA的表达, 这可能是IL-10抗纤维化作用机制之一, 有助于进一步指导IL-10的临床应用.
本研究方法合理可行, 结果有价值, 对临床基础研究的突破有意义. 如果进一步探讨IL-10与TGFb1的最佳搭配浓度, 结合机体本身病例状态下观察则更有价值.
编辑: 潘伯荣 电编:何基才
| 1. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor beta response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1094-1106. [PubMed] [DOI] |
| 2. | Chujo S, Shirasaki F, Kawara S, Inagaki Y, Kinbara T, Inaoki M, Takigawa M, Takehara K. Connective tissue growth factor causes persistent proalpha2(I) collagen gene expression induced by transforming growth factor-beta in a mouse fibrosis model. J Cell Physiol. 2005;203:447-456. [PubMed] [DOI] |
| 4. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 5. | Sanderson N, Factor V, Nagy P, Kopp J, Kondaiah P, Wakefield L, Roberts AB, Sporn MB, Thorgeirsson SS. Hepatic expression of mature transforming growth factor beta 1 in transgenic mice results in multiple tissue lesions. Proc Natl Acad Sci U S A. 1995;92:2572-2576. [PubMed] [DOI] |
| 6. | Kanzler S, Lohse AW, Keil A, Henninger J, Dienes HP, Schirmacher P, Rose-John S, zum Buschenfelde KH, Blessing M. TGF-beta1 in liver fibrosis: an inducible transgenic mouse model to study liver fibrogenesis. Am J Physiol. 1999;276:G1059-G1068. [PubMed] |
| 7. | Schnur J, Olah J, Szepesi A, Nagy P, Thorgeirsson SS. Thioacetamide-induced hepatic fibrosis in transforming growth factor beta-1 transgenic mice. Eur J Gastroenterol Hepatol. 2004;16:127-133. [PubMed] [DOI] |
| 8. | Hayashi N, Kakimuma T, Soma Y, Grotendorst GR, Tamaki K, Harada M, Igarashi A. Connective tissue growth factor is directly related to liver fibrosis. Hepatogastroenterology. 2002;49:133-135. [PubMed] |
| 9. | Crean JK, Finlay D, Murphy M, Moss C, Godson C, Martin F, Brady HR. The role of p42/44 MAPK and protein kinase B in connective tissue growth factor induced extracellular matrix protein production, cell migration, and actin cytoskeletal rearrangement in human mesangial cells. J Biol Chem. 2002;277:44187-44194. [PubMed] [DOI] |
| 10. | Mori T, Kawara S, Shinozaki M, Hayashi N, Kakinuma T, Igarashi A, Takigawa M, Nakanishi T, Takehara K. Role and interaction of connective tissue growth factor with transforming growth factor-beta in persistent fibrosis: A mouse fibrosis model. J Cell Physiol. 1999;181:153-159. [PubMed] [DOI] |
| 11. | Williams EJ, Gaca MD, Brigstock DR, Arthur MJ, Benyon RC. Increased expression of connective tissue growth factor in fibrotic human liver and in activated hepatic stellate cells. J Hepatol. 2000;32:754-761. [PubMed] [DOI] |
| 12. | Paradis V, Dargere D, Bonvoust F, Vidaud M, Segarini P, Bedossa P. Effects and regulation of connective tissue growth factor on hepatic stellate cells. Lab Invest. 2002;82:767-774. [PubMed] |
| 13. | Louis H, Van Laethem JL, Wu W, Quertinmont E, Degraef C, Van den Berg K, Demols A, Goldman M, Le Moine O, Geerts A. Interleukin-10 controls neutrophilic infiltration, hepatocyte proliferation, and liver fibrosis induced by carbon tetrachloride in mice. Hepatology. 1998;28:1607-1615. [PubMed] [DOI] |
| 14. | Thompson KC, Trowern A, Fowell A, Marathe M, Haycock C, Arthur MJ, Sheron N. Primary rat and mouse hepatic stellate cells express the macrophage inhibitor cytokine interleukin-10 during the course of activation In vitro. Hepatology. 1998;28:1518-1524. [PubMed] [DOI] |
| 15. | Nelson DR, Lauwers GY, Lau JY, Davis GL. Interleukin 10 treatment reduces fibrosis in patients with chronic hepatitis C: a pilot trial of interferon nonresponders. Gastroenterology. 2000;118:655-660. [PubMed] [DOI] |