修回日期: 2008-05-07
接受日期: 2008-05-12
在线出版日期: 2008-07-08
目的: 研究错配修复蛋白hMSH2与PTEN在散发性结直肠癌的表达变化及两者之间的关系, 以进一步探讨其临床意义.
方法: 采用SP免疫组织化学两步法对42例散发性结直肠癌、相应近端癌旁组织(距癌组织3 cm)和远端癌旁组织(距癌组织>10 cm)及15例正常结直肠组织进行hMSH2与PTEN蛋白表达检测. 同时Western blot法检测42例散发性结直肠癌、相应远端对照组织hMSH2与PTEN蛋白表达. 分析散发性结直肠癌发病机制及hMSH2与PTEN蛋白表达与临床病理之间的关系.
结果: 结直肠癌组织中, hMSH2与PTEN蛋白失表达率(阴性率)均低于正常结直肠组织及近端癌旁组织、远端癌旁组织 (χ2hMSH2 = 7.967, χ2PTEN = 11.67, 均P<0.05). PTEN蛋白表达与肿瘤分化程度呈正相关(rs = 0.727, P<0.05), 与Dukes分期、侵润深度、淋巴结转移、肝转移均呈负相关(rs = -0.727, -0.718, -0.718, -0.535, 均P<0.05). hMSH2蛋白表达与上述临床病理特征未见明显相关. hMSH2与PTEN蛋白表达在散发性结直肠癌中呈正相关(rs = 0.679, P<0.05). 与远端对照组织相比42例结直肠癌组织中hMSH2蛋白低表达率为59.52%(25/42), PTEN低表达率为45.24%(19/42).
结论: PTEN表达与其临床病理特征相关; 在散发性结直肠癌发生、发展过程中错配修复蛋白hMSH2表达缺失伴有PTEN蛋白表达
下调.
引文著录: 宋伟庆, 范占彬, 王烨, 袁虎方, 杨彦林, 王利伟, 韩彩丽. 散发性结直肠癌中hMSH2与PTEN的表达及临床意义. 世界华人消化杂志 2008; 16(19): 2125-2130
Revised: May 7, 2008
Accepted: May 12, 2008
Published online: July 8, 2008
AIM: To investigate expression alteration of human mut-s homologue 2 (hMSH2) and PTEN in sporadic colorectal carcinoma (SCC) and thereby to elucidate their relationship and clinical significance.
METHODS: Expression levels of hMSH2 and PTEN were detected using immunohistochemistry in 42 cases of SCC, its corresponding adjacent tissues (3 cm away from cancerous tissues), distal tissues (from cancer > 10 cm) and 15 cases of normal colorectal tissues. The expression levels of hMSH2 and PTEN protein were analyzed using Western blot in 42 cases of SCC and its corresponding distal controls.
RESULTS: Both negative expression of hMSH2 and PTEN were higher in SCC than in adjacent tissues, distal tissues or normal colorectal tissues (χ2hMSH2 = 7.967, χ2PTEN = 11.667, both P < 0.05). PTEN protein expression was positively correlated with tumor differentiation (rs = 0.727 P < 0.05) and negatively correlated with Dukes stage, invasive depth, lymph node metastasis and liver metastasis(rs = -0.727, -0.718, -0.718, -0.535, all P < 0.05). No significant correlation was observed between hMSH2 protein expression and SCC pathological features. There was a positive correlation between of the hMSH2 and PTEN protein in SCC (rs = 0.679, P < 0.05). Compared with the corresponding distal tissues, there were 25 cases of (59.52% 25/42) lower expression of hMSH2 protein and 19 cases (45.24% 19/42)of lower expression of PTEN protein in SCC.
CONCLUSION: PTEN protein expression is correlated with clinic and pathological features. The expression deletion of mismatch repair protein hMSH2 accompanied by down-regulated PTEN protein expression occur in SCC development.
- Citation: Song WQ, Fan ZB, Wang Y, Yuan HF, Yang YL, Wang LW, Han CL. Expression of hMSH2 and PTEN protein in sporadic colorectal carcinoma and their clinical significances. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2125-2130
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2125.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2125
结直肠癌发病率呈上升趋势, 在西方发达国家结直肠癌仅次于肺癌位于恶性肿瘤发病的第2位, 在我国居第3位. 在发病率上升的同时, 其发病年龄趋于年轻化, 发病部位趋于低位直肠. 有关错配修复蛋白hMSH2、hMLH1及微卫星不稳定(microsatellite instability, MSI)、PTEN多有报道, 但hMSH2和PTEN之间的关联报道鲜见. 错配修复(mismatch repair, MMR)基因是广泛存在于原核及真核生物细胞内高度保守的看家基因. 错配修复基因功能缺陷与多种肿瘤尤其是结直肠癌的发生关系密切. 目前人类的MMR系统含有9个基因: hMLH1, hMLH3, hPMS1, hPMS2, hMSH2, hMSH3, hMSH4, hMSH5, hMSH6. 其中hMLH1和hMSH2是人类MMR系统中功能最重要的两个基因[1]. PTEN为一新发现的抑癌基因, 位于10q23.3, 转录产物为515 kb mRNA, 他在细胞凋亡、迁移和肿瘤演进中具有重要作用[2]. 本研究采用SP免疫组织化学两步法对42例散发性结直肠癌、相应近端癌旁组织(距癌组织3 cm)和远端癌旁组织(距癌组织>10 cm)及15例正常结直肠组织进行hMSH2与PTEN蛋白表达的检测. 采用Western blot检测42例散发性结直肠癌、相应远端对照组织(距癌组织>10 cm)进行hMSH2与PTEN蛋白表达的检测. 进一步探讨散发性结直肠癌发病机制及hMSH2与PTEN蛋白表达表达与临床病理之间的关系.
研究对象为2006-01/2007-12在河北医科大学第二医院外科接受治疗的原发性结直肠癌的患者42例, 取患者癌组织、相应近端癌旁组织(距癌组织3 cm)和远端癌旁组织(距癌组织>10 cm)及15例正常结直肠组织(为外伤、息肉、溃疡病需手术切除的正常结直肠组织)所取标本备2份. 1份迅速放入-80℃冰箱中以保持标本的新鲜备用, 另1份经40 g/L甲醛溶液固定、石蜡包埋、4 μm连续切片备用. 癌组织均经病理医师确诊. 其中男性23例, 女性19例. 年龄38-75(平均年龄58.31±1.28)岁. 结肠癌23例, 直肠癌19例. 高度分化癌和中度分化癌27例, 低分化癌和未分化癌15例. hMSH2兔抗人多克隆抗体购自Biolegend公司, 工作浓度1:100, PTEN兔抗人多克隆抗体购自Biolegend公司, 工作浓度1:50, SP免疫组化试剂盒、DAB试剂盒均购于北京中山生物技术公司. Tris-Hcl工作浓度50 mmol/L; NP40购自华美生物工程公司, 工作浓度1%; 脱氧胆酸钠工作浓度0.5%; SDS工作浓度0.1%; PMSF购自Promega公司, 工作浓度1 mmol/L; Aprotinin购自Amrcsco公司工作浓度10 mg/L; 预染蛋白标准购自美国Fermentas公司; 考马斯亮蓝蛋白定量试剂盒购自南京建成生物试剂公司; 蛋白酶K购自拜昂生物技术有限公司.
1.2.1 免疫组织化学检测方法: 将收集的标本经100 g/L中性甲醛固定, 常规石蜡包埋后制成3-4 μm 连续切片, 按试剂盒说明书进行免疫组织化学染色, DAB显色, 苏木素复染后, 中性树胶封片. 取已知阳性组织作阳性对照, 以PBS代替一抗作为阴性对照. hMSH2、PTEN蛋白均定位在胞质, 胞质中出现棕黄色颗粒为阳性表达. 阳性细胞计数方法: 高倍镜下(400倍)每张组织切片记数5个视野, 每个视野计数100个细胞, 取阳性细胞数百分比的平均值. 阳性细胞数占11%-50%时为低表达, 阳性细胞数占51%-100%为高表达, 阳性细胞数≤10%时则视为失表达(阴性).
1.2.2 Western blot检测方法: (1)提取组织总蛋白: 剪碎组织, PBS漂洗2遍. 加裂解缓冲液作用10 min, 制成匀浆. 离心取上清夜, 用考马斯亮蓝蛋白定量试剂盒定量分析, 每次检测前用β-actin抗体标准化监测. (2)配置SDS-PAGE, 标本上样. (3)10 mA稳流条件电泳3 h. (4)转膜, 5%脱脂奶粉封闭过夜. (5)加一抗, 4℃过夜; TTBS漂洗3次: 加二抗, 37℃ 1 h, TTBS漂洗3次. (6)DAB显色, 采用凝胶分析系统进行照相、分析. 凝胶成像系统(UVP, 美国)LabWorks4.5软件对蛋白表达行半定量分析, 以积分吸光度(IA)值表示. 以相对IA值比较蛋白表达高低. 相对IA值=hMSH2和PTEN蛋白的IA值/相应β-actin蛋白的IA值. 判定标准: 以正常组织相对IA值作为参照标准, 计算95%参考值范围, 对癌组织相对IA值进行判断, 低于下限则判为低表达, 高于上限则判为高表达.
统计学处理 采用SPSS11.5统计软件进行统计学数据处理, 计数资料用χ2检验, P<0.05为差异有显著性意义, P<0.01为差异有非常显著性意义. 应用非参数统计中Spearman等级相关对二者在结直肠癌中表达及相互间关系进行分析.
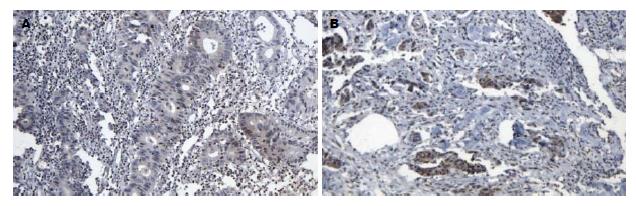
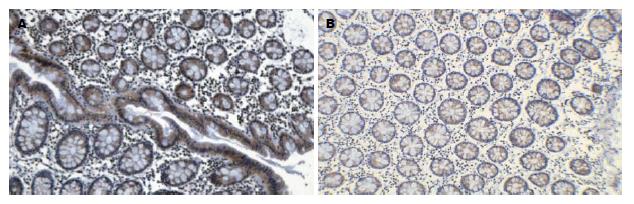
hMSH2失表达率(阴性率)在癌组织为30.95%(13/42)(图1A), 在近端癌旁组织为19.05%(8/42), 在远端癌旁组织为16.67%(7/42), 在正常结直肠组织为6.67%(1/15)(图2A). hMSH2在癌组织中失表达率高于近端癌旁组织、远端癌旁组织及正常结直肠组织(χ2 = 7.967, P<0.05), 而近端癌旁组织、远端癌旁组织和正常组织失表达率无显著差异. PTEN失表达率在癌组织为42.86%(18/42)(图1B), 在近端癌旁组织为23.81%(10/42), 在远端癌旁组织为16.67%(7/42), 在正常结直肠组织为6.67%(1/15)(图2B). PTEN在癌组织中失表达率高于近端癌旁组织、远端癌旁组织及正常结直肠组织(χ2 = 11.67, P<0.05), 而近端癌旁组织、远端癌旁组织和正常组织失表达率无显著差异(表1).
| 分组 | n | hMSH2 | PTEN | ||||
| 阴性 | 低表达 | 高表达 | 阴性 | 低表达 | 高表达 | ||
| 正常组 | 15 | 1 | 5 | 9 | 1 | 6 | 8 |
| 远端癌旁 | 42 | 7 | 16 | 19 | 7 | 13 | 22 |
| 近端癌旁 | 42 | 8 | 14 | 20 | 10 | 20 | 12 |
| 结直肠癌 | 42 | 13 | 18 | 11 | 18 | 9 | 15 |
hMSH2及PTEN低表达及失表达与患者年龄、性别、肿瘤发生的部位、组织学类型、大体类型均未见明显关系, PTEN低表达及失表达与肿瘤分化程度、浸润深度、Dukes分期、淋巴结转移及肝转移有统计学意义(P<0.05, 表2), hMSH2低表达及失表达与肿瘤分化程度、浸润深度、Dukes分期、淋巴结转移及肝转移未见明显相关(P>0.05, 表2).
| 对比项目 | n | hMSH2 | PTEN | ||||
| 阴性 | 低表达 | 高表达 | 阴性 | 低表达 | 高表达 | ||
| 年龄(岁) | |||||||
| ≤55 | 22 | 6 | 10 | 6 | 10 | 4 | 8 |
| >55 | 20 | 7 | 8 | 5 | 8 | 5 | 7 |
| 性别 | |||||||
| 男 | 23 | 9 | 8 | 6 | 12 | 3 | 8 |
| 女 | 19 | 4 | 10 | 5 | 6 | 6 | 7 |
| 部位 | |||||||
| 直肠 | 19 | 5 | 10 | 4 | 7 | 6 | 6 |
| 结肠 | 23 | 8 | 8 | 7 | 11 | 3 | 9 |
| 分化程度 | |||||||
| 高中 | 27 | 11 | 8 | 8 | 8 | 5 | 14 |
| 低未 | 15 | 2 | 10 | 3 | 10 | 4 | 1 |
| 浆膜浸润 | |||||||
| 有 | 15 | 4 | 6 | 5 | 14 | 1 | 0 |
| 无 | 27 | 9 | 12 | 6 | 4 | 8 | 15 |
| Dukes分期 | |||||||
| A+B | 22 | 5 | 10 | 7 | 1 | 8 | 13 |
| C+D | 20 | 8 | 8 | 4 | 17 | 1 | 2 |
| 淋巴转移 | |||||||
| 无 | 22 | 5 | 10 | 7 | 1 | 8 | 13 |
| 有 | 20 | 8 | 8 | 4 | 17 | 1 | 2 |
| 肝转移 | |||||||
| 无 | 35 | 11 | 16 | 8 | 11 | 9 | 15 |
| 有 | 7 | 2 | 2 | 3 | 7 | 0 | 0 |
| 组织类型 | |||||||
| 腺癌 | 31 | 8 | 14 | 9 | 14 | 5 | 12 |
| 黏液 | 8 | 3 | 3 | 2 | 3 | 3 | 2 |
| 腺癌 | |||||||
| 印戒 | 3 | 2 | 1 | 0 | 1 | 1 | 1 |
| 细胞癌 | |||||||
| 大体类型 | |||||||
| 隆起型 | 10 | 4 | 4 | 2 | 3 | 4 | 3 |
| 溃疡型 | 28 | 8 | 12 | 8 | 13 | 4 | 11 |
| 缩窄型 | 4 | 1 | 2 | 1 | 2 | 1 | 1 |
PTEN表达与肿瘤分化程度正相关(rs = 0.727, P<0.05), 与浸润深度、Dukes分期、淋巴结转移、肝转移均负相关(分别为: rs = -0.727, rs = -0.718, rs = -0.718, rs = -0.535, P<0.05, 表3).
| 对比项目 | n | PTEN | |||
| 阴性 | 低表达 | 高表达 | rs值 | ||
| 分化程度 | |||||
| 高中 | 27 | 8 | 5 | 14 | 0.727 |
| 低未 | 15 | 10 | 4 | 1 | |
| 浆膜侵犯 | |||||
| 有 | 15 | 14 | 1 | 0 | -0.727 |
| 无 | 27 | 4 | 8 | 15 | |
| Dukes分期 | |||||
| A+B | 22 | 1 | 8 | 13 | -0.718 |
| C+D | 20 | 17 | 1 | 2 | |
| 淋巴转移 | |||||
| 无 | 22 | 1 | 8 | 13 | -0.718 |
| 有 | 20 | 17 | 1 | 2 | |
| 肝转移 | |||||
| 无 | 35 | 11 | 9 | 15 | -0.535 |
| 有 | 7 | 7 | 0 | 0 | |
hMSH2与PTEN蛋白表达在散发性结直肠癌中呈正相关(rs = 0.679, P<0.05), 错配修复蛋白hMSH2表达缺失伴有PTEN蛋白表达下调(表4).
| hMSH2 | rs值 | P | ||||
| 阴性 | 低表达 | 高表达 | ||||
| 阴性 | 6 | 7 | 5 | |||
| PTEN | L | 4 | 3 | 2 | 0.679 | <0.05 |
| H | 3 | 8 | 4 | |||
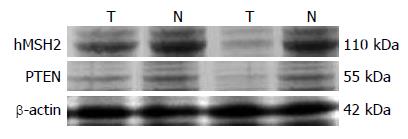
β-actin、hMSH2、PTEN蛋白分子量分别为42 kDa、110 kDa、55 kDa, Western杂交后在42 kDa、110 kDa、55 kDa位置出现相应阳性条带. 采用凝胶成像分析系统对杂交条带进行半定量分析, 蛋白含量以IA表示, 以相对积分吸光度比较蛋白表达高低, 每次检测蛋白时均检测β-actin蛋白, 以其为标准对所检测hMSH2、PTEN蛋白进行定量. 与对照组织相比, 42例结直肠癌组织中25例hMSH2蛋白低表达, 其低表达率为59.52%(25/42), 19例PTEN蛋白低表达, 其低表达率为45.24%(19/42), 两种蛋白表达水平均明显低于对照组织(P<0.05); 16例两种蛋白均低表达. hMSH2与PTEN蛋白表达在散发性结直肠癌中呈正相关(rs = 0.816, P<0.05)(图3).
近10余年来, 结直肠癌发生分子模型的提出、遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)发病机制的阐明和APC-β-catenin-Tcf通路改变在结直肠癌发生中作用的确定是结直肠癌研究具有影响的三大进展. 自1993年Thibodeau et al在HNPCC中证实有微卫星不稳定(microsatellite instable MSI)存在以来, 在HNPCC发生中非常明确, 由于错配修复基因的突变引起MSI而发生结直肠癌. hMSH2基因在其中起重要作用. MMR功能缺陷的表现型是高度的微卫星不稳定(high level microsatellite instability, MSI-H), 又称之为复制错误(replication error, RER)阳性[3]. 复制错误阳性的散发性结直肠癌与复制错误阴性者相比, 较少发生淋巴结转移, 生物学行为较好[4]. 研究发现, hMSH2蛋白的表达变化结果可很好的识别MSI-H肿瘤和预示MMR功能缺陷的存在[5].
本研究结果显示: 在42例散发性结直肠癌病例中, 有13例hMSH2失表达, 占28.3%(13/42)此结果与Gafa et al[4]研究结果相一致. hMSH2蛋白失表达率高于正常组织, 与肿瘤分化程度、Dukes分期、浸润深度、淋巴结转移位未见明显相关, 这与史恩溢 et al[6]研究结果一致. 说明在结直肠癌发生、发展过程中, 错配修复基因hMSH2是遗传易感基因, 此基因的突变或缺失与散发性结直肠癌密切相关. 目前认为, 单独hMSH2基因缺陷不足以引起肿瘤, 错配修复基因缺陷可能主要通过三条途径促进肿瘤的发生与发展: (1)增加癌基因和/或抑癌基因的突变率. (2)使一些重要的功能基因发生遗传不稳定. (3)通过化学物质使细胞损伤导致肿瘤发生.
PTEN/MMAC1/TEP1基因是1997年由3个研究组分别发现和命名的一种抑癌基因. PTEN的抑癌作用可通过以下途径来完成: (1)FA K途径[7]. (2)三磷酸脂酸肌醇(PI3)激酶途径[8]. (3)丝裂原激活的蛋白激酶(mitogen activated protein kinase, MAPK)途径[9]. 关于PTEN与肿瘤之间的关系已有较多报道. Cowden(CD)征合征是一种常染色体隐性遗传性肿瘤综合征, 对其家系进行的研究发现存在着PTEN基因的生殖细胞突变. 这充分说明, PTEN是一个典型的抑癌基因[10]. 其他恶性肿瘤如恶性胶质瘤、前列腺癌、子宫内膜癌及卵巢癌中, 也发现了较高频率的PTEN等位基因杂合性缺失和突变, 其中子宫内膜癌的突变率可高达50%[11].
本研究结果显示: PTEN蛋白表达阴性率高于正常组织; 此结果与刘振华 et al[12]研究结果相一致. PTEN蛋白表达水平与mRNA水平结果一致, PTEN抑制肿瘤作用主要通过脱去多种促瘤生长因子介导的细胞内信号转导途径中的关键激酶的磷酸根, 降低其磷酸化水平, 阻断信号传导通路, 以抑制细胞生长、转化、黏附、铺展及迁移, 促进调亡, 对肿瘤生长、侵袭和转移起负性调控作用. 当PTEN基因失活, 促瘤生长因子磷酸化, 导致肿瘤形成. PTEN蛋白表达与肿瘤分化程度呈正相关, 与Dukes分期、浸润深度、淋巴结转移均呈负相关与孟冬月 et al研究结果一致[13]. 孟冬月探讨结直肠癌中PTEN、E-cad、MMP-2表达情况显示: 淋巴结转移组PTEN、E-cad低表达, PTEN蛋白在高分化、中分化、低分化表达逐步降低, 与本实验结果符合. PTEN表达缺失通过intergrin介导的MAPK信号转导途径, 促进瘤细胞的迁移和扩散. 赵勇 et al[14]研究结直肠癌survivin, PTEN表达及其与细胞增殖、凋亡的关联性结果显示PTEN阳性率与分化程度正相关. PTEN表达缺失可以增强肿瘤细胞整合素与配体结合强度, 将信号传递进入细胞核内, 调节细胞内信号通道、控制细胞骨架变形和能量代谢, 从而改变细胞的形态、移行从而使细胞的恶性度增加[15].
在Western blot结果显示: 42例结直肠癌与对照组织相比, hMSH2蛋白低表达率为59.52%; PTEN蛋白低表达率为45.24%; 两种蛋白表达水平均明显低于对照组织. hMSH2蛋白低表达说明hMSH2蛋白与结直肠癌发生关系密切, 错配修复缺陷可通过增加癌基因和/或抑癌基因的突变率[16]导致结直肠癌发生或通过微卫星不稳定使某些决定性基因如TGF-β型受体基因突变[17], 促使肿瘤形成. 同样在结直肠癌组织中PTEN蛋白低表达也说明PTEN蛋白与结直肠癌发生关系密切, PTEN基因失活, 导致PTEN蛋白生成减少, 通过FAK途径[7]或MAPK途径[9]进而导致结直肠癌发生.
本研究结果显示: hMSH2与PTEN在散发性结直肠癌的表达呈正相关. 提示二者在细胞增殖调控可能存在正反馈调节机制, PTEN抑癌基因失活容易出现微卫星不稳定, 基因的多点突变和DNA复制错误, 使hMSH2基因表达代偿性上调, 但增多的基因产物仍不足以修复已发生损伤的基因, 使细胞向恶性转化. 错配修复蛋白hMSH2与PTEN在散发性结直肠癌中呈失表达及低表达, 在正常结直肠组织呈显著表达. 一定比例的散发性结直肠癌中存在PTEN表达与其临床病理特征相关. 在散发性结直肠癌发生、发展过程中错配修复蛋白hMSH2表达缺失伴有PTEN蛋白表达下调. 二者联合与散发性结直肠癌发生、发展关系密切. 联合检测二者的表达可能会有助于结直肠癌预防及诊断.
结直肠癌发病率呈上升趋势, 在西方发达国家结直肠癌仅次于肺癌位于恶性肿瘤发病的第2位, 在我国居第3位. 在发病率上升的同时, 其发病年龄趋于年轻化, 发病部位趋于低位直肠. 本研究进一步探讨散发性结直肠癌发病机制及hMSH2与PTEN蛋白表达表达与临床病理之间的关系.
张锦生, 教授, 复旦大学上海医学院病理学系
近10余年来, 结直肠癌发生分子模型的提出、遗传性非息肉病性结直肠癌(HNPCC)发病机制的阐明和APC-β-catenin-Tcf通路改变在结直肠癌发生中作用的确定是结直肠癌研究具有影响的三大进展.
赵勇 et al研究结直肠癌survivin, PTEN表达及其与细胞增殖、凋亡的关联性结果显示PTEN阳性率与分化程度正相关.
在散发性结直肠癌发生、发展过程中错配修复蛋白hMSH2表达缺失伴有PTEN蛋白表达下调. 二者联合与散发性结直肠癌发生、发展关系密切. 联合检测二者的表达可能会有助于结直肠癌预防及诊断.
错配修复蛋白hMSH2、hMLH1和PTEN表达变化与大肠癌发病的关系, 已写进教科书, 但两者之间相关性的研究较少, 国内曾在胃癌、子宫内膜癌和肺癌中对hMSH2和PTEN表达变化的相关性作过研究, 尚未见大肠癌中hMSH2和PTEN表达变化的相关性研究, 故该文有一定的参考价值.
编辑: 李军亮 电编:郭海丽
| 1. | Yu Z, Chen J, Ford BN, Brackley ME, Glickman BW. Human DNA repair systems: an overview. Environ Mol Mutagen. 1999;33:3-20. [PubMed] [DOI] |
| 2. | Yamada KM, Araki M. Tumor suppressor PTEN: modulator of cell signaling, growth, migration and apoptosis. J Cell Sci. 2001;114:2375-2382. [PubMed] |
| 3. | Boland CR, Thibodeau SN, Hamilton SR, Sidransky D, Eshleman JR, Burt RW, Meltzer SJ, Rodriguez-Bigas MA, Fodde R, Ranzani GN. A National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition: development of international criteria for the determination of microsatellite instability in colorectal cancer. Cancer Res. 1998;58:5248-5257. [PubMed] |
| 4. | Gafa R, Maestri I, Matteuzzi M, Santini A, Ferretti S, Cavazzini L, Lanza G. Sporadic colorectal adenocarcinomas with high-frequency microsatellite instability. Cancer. 2000;89:2025-2037. [PubMed] [DOI] |
| 5. | Shia J, Ellis NA, Klimstra DS. The utility of immunohistochemical detection of DNA mismatch repair gene proteins. Virchows Arch. 2004;445:431-441. [PubMed] [DOI] |
| 7. | Tamura M, Gu J, Takino T, Yamada KM. Tumor suppressor PTEN inhibition of cell invasion, migration, and growth: differential involvement of focal adhesion kinase and p130Cas. Cancer Res. 1999;59:442-449. [PubMed] |
| 8. | Stambolic V, Suzuki A, de la Pompa JL, Brothers GM, Mirtsos C, Sasaki T, Ruland J, Penninger JM, Siderovski DP, Mak TW. Negative regulation of PKB/Akt-dependent cell survival by the tumor suppressor PTEN. Cell. 1998;95:29-39. [PubMed] [DOI] |
| 9. | Achiwa Y, Hasegawa K, Udagawa Y. Regulation of the phosphatidylinositol 3-kinase-Akt and the mitogen-activated protein kinase pathways by ursolic acid in human endometrial cancer cells. Biosci Biotechnol Biochem. 2007;71:31-37. [PubMed] [DOI] |
| 10. | Alvarez-Breckenridge CA, Waite KA, Eng C. PTEN regulates phospholipase D and phospholipase C. Hum Mol Genet. 2007;16:1157-1163. [PubMed] [DOI] |
| 11. | An HJ, Lee YH, Cho NH, Shim JY, Kim JY, Lee C, Kim SJ. Alteration of PTEN expression in endometrial carcinoma is associated with down-regulation of cyclin-dependent kinase inhibitor, p27. Histopathology. 2002;41:437-445. [PubMed] [DOI] |
| 16. | Loeb LA. Microsatellite instability: marker of a mutator phenotype in cancer. Cancer Res. 1994;54:5059-5063. [PubMed] |
| 17. | Rhyu MS. Molecular mechanisms underlying hereditary nonpolyposis colorectal carcinoma. J Natl Cancer Inst. 1996;88:240-251. [PubMed] [DOI] |