修回日期: 2008-04-23
接受日期: 2008-04-28
在线出版日期: 2008-07-08
目的: 观察S100A2 mRNA及其蛋白在食管鳞状细胞癌组织中的表达及其与食管癌临床病理特征之间的关系, 并探讨其在食管癌发生、发展中的作用及临床应用价值.
方法: 收集40例手术切除的食管鳞状细胞癌标本, 同时取40例手术切缘食管正常黏膜组织. 应用免疫组织化学S-P法检测其中S100A2蛋白的表达, 原位分子杂交技术检测S100A2 mRNA的表达.
结果: S100A2 mRNA及S100A2蛋白在食管鳞状细胞癌组织中阳性表达率均明显低于正常食管黏膜(77.5% vs 100%, 72.5% vs 100%, 均P<0.01); 其中高、中、低分化三组间差异均有显著性(均P<0.05), 并且高、中分化组S100A2 mRNA的阳性表达率均明显高于低分化组(分别为93.3% vs 85.7%, 86.7% vs 85.7%, 均P<0.05); 无淋巴结转移组S100A2 mRNA阳性表达率均明显高于有淋巴结转移组(分别为92% vs 53.3%, 92% vs 40%, 均P<0.01). 食管鳞状细胞癌组织中S100A2 mRNA和S100A2蛋白的表达呈明显正相关(r = 0.607, P<0.001).
结论: S100A2在食管癌的发生发展中具有重要作用, 并可能作为判断食管癌生物学行为的重要参考指标.
引文著录: 尹玉, 张洪福. S100A2基因及其蛋白在食管癌中的表达及其临床意义. 世界华人消化杂志 2008; 16(19): 2119-2124
Revised: April 23, 2008
Accepted: April 28, 2008
Published online: July 8, 2008
AIM: To investigate the expression of S100A2 mRNA and its protein in esophageal squamous cell cancer(ESCC) and their relationship with clinicopathologic features, and explore their roles in carcinogenesis and progression of esophageal cancer and to evaluate their clinicopathologic significance.
METHODS: Immunohistochemical staining (S-P method) was performed to detect S100A2 protein expression in 40 ESCC samples and 40 samples from normal esophageal mucosa. In situ hybridization (ISH) was performed to detect the expression of S100A2 mRNA.
RESULTS: The positive rates of S100A2 mRNA and S100A2 protein in ESCC samples were both markedly lower than that in normal mucosa (77.5% vs 100%, 72.5% vs 100%, both P < 0.01). The differences were both significant among the well differentiated, the moderately differentiated and the lowly differentiated groups (all P < 0.05). The expression levels of S100A2 mRNA and S100A2 protein were significantly higher in well and moderately differentiated groups than that in lowly differentiated group (93.3% vs 85.7%, 86.7% vs 85.7%, both P < 0.05). There was significant difference between the lymph node-positive group and the lymph node-negative group (92% vs 53.3%, 92% vs 40%, both P < 0.01). A positive correlation was found between the expression of S100A2 mRNA and S100A2 protein (r = 0.607, P < 0.001).
CONCLUSION: S100A2 plays an important role in ESCC carcinogenesis. S100A2 might be an important reference biomarker for ESCC biological behavior.
- Citation: Yin Y, Zhang HF. Expression of S100A2 mRNA and protein and its clinical significance in esophageal cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2119-2124
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2119.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2119
S100A2基因是一个肿瘤相关基因, 定位于人染色体1q21[1], 其编码的蛋白质为97个氨基酸所组成的一个钙结合蛋白[2]. 研究结果提示在S100A2存在时, 因其能够结合钙离子而使钙离子浓度降低, 致使细胞增生活性得到控制, 从而抑制肿瘤的生成[1]. 作为S100家族成员之一, 与其他成员相比, S100A2具有其独特性. 首先, 相对于其他S100蛋白定位于胞质, S100A2蛋白主要定位于胞核. 另外, 相对于其他大多数S100家族成员对肿瘤的发生发展起促进作用, S100A2对肿瘤所起的主要是抑制作用, 他在许多恶性肿瘤中表达明显降低或缺失, 因此被看作是候选抑癌基因[3]. 关于S100A2在食管癌组织中的表达及其与临床病理学因素之间的关系, 目前国内外研究较少. 本研究应用免疫组织化学S-P法检测40例食管癌组织和40例正常食管黏膜组织中S100A2蛋白的表达情况; 运用原位分子杂交技术检测食管癌组织和正常食管黏膜组织中S100A2 mRNA的表达, 观察他们之间及其与食管癌临床病理因素之间的关系, 并探讨他们在食管癌发生和发展中的作用, 以期为食管癌早期诊断、早期治疗和判断其生物学行为提供新的参考指标.
收集安徽医科大学第一附属医院病理科2005-2006年住院食管癌手术切除标本40例, 患者术前均未作放疗、化疗及免疫治疗, 术后病理诊断为食管鳞状细胞癌. 其中, 男31例, 女9例. 年龄49-76(中位年龄62)岁. 上段食管癌5例, 中段食管癌18例, 下段食管癌17例; 溃疡型29例, 髓质型5例, 蕈伞型5例, 缩窄型1例; 有淋巴结转移者15例, 无淋巴结转移者25例. 按组织学分级: 高分化15例, 中分化14例, 低分化11例. 按国际抗癌联合会(UICC)1997年标准临床病理分期: Ⅰ期1例, Ⅱ期30例, Ⅲ期8例, Ⅳ期1例. 所有标本组织经40 g/L甲醛固定, 常规石蜡包埋, 4 μm厚连续切片, 分别进行HE染色、免疫组化染色和原位杂交染色. 染色结果均由两位病理医生阅读诊断核实. 同时取40例距癌灶边缘5 cm以上切缘的正常黏膜组织作为对照组, 并分别作上述各种染色. 兔抗人S100A2多克隆抗体购自Neomarker公司(1:100稀释), SP免疫组化试剂盒购自福州迈新生物技术有限公司, DAB显色试剂盒购自北京中杉生物技术有限公司. S100A2原位杂交检测试剂盒购自武汉博士德生物技术有限公司(产品编号: MK2639-h). DEPC由美国Sigma公司生产; DAB显色试剂盒购自北京中杉生物技术有限公司.
采用预实验反复多次证实均呈阳性的正常食管黏膜组织切片为阳性对照, 用PBS代替一抗或杂交液作为阴性对照. 具体实验步骤参照试剂盒说明进行. S100A2蛋白免疫组织化学和S100A2 mRNA原位分子杂交阳性信号均为黄色或棕黄色颗粒, 定位于细胞核或细胞核和细胞质[4-5]. 每张切片选择10个高倍视野(×40), 根据阳性细胞数占视野中总细胞数的百分比判定: 阳性细胞比例<10%为阴性(-), 阳性细胞比例≥10%为阳性(+)[6].
统计学处理 应用SPSS13.0软件包进行统计分析. 计量资料采用c2检验, 对行列表资料含有理论频数小于5者采用蒙特卡罗模拟方法(Monte Carlo)计算确切概率值. 等级资料的相关性分析采用非参数Spearman等级相关分析法检验.
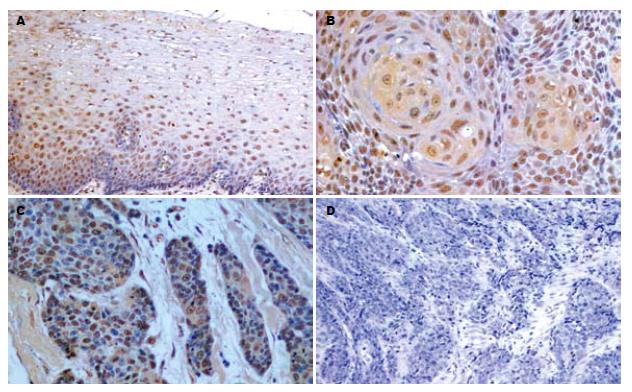
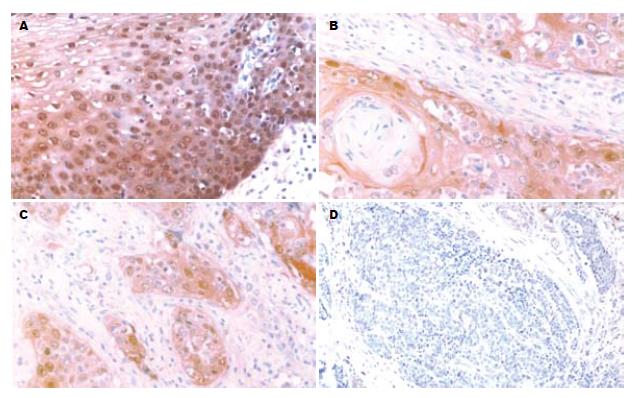
S100A2 mRNA和S100A2蛋白阳性信号均为黄色或棕黄色颗粒, 定位于细胞核或细胞核和细胞质. 在正常食管黏膜中S100A2 mRNA和S100A2蛋白的表达水平高(图1A, 图2A); 而在食管鳞状细胞癌中表达明显降低(图1B-D, 图2B-D). 40例正常食管黏膜中S100A2 mRNA和蛋白的阳性率均为100%(40/40); 40例鳞状细胞癌组织中S100A2 mRNA阳性率为77.5%(31/40), S100A2蛋白阳性率为72.5%(29/40). S100A2 mRNA和蛋白在食管鳞状细胞癌组织中的表达与正常食管黏膜相比, 差异有显著性(P<0.01, 表1).
S100A2 mRNA在高、中、低分化鳞状细胞癌中的阳性表达率分别是93.3%(14/15)、85.7%(12/14)、45.5%(5/11), 三组间差异有显著性(P<0.05), 并且高、中分化组S100A2 mRNA的阳性表达率均高于低分化组(P<0.05); 无淋巴结转移组其阳性表达率为92.0%(23/25), 而有淋巴结转移组S100A2 mRNA阳性表达率为53.3%(8/15), 两者之间差异有显著性(P<0.01). S100A2蛋白在高、中、低分化鳞状细胞癌中的阳性表达率分别是86.7%(13/15)、85.7%(12/14)、36.4%(4/11), 三组间比较, 差异有显著性(P<0.01), 并且高、中分化组S100A2蛋白的阳性表达率均高于低分化组(P<0.05); 无淋巴结转移组其阳性表达率为92.0%(23/25), 而有淋巴结转移组S100A2蛋白阳性表达率为40.0%(6/15), 两者之间差异有显著性(P<0.01). S100A2 mRNA和S100A2蛋白的表达与患者性别、年龄、临床分期、肿瘤部位、肿瘤大小及浸润深度均无关(P>0.05, 表2).
| 分组 | n | S100A2 mRNA的表达 | 阳性率(%) | S100A2蛋白的表达 | 阳性率(%) | ||
| - | + | - | + | ||||
| 性别 | |||||||
| 男 | 31 | 7 | 24 | 77.4 | 8 | 23 | 74.2 |
| 女 | 9 | 2 | 7 | 77.8 | 3 | 6 | 66.7 |
| 年龄(岁) | |||||||
| <62 | 21 | 4 | 17 | 81 | 4 | 17 | 81 |
| ≥62 | 19 | 5 | 14 | 73.7 | 7 | 12 | 63.2 |
| 临床分期 | |||||||
| Ⅰ+Ⅱ期 | 31 | 5 | 26 | 83.9 | 6 | 25 | 80.7 |
| Ⅲ+Ⅳ期 | 9 | 4 | 5 | 55.6 | 5 | 4 | 44.4 |
| 肿瘤部位 | |||||||
| 上+中段 | 23 | 3 | 20 | 87 | 5 | 18 | 78.3 |
| 下段 | 17 | 6 | 11 | 64.7 | 6 | 11 | 64.7 |
| 肿瘤大小(cm) | |||||||
| <3.5 | 16 | 3 | 13 | 81.3 | 4 | 12 | 75 |
| ≥3.5 | 24 | 6 | 18 | 75 | 7 | 17 | 70.8 |
| 浸润深度 | |||||||
| 未及浆膜 | 20 | 4 | 16 | 80 | 4 | 16 | 80 |
| 侵及浆膜 | 20 | 5 | 15 | 75 | 7 | 13 | 75 |
| 分化程度 | |||||||
| 高 | 15 | 1 | 14 | 93.3 | 2 | 13 | 86.7 |
| 中 | 14 | 2 | 12 | 85.7c | 2 | 12 | 85.7c |
| 低 | 11 | 6 | 5 | 45.5a | 7 | 4 | 36.4b |
| 淋巴结转移 | |||||||
| 无 | 25 | 2 | 23 | 92 | 2 | 23 | 92 |
| 有 | 15 | 7 | 8 | 53.3d | 9 | 6 | 40d |
S100A2基因全长为8670 bp, 定位于人染色体1q21的250-300 kb之间. 1991年由Lee et al[7]利用抑制性消减杂交技术, 将正常细胞NMECS(76株, 从乳腺成形术中分离出的二倍体细胞)和肿瘤细胞TMECS(21MT-2, 从胸膜渗出液中分离出的非整倍体细胞)的mDNA和cRNA经二轮杂交后, 筛选并鉴定了S100A2基因全长cDNA(当时命名为Clone19).
S100A2基因是S100基因家族成员之一, S100基因家族共有S100A1-S100A11、S100B、S100C、S100P等21个成员, 其编码的蛋白均为钙结合蛋白. 此蛋白由两个与钙离子有高亲和力的EF-手型结构组成. 现已发现, 某些肿瘤的发生、发展与钙离子密切相关[8], 还发现钙离子拮抗剂能够抑制肿瘤细胞的生长和转移. 钙离子依赖与钙结合蛋白结合, 从而发挥其信使作用. S100蛋白通过对钙离子的调节及与靶蛋白的相互作用, 在体内发挥多种生物学功能. 另有研究发现, S100家族中有15个成员其基因均定位于稳定性差的1号染色体长臂2区1带(1q21)[8], 该区易发生各种染色体质量排, 如杂合性缺失、易位、重叠等; 同时发现, 定位于1q21的15个S100家族成员、SPRR及其他一些基因共同构成了表皮分化复合体(EDC), 该复合体与上皮的分化及上皮源性肿瘤的发生发展关系密切; 且有多种S100蛋白在多种肿瘤中表达异常, 并与肿瘤的浸润、转移有关, 因此S100家族与肿瘤的发生发展关系密切. 目前已知的对肿瘤可能起促进作用的S100家族成员主要是S100A4、S100A6、S100A8、S100A9、S100B、S100P等, 可能起抑制作用的主要是S100A2等.
作为候选抑癌基因, 已有研究表明S100A2在许多恶性肿瘤中表达明显降低, 如乳腺癌[9]、黑色素瘤[10]、前列腺癌[11]、肺癌[12]和胃癌[4]等, 并可能与肿瘤的发生发展及预后[13]密切相关.
Ji et al[14]用半定量RT-PCR法检测62例食管鳞癌和正常食管黏膜组织中S100A2及其他15种S100家族成员的表达, 结果显示54.8%(34/62)的肿瘤组织S100A2表达比正常组织显著下调. 并显示S100A2的表达失调分别与S100A8、S100A14、S100P的失调显著相关.
我们首次采用原位分子杂交方法对食管癌和正常食管黏膜中S100A2 mRNA的表达进行了检测, 实验结果显示, S100A2 mRNA在食管癌组织中的阳性表达率(77.5%)显著低于正常食管黏膜(100%). 表明食管癌组织具有S100A2的低表达特性, 这与Ji et al的研究结果一致. 但本实验中S100A2 mRNA在食管癌组织中的阳性表达率(77.5%)高于Ji et al的研究结果(54.8%), 分析原因可能为: (1)肿瘤组织病例数不一致(40例和62例). (2)检测S100A2 mRNA的方法不同(原位杂交技术和半定量RT-PCR技术).
本实验进一步探讨了S100A2 mRNA的表达与食管癌临床病理因素之间的关系, 发现S100A2 mRNA在食管癌中的表达与患者性别、年龄、临床分期、肿瘤部位、肿瘤大小及浸润深度无关, 但与肿瘤分化程度及淋巴结转移显著相关, 发现在低分化组、有淋巴结转移组S100A2 mRNA表达较低. 提示S100A2基因在肿瘤细胞分化过程中可能起着重要的作用, 并可能作为判断食管癌生物学行为的重要参考指标. 我们由此推测S100A2可能是通过抑制肿瘤的转移从而发挥抑癌作用, 为S100A2对肿瘤抑制机制的研究提供线索.
Kyriazanos et al[15]利用免疫组化技术检测116例食管鳞癌标本中S100A2表达的临床意义. 结果显示S100A2阳性表达率为42.2%(49/116), 并且体积大、分化好的肿瘤阳性表达率显著高于其他肿瘤. T期相同时, 淋巴结阳性的肿瘤相对于阴性的肿瘤, S100A2蛋白低表达, 但只有在T1b期差别有显著性. 淋巴结阴性的病例中, S100A2成为独立的预后指标. 淋巴结阴性且不表达S100A2的食管鳞癌患者, 可能是低生存率的高风险群体, 有必要进一步采用适当的辅助治疗.
我们用免疫组化S-P法检测了40例食管癌和40例正常食管黏膜中S100A2蛋白的表达. 结果发现, 食管癌组S100A2蛋白表达阳性率(72.5%)明显低于正常食管黏膜组(100%), 表明在食管癌中存在S100A2蛋白表达的减少, 提示食管癌的发生可能与S100A2基因表达产物减少有关. 另外S100A2蛋白在不同分化程度食管癌中表达不同, 高、中分化癌组S100A2蛋白表达阳性率显著高于低分化癌组. 这表明S100A2蛋白表达的减少与食管癌分化程度有关, 这与Kyriazanos et al的实验结果一致. 本实验还发现有淋巴结转移组S100A2蛋白表达阳性率显著低于无淋巴结转移组, 说明S100A2蛋白表达与食管癌淋巴结转移有关. S100A2蛋白的表达与患者性别、年龄、临床分期、肿瘤部位、肿瘤大小及浸润深度均无关. 以上结果说明S100A2蛋白的低表达在食管癌的发生、发展及侵袭转移中具有重要作用. 本实验结果可能为食管癌的基因诊断和基因治疗提供一个新的理论依据.
本研究显示S100A2 mRNA与S100A2蛋白在食管癌中的表达均降低, 呈正相关, 提示S100A2蛋白表达的调控主要在转录水平, S100A2通过降低转录活性, 促进蛋白质表达水平的下调. 我们另外发现, S100A2 mRNA与S100A2蛋白在食管癌中的表达同临床病理特征之间的关系比较: S100A2 mRNA和蛋白表达与患者性别、年龄、临床分期、肿瘤部位、肿瘤大小及浸润深度均无关, 均与肿瘤分化程度及淋巴结转移显著相关, 两者观察结果一致.
本实验结果显示食管癌组织中S100A2 mRNA、S100A2蛋白的表达下调, 并与肿瘤分化程度及淋巴结转移有关, 提示他们在食管癌的发生发展中具有重要作用, 并可能作为判断食管癌生物学行为的重要参考指标. 食管癌组织中S100A2 mRNA、S100A2蛋白的表达呈正相关, 提示S100A2蛋白表达的调控主要在转录水平, S100A2蛋白表达水平的降低主要是相应转录水平下调的结果.
目前尚未找到食管癌的特异性肿瘤标志, 尚无任何一种分子生物学指标可作为食管癌筛查、早期诊断和预后的指标. 作为候选抑癌基因, S100A2与肿瘤发生发展之间的关系已逐渐引起人们的关注, 而S100A2在食管癌发生发展中所起到的作用, 及与生物学行为之间的关系, 人们尚知之甚少.
施瑞华, 教授, 南京医科大学第一附属医院消化科; 刘占举, 教授, 郑州大学第二附属医院 消化内科
S100A2在许多恶性肿瘤中的表达情况已引起人们的关注, 已有文献显示其在乳腺癌、黑色素瘤、前列腺癌、肺癌、胃癌等组织中均表达明显降低或缺失, 因此被看作是候选抑癌基因. 但具体机制目前尚不清楚, 亟待更深入的研究.
本文首次利用原位杂交技术在食管鳞癌和相应正常食管黏膜中检测S100A2基因的表达情况, 同时利用免疫组化方法检测S100A2蛋白的表达情况. 从而在基因和蛋白水平上探讨S100A2与食管癌的发生发展及各项临床病理参数之间的关系, 为S100A2作为判断食管癌生物学行为的重要参考指标提供理论依据.
本文同时在基因和蛋白水平上探讨S100A2与食管癌的发生发展及各项临床病理参数之间的关系, 为S100A2作为判断食管癌生物学行为的重要参考指标提供理论依据. 以期为食管癌早期诊断、早期治疗和判断预后提供新的参考指标.
S100A2: 基因全长为8670 bp, 定位于人染色体1q21的250-300 kb之间. 1991年由Lee et al利用抑制性消减杂交技术筛选并鉴定了S100A2基因全长cDNA. 其编码的蛋白质为97个氨基酸所组成的一个钙结合蛋白. 在许多恶性肿瘤中均表达明显降低或缺失, 被看作候选抑癌基因.
本研究设计合理, 结论可靠, 无伦理问题, 具有一定的科学性和参考价值.
编辑: 李军亮 电编:何基才
| 1. | Engelkamp D, Schäfer BW, Mattei MG, Erne P, Heizmann CW. Six S100 genes are clustered on human chromosome 1q21: identification of two genes coding for the two previously unreported calcium-binding proteins S100D and S100E. Proc Natl Acad Sci U S A. 1993;90:6547-6551. [PubMed] [DOI] |
| 2. | Nakayama S, Kretsinger RH. Evolution of the EF-hand family of proteins. Annu Rev Biophys Biomol Struct. 1994;23:473-507. [PubMed] [DOI] |
| 3. | Wicki R, Franz C, Scholl FA, Heizmann CW, Schäfer BW. Repression of the candidate tumor suppressor gene S100A2 in breast cancer is mediated by site-specific hypermethylation. Cell Calcium. 1997;22:243-254. [PubMed] [DOI] |
| 4. | 刘 迎福, 贺 修胜, 徐 刚, 邓 敏, 曾 超, 赵 帅. S100A2蛋白表达与胃癌分化程度的关系研究. 南华大学学报(医学版). 2005;33:1-12. |
| 5. | Tsai ST, Jin YT, Tsai WC, Wang ST, Lin YC, Chang MT, Wu LW. S100A2, a potential marker for early recurrence in early-stage oral cancer. Oral Oncol. 2005;41:349-357. [PubMed] [DOI] |
| 6. | 王 玉萍, 楚 天骄, 岳 秀云, 雷 冬梅, 党 秋红, 郝 志伟, 张 曦. S100A2、S100A4、ER和PR在子宫肉瘤中的表达及其相关性研究. 中国妇幼保健. 2006;21:535-537. |
| 7. | Lee SW, Tomasetto C, Sager R. Positive selection of candidate tumor-suppressor genes by subtractive hybridization. Proc Natl Acad Sci U S A. 1991;88:2825-2829. [PubMed] [DOI] |
| 8. | Donato R. S100: a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles. Int J Biochem Cell Biol. 2001;33:637-668. [PubMed] [DOI] |
| 9. | Liu D, Rudland PS, Sibson DR, Platt-Higgins A, Barraclough R. Expression of calcium-binding protein S100A2 in breast lesions. Br J Cancer. 2000;83:1473-1479. [PubMed] [DOI] |
| 10. | Maelandsmo GM, Flørenes VA, Mellingsaeter T, Hovig E, Kerbel RS, Fodstad O. Differential expression patterns of S100A2, S100A4 and S100A6 during progression of human malignant melanoma. Int J Cancer. 1997;74:464-469. [PubMed] [DOI] |
| 11. | Gupta S, Hussain T, MacLennan GT, Fu P, Patel J, Mukhtar H. Differential expression of S100A2 and S100A4 during progression of human prostate adenocarcinoma. J Clin Oncol. 2003;21:106-112. [PubMed] [DOI] |
| 12. | Matsubara D, Niki T, Ishikawa S, Goto A, Ohara E, Yokomizo T, Heizmann CW, Aburatani H, Moriyama S, Moriyama H. Differential expression of S100A2 and S100A4 in lung adenocarcinomas: clinicopathological significance, relationship to p53 and identification of their target genes. Cancer Sci. 2005;96:844-857. [PubMed] [DOI] |
| 13. | Lauriola L, Michetti F, Maggiano N, Galli J, Cadoni G, Schäfer BW, Heizmann CW, Ranelletti FO. Prognostic significance of the Ca(2+) binding protein S100A2 in laryngeal squamous-cell carcinoma. Int J Cancer. 2000;89:345-349. [PubMed] [DOI] |
| 14. | Ji J, Zhao L, Wang X, Zhou C, Ding F, Su L, Zhang C, Mao X, Wu M, Liu Z. Differential expression of S100 gene family in human esophageal squamous cell carcinoma. J Cancer Res Clin Oncol. 2004;130:480-486. [PubMed] [DOI] |