修回日期: 2008-03-27
接受日期: 2008-04-04
在线出版日期: 2008-07-08
目的: 研究内脏高敏感大鼠的脊髓、脑部CRF的分布和表达, 探讨CRF在肠易激综合征(IBS)内脏高敏感信号传导通路中的机制, 以及肠炎宁糖浆对IBS起效的可能作用机制.
方法: 清洁级成年♀SD大鼠40只, 随机分3组, 空白组(n = 8), 模型一组(腹腔注射鸡卵清蛋白致敏, n = 16), 模型二组(条件刺激和非条件刺激轮替致敏, n = 16), 评估肠道敏感性后, 模型一组和模型二组均随机分成2组, 即对照组和肠炎宁组, 每组8只. 空白组和对照组给予生理盐水, 肠炎宁组给予肠炎宁, ig 4 wk, 取脑、脊髓进行免疫组化, 观察CRF的分布和表达
情况.
结果: 肠炎宁组内脏敏感性较模型组明显降低(P<0.01). 免疫组化显示大鼠下丘脑、第三脑室下侧、脊髓腰膨大部可见CRF的明显表达, CRF阳性指数模型一对照组和模型二对照组均高于空白对照组, 差异有统计学意义(下丘脑: 0.037±0.009, 0.037±0.024 vs 0.005±0.001; 第三脑室下侧: 0.038±0.009, 0.040±0.022 vs 0.005±0.001; 脊髓: 0.028+0.008, 0.024±0.004 vs 0.002±0.001; 均P<0.01). 模型一肠炎宁组(0.012±0.005, 0.012±0.005, 0.010±0.003)较模型一对照组高, 模型二肠炎宁组(0.009±0.005, 0.011±0.006, 0.012±0.005)较模型二对照组高, 模型一肠炎宁组和模型二肠炎宁组较空白对照组高, 差异均有统计学意义(P<0.05).
结论: CRF在内脏刺激信号的传入过程中起重要作用, 肠炎宁可以降低其表达程度, 这可能是降低大鼠内脏高敏感的机制之一.
引文著录: 晁冠群, 吕宾, 孟立娜, 张烁, 张璐, 郭赟. 肠炎宁糖浆对内脏高敏感大鼠脑、脊髓CRF表达的影响. 世界华人消化杂志 2008; 16(19): 2112-2118
Revised: March 27, 2008
Accepted: April 4, 2008
Published online: July 8, 2008
AIM: To investigate the distribution and expression of corticotropin releasing factor in spinal cord and brain of rats with visceral hypersensitivity, and to explore the mechnism of Changyanning Tangjiang treating irritable bowel syndrome.
METHODS: Forty female SD rats were divided randomly into 3 groups: blank control group (n = 8), model 1 group (n = 16, sensitized with intra-peritoneal injection of chicken ovalbumin) and model 2 group (n = 16, sensitized in turn with conditional stimulation and non-conditional stimulation). After the intestinal hypersensitivity was evaluated, the rats in the two model groups were divided into 2 subgroups: model control group (n = 8) and Changyanning group (n = 8). The rats in the blank control group and model group were treated with normal saline, and those in Changyanning group were intragastrically treated with Changyanning Tangjiang for 4 wk. Then spinal cord and brain were collected for immunohistochemical staining, and the distribution and expression of CRF were observed.
RESULTS: The visceral sensitivity of rats in the Changyanning groups was lower than that in the model groups (P < 0.01). Immunohistochemistry showed that CRF was obviously expressed in the lumbar intumescentia of spinal cord, hypothalamus and diaphragmatic surface of the third ventricle of cerebrum. The positive indexes in the model control groups were higher than those in the blank control group (hypothalamus: 0.037 ± 0.009, 0.037 ± 0.024 vs 0.005 ± 0.001; diaphragmatic surface: 0.038 ± 0.009, 0.040 ± 0.022 vs 0.005 ± 0.001; spinal cord: 0.028 ± 0.008, 0.024 ± 0.004 vs 0.002 ± 0.001; all P < 0.01). The positive indexes in the Changyanning groups (hypothalamus: 0.012 ± 0.005, 0.009 ± 0.005; diaphragmatic surface: 0.012 ± 0.005, 0.011 ± 0.006; spinal cord: 0.010 ± 0.003, 0.012 ± 0.005) were lower than that in the model groups. The positive index of CRF was also higher in the Changyanning groups than that in the blank control group (P < 0.05).
CONCLUSION: CRF plays an important role in the introduction of stimulation signal, while Changyanning Tangjiang can down-regulating the expression of CRF, which may be one of the mechnisms of Changyanning decreasing the visceral hypersensitivity in rats.
- Citation: Chao GQ, Lv B, Meng LN, Zhang S, Zhang L, Guo Y. Effect of Changyanning Tangjiang on the expression of corticotropin releasing factor in spinal cord and brain of rats with visceral hypersensitivity. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2112-2118
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2112.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2112
肠易激综合征(irritable bowel syndrome, IBS)是以大便习惯改变为主要特征的一种常见胃肠功能紊乱性疾患. 其病因复杂, 据文献报道, 欧美等发达国家患病率达9%-22%[1], 我国城市居民患病率为10.50%, 乡村为6.14%. 该病进入成年后发病率上升, 在30-40岁达到高峰, 女性发病率明显高于男性, 比率为2:1[2]. 发病机制亦不十分明确, 目前认为可能与脑肠轴作用、免疫异常、胃肠激素与神经肽作用、肠道动力学异常、性激素水平变化[3]有关. 越来越多的证据表明IBS患者存在内脏高敏感状态[4-9]. 内脏高敏感性可以被认为是IBS的一个生物学指标[10]. 国内外较一致的观点认为, IBS是在特殊的基质基础上, 以精神、免疫、内分泌系统为中介, 以社会心理因素刺激为扳机而触发的心身疾病, 被公认为了解地最差的疾病之一. 我们建立直肠刺激联合心理应激、免疫引起的IBS内脏高敏感大鼠模型, 应用免疫组化染色技术观察不同刺激诱导的内脏高敏感大鼠的脊髓、脑部CRF的分布和表达, 寻找IBS内脏感觉传导异常的客观依据, 从而初步探讨IBS内脏高敏感的机制. 并应用肠炎宁糖浆干预, 探讨其对内脏高敏感大鼠的作用及机制.
成年♀SD大鼠40只, 体质量约200 g, 清洁级(由浙江中医药大学实验动物中心提供), 随机分3组, 空白对照组(A组)8只, 模型一组16只, 模型二组16只, 放置于室温22-24℃、湿度<60%、噪音<50 db的环境中, 分笼饲养, 正常饮水摄食.
将鸡卵清蛋白(购自Sigma公司)30 mg加入浓度为10 g/L氢氧化铝凝胶1 mL中, 充分混匀, 注入模型组大鼠腹腔, 制备内脏高敏感大鼠模型. 空白对照组给予1 mL生理盐水ip对照. 正常进食饮水2 wk后, 观察大鼠情况, 进行直肠注水扩张试验评估肠道敏感性. 采用樟脑丸特殊气味作条件刺激, 结直肠扩张压力>60 mmHg(1 mmHg = 0.133 kPa)的刺激结合经典的肢体束缚作为非条件刺激, 建立动物模型. 大鼠装入放有樟脑丸的应激笼, 用胶布固定四肢和躯干45 min, 限制自由运动, 但可作少许前后活动和回头. 其间将不漏气的气囊扩张导管经肛门插入直肠, 气囊远端距肛门口1 cm, 并固定于鼠尾根部, 每次充气量1.6 mL(气囊内压力>60 mmHg), 持续60 s, 间断放空气囊3 min后重复充气10次, 完成1次应激程序. 条件应激组第1天完成1次应激程序后放回原饲养环境, 第2天同一时间给予同样的应激; 第4天只给予条件刺激45 min; 第5天重复第1天的应激程序, 第6天重复第4天应激程序, 第8天给予条件应激45 min. 完成后进行直肠注水扩张试验评估肠道敏感性. ig给药: 验证模型后2 d进行ig给药, 将两种模型组分别随机分为2组, 分别为模型一对照组(B组)、模型一治疗组(C组)和模型二对照组(D组)、模型二治疗组(E组), 每组各8只. 肠炎宁糖浆(康恩贝集团生产)成人一日量为40 mL, 大鼠(200 g)与人(70 kg)比较, 折算系数是0.018, 按照体质量给药, 肠炎宁糖浆剂量为3.6 mL/(kg·d), 空白对照组及模型对照组给予生理盐水3.6 mL/(kg·d).
1.2.1 模型验证: 内脏敏感性评估采用国际通用的AWR(腹壁撤离反射)评分标准, 即大鼠的腹部收缩反射. 大鼠腹部收缩反射(AWR)评分标准: 0分: 大鼠对结肠扩张无行为学反应; 1分: 结肠扩张时身体静止不动, 头部运动减少; 2分: 结肠扩张时腹肌收缩, 但腹部未抬离桌面; 3分: 结肠扩张时腹肌收缩并抬离桌面; 4分: 结肠扩张时骨盆抬起, 身体呈弓形. 内脏敏感性评估具体操作: 将石蜡油润滑后的8F导尿管经肛门插入, 将球囊末端放在距离肛门1.0 cm左右, 用棉线把导尿管和大鼠尾巴根部固定. 将其放在平台上, 待大鼠适应环境后, 逐渐注水使球囊扩张, 观察大鼠腹部抬起并且背部拱起时(AWR评分3分)所需的注水量. 每次直肠扩张持续30 s, 重复进行3次, 数据取均值.
1.2.2 标本的获取: 在戊巴比妥钠50 mg/kg ip麻醉下, 开胸, 暴露心脏, 从左心室插管至升主动脉, 经升主动脉用500 mL生理盐水灌流冲洗血液, 并剪开右心耳, 至肝脏完全变白, 从右心耳流出无色的冲洗液后, 再用新鲜配置的固定液(含40 g/L多聚甲醛的0.1 mol/L磷酸缓冲液)500 mL灌流, 至四肢、脊柱变硬(时间约40 min), 立即取脑、脊髓背段, 放入福尔马林中固定. 脱水, 包埋, 制腊块保存, 切片制片.
1.2.3 免疫组化: (1)常规脱腊水化: 将石蜡切片浸于二甲苯中5 min, 3次. 取出切片置于1000 mL/L乙醇中3 min 2次; 依次置入900 mL/L-700 mL/L各级酒精各3 min, 取出置于蒸馏水中. (2)二步法: 取出蒸馏水中的切片, 甩掉并擦干切片上组织周围的液体, 平放于湿盒中, 滴加30 mL/L过氧化氢于组织上避光孵育15 min. 蒸馏水冲洗, 再将切片置入PBS缓冲液中, 浸泡5 min, 3次. 取出切片, 甩掉并擦干组织周围的液体(组织切勿干燥), 平放于湿盒中. 抗原修复, 将切片放入盛有枸橼酸盐缓冲液(工作液)的切片盒, 置微波炉内80%火力加热, 使切片盒内液体温度保持在92-98℃之间并持续10-15 min. 完成后置室温冷却. 滴加50-100 mL一抗工作液于组织上, 室温孵育30 min. 用TBS或PBS冲洗切片. 将切片置入PBS缓冲液中, 浸泡5 min, 3次, 取出切片, 甩掉并擦干组织周围的液体, 平放于湿盒中. 滴加适当比例稀释的生物素标记二抗(10 g/L BSA-PBS稀释), 室温孵育30 min. 用PBS冲洗切片. 将切片置入PBS缓冲液中, 浸泡5 min, 3次, 取出切片, 甩掉并擦干组织周围的液体, 平放于湿盒中. 滴加预备好的显色剂DAB工作液50-100 μL, 室温孵育5-20 min, 显色完全后, 用蒸馏水冲洗终止显色. 苏木精复染. 850、900、950、1000、1000和1000 mL/L酒精上行逐级脱水, 每级3 min. 取出切片置入二甲苯5 min, 3次. 用封片胶封片. 阴性对照用PBS代替一抗, 进行空白对照, 同步进行上述免疫组化染色, 结果为阴性. (3)结果分析方法: 每张切片所要分析的部位显微镜下拍摄3-5张照片, 进行图象分析. 本研究运用计算机图像分软件(carl zeiss imaging systems, Carl Zeiss公司)分析免疫组化图像, 系统在40倍物镜下采集图像, 每张切片中选取有代表性的区域, 连续摄10个高倍(×400倍)视野, 分别对免疫组化切片中染色胞质中的阳性表达进行定量分析, 计算每视野阳性染色的吸光度以及总吸光度.
统计学处理 各组数据结果以mean±SD表示. 统计用SPSS软件包, 两样本均数比较用t检验, 显著性水准为P<0.05.
内脏高敏感模型完成后仔细观察大鼠的各方面情况, 日常行为无很大变化, 进食饮水如常, 当受惊吓或给予ig时, 造模组表现过度反应, 情绪激动甚至反抗和攻击, 其中以直肠刺激模型组更为明显. 从大便性状来看, 各组之间没有明显的差异.
首次评估各组大鼠肠道敏感性, 大鼠腹部撤离反射为3分时所需的注水量, 模型组明显低于对照组, 差异有统计学意义(P<0.01), 提示模型组大鼠内脏敏感性较对照组明显增高. 而ip白蛋白模型组与直肠刺激条件刺激模型组差异无统计学意义, 提示两种造模方法均能引起内脏高敏感, 但两者无敏感性高低差异(表1). 经用药4 wk后, 再次评估各组大鼠的肠道敏感性, 对照组仍明显高于模型组, 差异有统计学意义(P<0.01); ig 4 wk后AWR = 3分时直肠注水量A、B、C、D和E组分别为1.35±0.08、0.88±0.18、1.28±0.12、0.79±0.12和1.30±0.08 mL. 经过肠炎宁糖浆ig治疗后, 其注水量较模型对照组有明显增加, 差异有统计学意义(P<0.01). 而其余各组间比较均无统计学差异.
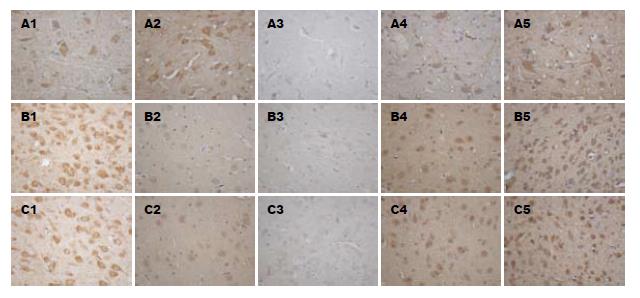
用DAB显色的免疫组化切片阳性区域呈棕黄色. 分别取脑, 脊髓免疫组化切片, 镜下阳性区域表达明显部位分别为下丘脑、第三脑室下侧以及脊髓腰膨大部, 其余部位表达微弱. 典型的CRF阳性神经元表现为胞质染色呈棕黄色, 胞核不着色, 不同部位的CRF阳性神经元其形态表现多样, 如梭形、椭圆形、多角形等. 镜下下丘脑及第三脑室下侧CRF阳性神经元分布较为密集, 分布均匀, 胞质染色呈棕黄色颗粒样, 胞核不着色, 部分呈空泡状, 形状多为圆形、梭形、椭圆形等; 脊髓腰膨大段切片染色可见CRF阳性神经元分布较脑稀疏, 分布不均匀, 胞质染色呈棕黄色颗粒样, 胞核不着色, 镜下以梭形较为多见, 也可见多角形, 未见圆形及椭圆形, 阳性神经元在相同倍数光镜下体积较脑片神经元大(图1).
实验结果主要通过阳性区域面积, 总吸光度以及阳性指数进行比较. 阳性区域面积为图像分析所得的面积, 通过仪器可以测出图像分析的平均吸光度, 反映表达部位的阳性强度. 一张照片的IA(总吸光度)表示照片内所有阳性表达部位的Area(阳性表达部位)×Density(该部位的平均吸光度)的和. 阳性指数表示总吸光度均分到该照片的值, 即所拍摄照片的黄度, 值越大, 照片越黄, 以此评价照片所对应的组织的阳性程度. 在下丘脑空白对照组阳性区域不明显, CRF阳性神经元稀少, 而造模组阳性区域染色较深, 神经元密集, 药物治疗组阳性神经元数目减少, 但是阳性区域染色深度没有改变. 经过统计分析, 下丘脑、第三脑室下侧和脊髓, B组及D组阳性面积、总吸光度及阳性指数均高于A组, 差异有统计学意义(P<0.01). C组阳性面积、总吸光度及阳性指数较B组高, 差异有统计学意义(P<0.01). E组阳性面积、总吸光度及阳性指数较D组高, 差异有统计学意义(P<0.01). C组及E组阳性程度较A组高, 差异有统计学意义(P<0.05). B组与D组无统计学差异(表2-4).
IBS是多种因素引起的疾病, 据文献报道, 欧美等发达国家患病率达9%-22%[1]. 美国的调查显示每年约有300万次的IBS患者就诊, 相应的处方达220万张, 每年约有96 000名1BS患者住院治疗; IBS患者分别占初级医疗和消化专科门诊就诊人数的12%和28%, 每年耗去的医疗资源约80亿美元[11]. 中国的总体资料不详, 而香港、北京、广东地区的发病率分别为6.6%(RomaⅡ)[12]、7.26%(Manning)和11.5%(Manning)[13]. 现有对其发病原因及发病机制的不同观点, 包括肠道动力和肠道平滑肌功能障碍、内脏感觉异常、脑-肠轴学说、精神心理因素、消化道激素及全肠道感染等. 近年来, 许多研究表明IBS与内脏的高敏感性异常现象有关[14]. 自1973年Ritchie报导IBS患者结肠气囊扩张疼痛阈值下降以来, 内脏高敏感机制备受关注. 内脏高敏感的可能机制包括以下几个方面: (1)肠道感觉的异常, 如IBS患者对机械刺激有高敏感. (2)内脏感觉神经传导通路异常, 如IBS患者内脏感觉的超敏反应已被感觉刺激的评估所证实, 他能反映感觉神经通路和认识过程的异常[15]. (3)免疫炎症和肠神经系统的联系, Barbara et al[16]发现IBS患者结肠黏膜内T淋巴细胞增多, 认为这些免疫细胞和肠神经系统的轴突纤维在解剖学上有着密切的联系. (4)高级中枢参与内脏高敏感的形成, Accarino et al[17]报道, 在直肠扩张前或当时给予心理压力(听力分散)会增加直肠对扩张的敏感性.
促肾上腺皮质激素释放因子(corticotropin releasing factor, CRF)的主要作用为促进腺垂体合成与释放促肾上腺皮质激素(adrenocor-tieotropic hormone, ACTH). CRF是一种重要的神经内分泌肽[18-19], 主要分布在中枢神经系统中与应激相关的重要区域, 作为应激反应中的关键调节因子, 通过其受体产生一系列生物学效应, 调动机体各系统以应答应激刺激, 调节内分泌、自主神经、免疫和行为反应[20]. CRF及CRF相关肽都能引起与应激状态下相似的胃肠蠕动改变[21]. 有实验表明, 向应激大鼠脑室内或外周静脉注射CRF均可对结肠产生刺激作用, 使结肠的传输运动加速并促进粪便的排出[22]. 所以, 中枢注射CRF已经成功地模拟了应激情况下的动物胃肠道动力的改变, 这都说明CRF在介导应激引起的胃肠道动力改变的重要作用, 他能引起急性应激引起的相似的结肠改变. 应激通过CRF和肥大细胞影响脑-肠轴环路功能而导致胃肠功能紊乱[23], Williams et al[24]据此建立了应激诱导的IBS模型. 国外文献也有报道, 正常人群静脉给予选择性CRF1受体激动剂可模拟应激引起的内脏反应[25]. 选择性CRF1受体激动剂降低了结肠刺激引起的痛阈, 增强了结肠运动[26-27]. 有研究显示, 外周注射CRF提高人对结肠气囊扩张的敏感性, 类似于IBS的内脏高敏感. 最近有学者报道应用非选择性CRF受体拮抗剂可改善IBS患者对直肠电刺激引起的结肠动力改变和疼痛反应[28]. 另外, CRFR1信号途径与应激相关的结肠功能改变和内脏高敏性相关. 近年研究表明, IBS患者57%其结肠呈高敏感性, 本实验通过条件刺激与非条件刺激结合以及ip白蛋白建立内脏高敏感动物模型, 探讨CRF在内脏高敏感大鼠传导通路中的表达.
我们发现CRF在空白对照组大鼠脑、脊髓中表达微弱, 而在内脏高敏感大鼠模型中有较高的表达, 其阳性指数明显高于空白对照组. 脑片中我们发现, CRF阳性表达区域以下丘脑最为广泛, 第三脑室下侧也有较高程度的表达, 而脊髓片中, 阳性神经元也有显著表达, 但其CRF阳性神经元分布较脑片稀疏, 阳性表达面积与脑片相比有所减少. 由此可以证明, 内脏高敏感传导通路中CRF也可能存在关键的作用, IBS患者的脑-肠轴可能对CRF反应过度, 下丘脑是CRF促进结肠运动的作用点, 而不同部位的CRF对结肠的作用力存在差异. 因此可以推测下丘脑CRF的释放可以影响结肠的运动, 高敏感的结肠感觉感受器兴奋异常可引起下丘脑以及其相关区域的CRF神经兴奋, 从而引起结肠的高运动以及腺体的分泌, 由此可以解释IBS与CRF的相关性. 我们可以设想, 通过对下丘脑以及相关区域的CRF释放的调节, 可以改善IBS患者症状.
肠炎宁糖浆是根据民间验方, 精选数味良药(黄毛耳草、地锦草、香薷、樟树根和枫树叶)研制而成的纯中药糖浆制剂, 具有清热、利湿和行气的作用. 药理上对小肠平滑肌有很好的松弛作用, 减弱小肠推进运动, 另外具有解毒、杀菌和镇痛作用. 对IBS及急慢性胃肠炎引起的腹泻、腹痛及细菌性痢疾、小儿消化不良等症疗效显著. 我们前期实验也表明肠炎宁糖浆可以用于治疗IBS, 可以降低高级神经中枢信息上行传导通路上CGRP、c-fos的过度表达, 进而降低内脏敏感性, 其作用机制可能是改变了脊髓背角神经元上送的刺激信号, 抑制信息的上行传导, 提高对疼痛等刺激的感觉阈值, 从而降低内脏敏感性.
我们发现经过肠炎宁糖浆治疗4 wk后, 内脏高敏感模型组CRF阳性指数明显低于模型对照组, 但仍高于空白对照组, 镜下发现肠炎宁治疗组CRF阳性表达面积较治疗前有明显减少, 但对于单个神经元, 其表达强度与治疗前无明显差异. 由此可见, 肠炎宁可以有效减少CRF的释放, 但不能在短期内达到与正常组相同的CRF释放水平, 因此, 在短期治疗后, 仍可存在部分临床症状. 我们的实验表明, 肠炎宁糖浆可以降低高级神经中枢信息上行传导通路上CRF的过度表达, 从而降低内脏敏感性, 其可能机制为肠炎宁糖浆改变了结肠感觉感受器的兴奋性, 从而减少了下丘脑以及相关区域的CRF神经元的兴奋, CRF释放减少, 影响了结肠的运动以及腺体的分泌, 从而降低内脏敏感性, 改善患者的症状.
通过实验我们认为, CRF可以作为研究内脏高敏感传导系统的一个关键因子. 两种模型成功建立内脏高敏感状态, 且可以相似水平的激发CRF的表达增高, 而治疗后CRF明显降低, 因此, 在今后的治疗中, CRF可以作为治疗IBS一个新的研究靶点, 同时也可用于评价治疗效果.
肠易激综合征是以大便习惯改变为主要特征的一种常见胃肠功能紊乱性疾患, 其病因复杂, 发病机制亦不十分明确, 目前认为可能与脑肠轴作用、免疫异常、胃肠激素与神经肽作用、肠道动力学异常、性激素水平变化有关. 越来越多的证据表明IBS患者存在内脏高敏感状态. 内脏高敏感性被认为是IBS的一个生物学指标.
徐列明, 教授, 上海中医药大学附属曙光医院(东部)肝二科
自1973年Ritchie报导IBS患者结肠气囊扩张疼痛阈值下降以来, 内脏高敏感机制备受关注.
据文献报道, 欧美等发达国家患病率达9%-22%. 美国的调查显示每年约有300万次的IBS患者就诊, 相应的处方达220万张, 每年约有96 000名1BS患者住院治疗; 中国的总体资料不详, 而香港、北京、广东地区的发病率分别为6.6%(RomaⅡ)、7.26%(Manning)和11.5%(Man-ning).
本文主要研究内脏高敏感大鼠大脑和脊髓CRF的表达的改变, 验证了无论是外界应激还是通过免疫引起的内脏高敏感都需要通过CRF这一条途径来实现, 并且证实了肠炎宁糖浆在治疗IBS中的作用和机制.
目前, 在国内对内脏高敏感大鼠CRF的报道较少, 本研究有助于IBS新型药物的开发.
本文总体质量较好, 研究设计较科学合理, 写作流畅, 具有较好的学术价值.
编辑: 师忠芳 电编:郭海丽
| 4. | Rossel P, Drewes AM, Petersen P, Nielsen J, Arendt-Nielsen L. Pain produced by electric stimulation of the rectum in patients with irritable bowel syndrome: further evidence of visceral hyperalgesia. Scand J Gastroenterol. 1999;34:1001-1006. [PubMed] [DOI] |
| 6. | Verne GN, Price DD. Irritable bowel syndrome as a common precipitant of central sensitization. Curr Rheumatol Rep. 2002;4:322-328. [PubMed] [DOI] |
| 7. | Sarkar S, Hobson AR, Furlong PL, Woolf CJ, Thompson DG, Aziz Q. Central neural mechanisms mediating human visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 2001;281:G1196-G1202. [PubMed] |
| 8. | Drewes AM, Petersen P, Rossel P, Gao C, Hansen JB, Arendt-Nielsen L. Sensitivity and distensibility of the rectum and sigmoid colon in patients with irritable bowel syndrome. Scand J Gastroenterol. 2001;36:827-832. [PubMed] [DOI] |
| 9. | Bouin M, Plourde V, Boivin M, Riberdy M, Lupien F, Laganiore M, Verrier P, Poitras P. Rectal distention testing in patients with irritable bowel syndrome: sensitivity, specificity, and predictive values of pain sensory thresholds. Gastroenterology. 2002;122:1771-1777. [PubMed] [DOI] |
| 10. | Mayer EA, Naliboff BD, Chang L, Coutinho SV. V. Stress and irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 2001;280:G519-G524. [PubMed] |
| 11. | American Gastroenterological Association medical position statement: irritable bowel syndrome. Gastroenterology. 1997;112:2118-2119. [PubMed] [DOI] |
| 12. | Kwan AC, Hu WH, Chan YK, Yeung YW, Lai TS, Yuen H. Prevalence of irritable bowel syndrome in Hong Kong. J Gastroenterol Hepatol. 2002;17:1180-1186. [PubMed] [DOI] |
| 13. | Xiong LS, Chen MH, Chen HX, Xu AG, Wang WA, Hu PJ. A population-based epidemiologic study of irritable bowel syndrome in Guangdong province. Zhonghua Yixue Zazhi. 2004;84:278-281. [PubMed] |
| 14. | Dunlop SP, Spiller RC. Nutritional issues in irritable bowel syndrome. Curr Opin Clin Nutr Metab Care. 2001;4:537-540. [PubMed] [DOI] |
| 15. | Lawal A, Kern M, Sidhu H, Hofmann C, Shaker R. Novel evidence for hypersensitivity of visceral sensory neural circuitry in irritable bowel syndrome patients. Gastroenterology. 2006;130:26-33. [PubMed] [DOI] |
| 16. | Barbara G, Stanghellini V, Berti-Ceroni C, De Giorgio R, Salvioli B, Corradi F, Cremon C, Corinaldesi R. Role of antibiotic therapy on long-term germ excretion in faeces and digestive symptoms after Salmonella infection. Aliment Pharmacol Ther. 2000;14:1127-1131. [PubMed] [DOI] |
| 17. | Accarino AM, Azpiroz F, Malagelada JR. Attention and distraction: effects on gut perception. Gastroenterology. 1997;113:415-422. [PubMed] [DOI] |
| 18. | Bittencourt JC, Sawchenko PE. Do centrally administered neuropeptides access cognate receptors?: an analysis in the central corticotropin-releasing factor system. J Neurosci. 2000;20:1142-1156. [PubMed] |
| 20. | Bakshi VP, Kalin NH. Corticotropin-releasing hormone and animal models of anxiety: gene-environment interactions. Biol Psychiatry. 2000;48:1175-1198. [PubMed] [DOI] |
| 21. | Heinrichs SC, Tache Y. Therapeutic potential of CRF receptor antagonists: a gut-brain perspective. Expert Opin Investig Drugs. 2001;10:647-659. [PubMed] [DOI] |
| 22. | Monnikes H, Raybould HE, Schmidt B, Tache Y. CRF in the paraventricular nucleus of the hypothalamus stimulates colonic motor activity in fasted rats. Peptides. 1993;14:743-747. [PubMed] [DOI] |
| 23. | Castagliuolo I, Lamont JT, Qiu B, Fleming SM, Bhaskar KR, Nikulasson ST, Kornetsky C, Pothoulakis C. Acute stress causes mucin release from rat colon: role of corticotropin releasing factor and mast cells. Am J Physiol. 1996;271:G884-G892. [PubMed] |
| 24. | Williams CL, Villar RG, Peterson JM, Burks TF. Stress-induced changes in intestinal transit in the rat: a model for irritable bowel syndrome. Gastroenterology. 1988;94:611-621. [PubMed] |
| 25. | Tache Y, Martinez V, Wang L, Million M. CRF1 receptor signaling pathways are involved in stress-related alterations of colonic function and viscerosensitivity: implications for irritable bowel syndrome. Br J Pharmacol. 2004;141:1321-1330. [PubMed] [DOI] |
| 26. | Lembo T, Plourde V, Shui Z, Fullerton S, Mertz H, Tache Y, Sytnik B, Munakata J, Mayer E. Effects of the corticotropin-releasing factor (CRF) on rectal afferent nerves in humans. Neurogastroenterol Motil. 1996;8:9-18. [PubMed] |