修回日期: 2008-04-25
接受日期: 2008-05-05
在线出版日期: 2008-07-08
目的: 研究小檗碱对3T3-L1胰岛素抵抗细胞模型PI-3K p85蛋白表达的影响, 探讨小檗碱改善胰岛素抵抗的分子机制.
方法: 分别以0.5 mmol/L软脂酸与25 mmol/L葡萄糖加0.6 nmmol/L胰岛素诱导3T3-L1脂肪细胞产生胰岛素抵抗, 予以小檗碱进行干预, 同时以阿司匹林作为阳性对照, 以2-脱氧-[3H]-D-葡萄糖摄入法观察葡萄糖的转运率, 用Western blot检测PI-3K p85蛋白的表达.
结果: 0.5 mmol/L软脂酸作用24 h或25 mmol/L葡萄糖加0.6 nmmol/L胰岛素作用18 h分别使3T3-L1脂肪细胞胰岛素刺激的葡萄糖转运抑制67%和60%, Western blot显示PI-3K p85蛋白表达减少, 与正常对照组比较有统计学意义(P<0.01); 同时加入小檗碱则可逆转上述效应使PI-3K p85蛋白表达增加, 与模型组比较有明显差异(P<0.01), 并且PI-3K p85蛋白的表达与小檗碱的剂量和作用时间呈依赖关系.
结论: 小檗碱可以明显改善游离脂肪酸和高糖诱导的胰岛素抵抗, 其分子机制可能与小檗碱提高PI-3K p85蛋白的表达有关.
引文著录: 易屏, 陆付耳, 陈广, 徐丽君, 董慧, 王开富. 小檗碱对3T3-L1胰岛素抵抗细胞模型PI-3K p85蛋白表达的影响. 世界华人消化杂志 2008; 16(19): 2102-2106
Revised: April 25, 2008
Accepted: May 5, 2008
Published online: July 8, 2008
AIM: To investigate the effects of berberine on PI-3K p85 protein expression in insulin-resistant cell model in 3T3-L1 adipocytes and its possible molecular mechanism.
METHODS: 3T3-L1 adipocytes were treated with 0.5 mmol/L palmic acid or with 25 mmol/L glucose in combination with 0.6 nmol/L insulin to induce insulin resistance. Berberine was used for treatment and aspirin was used for positive control. 2-deoxy-[3H]-D-glucose method was used for determination of glucose uptake. Western blot was performed to estimate protein expression of PI-3K p85.
RESULTS: After the intervention of palmic acid for 24 h or 25 mmol/L glucose with 0.6 nmol/L insulin for 18 h, the insulin-stimulated glucose transport in 3T3-L1 adipocytes was inhibited by 67% and 60% respectively. Meanwhile, the expression of PI-3K p85 protein was significantly reduced compared with normal control group (P < 0.01). However, berberine reversed above phenomenon and significantly enhanced PI-3K p85 protein expression (P < 0.01). The expression rate of PI-3K p85 protein was time- and dose-dependent on berberine.
CONCLUSION: Insulin resistance induced by FFAs or high glucose in 3T3-L1 adipocytes can be improved by berberine and its molecular mechanism might be associated with the expression of PI-3K p85.
- Citation: Yi P, Lu FE, Chen G, Xu LJ, Dong H, Wang KF. Effects of berberine on PI-3K p85 protein expression in insulin-resistant cell model in 3T3-L1 adipocytes. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2102-2106
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2102.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2102
小檗碱(berberine, Ber)是从黄连等植物中提取的一种异喹啉类生物碱. 新近研究表明小檗碱具有改善胰岛素抵抗(insulin resistance, IR), 降低血糖, 纠正脂质紊乱的作用[1-4]. 在细胞水平, IR是指胰岛素信号转导能力的减低, 这种信号转导从胰岛素受体向下到达胰岛素作用的终未底物, 涉及到细胞功能的多种代谢和促有丝分裂方面. 胰岛素通过胰岛素信号转导路径发挥其促进合成代谢、稳定血糖的生理作用,其中磷脂酰肌醇-3激酶(PI-3K)是胰岛素信号转导中的关键分子. 那么小檗碱是否通过促进PI-3K p85蛋白的表达而改善IR呢? 本研究分别以游离脂肪酸和高糖诱导3T3-L1脂肪细胞产生胰岛素抵抗, 观察小檗碱对3T3-L1胰岛素抵抗细胞模型PI-3K p85蛋白表达的影响, 探讨小檗碱改善胰岛素抵抗的分子机制.
盐酸小檗碱、3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松、胰岛素、软脂酸(PA)、乙酰水杨酸钠(阿司匹林)、不含游离脂肪酸的BSA(FAF BSA)、DMSO和细胞松弛素B均购自Sigma公司; DMEM和胎牛血清(FBS)购自Gibco BRL公司; 2-脱氧-[3H]-D-葡萄糖(北京原子高科股份有限公司), 3T3-L1前脂肪细胞(3T3-L1 preadipocyte)(中国医学科学院基础医学研究所细胞中心), 兔PI-3K p85抗体(Santa Cruz公司), 兔β-actin抗体(Lab Vision公司), 蛋白Marker(Fermentas公司), 辣根酶标记山羊抗兔IgG、BCA蛋白检测试剂盒和增强化学发光法(ECL)试剂盒(Pierce公司), 其他化学试剂均为分析纯. SH87261616型CO2培养箱(美国Sheldon公司); 倒置相差显微镜(日本Olympus CHK公司); YJ-1450型医用净化工作台(苏州净化设备公司); Micro Beta 1540型液闪仪(美国PE公司).
1.2.1 细胞培养及诱导分化: 在37℃、50 mL/L的CO2的条件下, 3T3-L1前脂肪细胞在含100 mL/L FBS的高糖DMEM中培养, 待细胞融合2 d后, 加入含0.5 mmol/L 3-异丁基-1-甲基黄嘌呤(IBMX)、1 μmol/L地塞米松、10 mg/L胰岛素和100 mL/L FBS的高糖DMEM培养48 h, 然后换上含10 mg/L胰岛素和100 mL/L FBS的高糖DMEM再培养48 h, 随后以100 mL/L FBS的高糖DMEM继续培养, 2 d换培液1次, 诱导分化8-12 d的3T3-L1细胞90%-95%呈脂肪细胞表型, 可用于实验[5].
1.2.2 高游离脂肪酸诱导的胰岛素抵抗细胞模型的建立与分组: 将诱导分化成熟的3T3-L1脂肪细胞换上含2 g/L BSA的DMEM无血清培养液培养12 h后, 分别换上含0.5 mmol/L软脂酸(PA)10 g/L FAF BSA的DMEM培养24 h(模型组, Mod); 含0.5 mmol/L PA, 10 μmol/L Ber, 10 g/L FAF BSA的DMEM培养24, 48 h(小檗碱高剂量组, BH24, BH48); 含0.5 mmol/L PA, 1 μmol/L Ber, 10 g/L FAF BSA的DMEM培养24, 48 h(小檗碱低剂量组, BL24, BL48); 含0.5 mmol/L PA, 5 mmol/L阿司匹林(Aspirine), 10 g/L FAF BSA的DMEM培养24, 48 h(阿司匹林组, As24, As48); 含10 g/L BSA的DMEM培养24 h(正常组, Nor).
1.2.3 高糖诱导的胰岛素抵抗细胞模型的建立与分组处理: 将诱导分化成熟的3T3-L1脂肪细胞换上含2 g/L BSA的DMEM无血清培养液培养12 h 后, 分别换上含25 mmol/L葡萄糖, 0.6 nmmol/L胰岛素, 10 g/L BSA的DMEM培养18 h(模型组, Mod); 含25 mmol/L葡萄糖, 0.6 nmmol/L胰岛素, 10 μmol/L Ber, 10 g/L BSA的DMEM培养24, 48 h(小檗碱高剂量组, BH24, BH48); 含25 mmol/L葡萄糖, 0.6 nmmol/L胰岛素, 1 μmol/L Ber, 10 g/L BSA的DMEM培养24, 48 h(小檗碱低剂量组, BL24, BL48); 含25 mmol/L葡萄糖, 0.6 nmmol/L胰岛素, 5 mmol/L阿司匹林(Aspirine), 10 g/L BSA的DMEM培养24 h, 48 h(阿司匹林组, As24, As48); 含10 g/L BSA的DMEM培养24 h(正常组, Nor).
1.2.4 葡萄糖转运实验: 将24孔板中诱导分化成熟的3T3-L1脂肪细胞以含2 g/L BSA的DMEM 培养液培养12 h, 换以含2 g/L BSA的含药培养液孵育一定时间后, 移去培养液, 以KRP缓冲液(131.2 mmol/L NaCl, 4.71 mmol/L KCl, 2.47 mmol/L CaCl2, 1.24 mmol/L MgSO4, 2.48 mmol/L Na3PO4, 10 mmol/L HEPES, pH7.4)洗3次,再以含或不含100 nmol/L 胰岛素的KRP 缓冲液37℃孵育30 min, 加入1 mL含0.5 mCi/L 2-脱氧-[3H]-D-葡萄糖的KRP缓冲液37℃孵育10 min, 以预冷含10 mmol/L葡萄糖的PBS快速洗3次中止反应, 加1 mL 0.1 mol/L NaOH作用2 h, 取细胞裂解液, 用液闪仪计数其每分钟衰变数. 另设一组加10 μmol/L细胞松弛素B作为2-脱氧-[3H]-D-葡萄糖的非特异摄取率, 所有数据减去此值, 作为各组细胞的葡萄糖摄取率[6]. 每次实验设三复孔, 共重复3次实验. 另用CCK-8法监测细胞的数目和活力[7].
1.2.5 Western blot: 分化成熟、软脂酸(0.5 mmol/L)、高糖(25 mmol/L)加胰岛素(0.6 nmmol/L)、小檗碱(10 μmol/L, 1 μmol/L)、阿司匹林(5 mmol/L)分别处理24、48 h的3T3-L1脂肪细胞用细胞裂解液裂解后提取总蛋白, 用BCA试剂盒测定蛋白浓度. 取等量的蛋白样品50 μg用样品缓冲液处理,蛋白变性、SDS-PAGE胶电泳分离蛋白、电转移法使蛋白转移至PDVF膜上, 用含5%脱脂奶粉的TBST(Tris-HCl 50 mmol/L, NaCl 150 mmol/L, pH7.4, 0.1% Tween-20)室温下封闭2 h以减少非特异性结合, 封膜后加入兔PI-3K p85抗体为特异性第一抗体, 4℃过夜, TBST洗膜后以辣根过氧化化物酶(HRP)标记的山羊抗兔IgG作为二抗(1:3000)孵育, 室温下轻摇2 h, TBST洗膜后用ECL化学发光法曝光显影, 洗片后用Bio-Rad图像分析系统对Western blot目的条带进行扫描, 然后用Quantity One软件进行分析.
统计学处理 所有数据采用SPSS13.0软件包进行分析, 实验数据用mean±SD表示, 组间数据的比较采用两样本均值的t检验, P<0.05为有统计学意义.
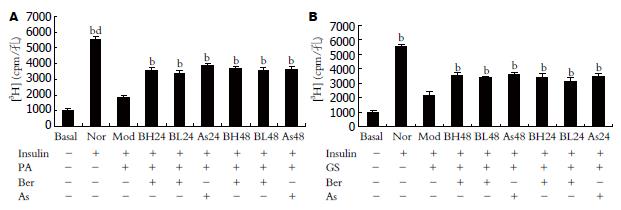
葡萄糖转运实验发现, 诱导分化成熟的3T3-L1脂肪细胞, 胰岛素刺激的葡萄糖转运较基础状态下明显增加,是基础状态下的5.6倍, 0.5 mmol/L软脂酸作用24 h使3T3-L1脂肪细胞胰岛素刺激的葡萄糖转运抑制67%; 加入1 μmol/L, 10 μmol/L小檗碱作用24 h后3T3-L1脂肪细胞胰岛素刺激的葡萄糖转运分别增加82%、93%, 作用48 h后分别增加93%、101%, 呈剂量时间依赖效应; 加入5 mmol/L阿司匹林作用24 h后3T3-L1脂肪细胞胰岛素刺激的葡萄糖转运增加109%, 作用48 h后增加97%, 这与阿司匹林作用48 h后对细胞产生一定的毒性作用使细胞活力和细胞数降低有关(图1A). CCK-8结果显示: 0.5 mmol/L软脂酸作用24 h或同时加入1 μmol/L、10 μmol/L小檗碱作用24、48h或同时加入5 mmol/L阿司匹林作用24 h对3T3-L1脂肪细胞的CCK-8值均无影响, 与正常组比较, P>0.05; 加入5 mmol/L阿司匹林作用48 h脂肪细胞的CCK-8值有轻度下降, 但无统计学意义(表1).
| 分组 | 高游离脂肪酸模型CCK-8值 | 高糖模型CCK-8值 |
| Nor | 1.869±0.050 | 1.869±0.050 |
| Mod | 1.848±0.057 | 1.855±0.019 |
| BH48 | 1.830±0.066 | 1.849±0.020 |
| BL48 | 1.846±0.019 | 1.854±0.019 |
| As48 | 1.819±0.141 | 1.837±0.023 |
| BH24 | 1.836±0.047 | 1.856±0.025 |
| BL24 | 1.852±0.050 | 1.854±0.021 |
| As24 | 1.803±0.088 | 1.845±0.030 |
5 mmol/L葡萄糖加0.6 nmmol/L胰岛素作用18 h使3T3-L1脂肪细胞胰岛素刺激的葡萄糖转运抑制60%; 加入1 μmol/L, 10 μmol/L小檗碱作用24 h后3T3-L1脂肪细胞胰岛素刺激的葡萄糖转运分别增加46%、56%, 作用48 h后分别增加52%、61%, 呈时间剂量依赖效应, 加入5 mmol/L阿司匹林作用24 h后3T3-L1 脂肪细胞胰岛素刺激的葡萄糖转运增加58%, 作用48 h后增加65%(图1B). CCK-8结果显示: 25 mmol/L葡萄糖加0.6 nmmol/L胰岛素培养18 h或同时加入1 μmol/L、10 μmol/L小檗碱作用24 h、48 h或同时加入5 mmol/L阿司匹林作用24 h, 48 h对3T3-L1脂肪细胞的CCK-8值均无影响, 与正常组比较, P>0.05(表1).
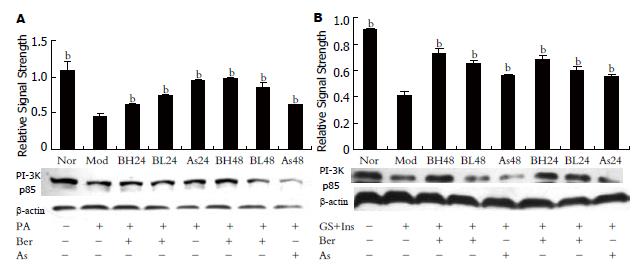
采用Western blot检测3T3-L1脂肪细胞PI-3K p85蛋白的表达, 0.5 mmol/L软脂酸作用24 h可以明显抑制PI-3K p85蛋白的表达, 与正常对照组比较P<0.01; 同时加入小檗碱或阿司匹林则可以逆转PA的作用, 使PI-3K p85蛋白的表达增加, 与模型组比较P<0.01,并且PI-3K p85蛋白的表达与小檗碱的剂量和作用时间呈依赖关系(图2A).
采用Western blot检测3T3-L1脂肪细胞PI-3K p85蛋白的表达, 结果显示: 25 mmol/L葡萄糖加0.6 nmmol/L胰岛素作用18 h可以明显抑制PI-3K p85蛋白的表达, 与正常对照组比较P<0.01; 同时加入小檗碱或阿司匹林则可以逆转其作用, 使PI-3K P85蛋白的表达增加, 与模型组比较P<0.05; 且其表达与小檗碱的作用时间和剂量呈依赖关系(图2B).
小檗碱是从黄连等植物中提取的一种异喹啉类生物碱, 最初作为清热解毒药和抗炎药应用于临床. 最近在《Diabetes》上报道小檗碱通过激活AMPK途径而增加胰岛素敏感性表明小檗碱具有改善IR, 降低血糖, 纠正脂质紊乱的作用[1-4]. 这与我们提出的"糖尿病从毒论治"的假说不谋而合, 那么小檗碱改善胰岛素抵抗作用的分子机制是什么呢?
本次实验分别以0.5 mmol/L软脂酸和25 mmol/L葡萄糖加0.6 nmmol/L胰岛素诱导3T3-L1脂肪细胞产生IR, 予以小檗碱进行干预, 同时以IKKß抑制剂阿司匹林作为阳性对照, 观察到0.5 mmol/L软脂酸作用24 h或25 mmol/L葡萄糖加0.6 nmmol/L胰岛素作用18 h分别使3T3-L1脂肪细胞胰岛素刺激的葡萄糖转运抑制67%和60%, 若预先加入小檗碱或阿司匹林则可以逆转上述效应, 使葡萄糖转运增加46%-101%. 胰岛素刺激的葡萄糖转运是衡量胰岛素敏感性、判断胰岛素抵抗的重要指标, 这说明0.5 mmol/L软脂酸作用24 h或25 mmol/L葡萄糖加0.6 nmmol/L胰岛素作用18 h后3T3-L1脂肪细胞产生IR, 而小檗碱具有改善IR的作用. 此结果与国外报导高游离脂肪酸和高糖可诱导IR, 而小檗碱具有改善IR的结果一致[1,5,8].
为了进一步研究小檗碱改善胰岛素抵抗的作用机制, 我们应用Western blot检测胰岛素信号转导蛋白PI-3K p85的表达, 结果发现: 0.5 mmol/L软脂酸作用24 h或25 mmol/L葡萄糖加0.6 nmmol/L胰岛素作用18 h可以明显抑制PI-3K p85蛋白的表达, 同时加入小檗碱或阿司匹林则可以逆转其作用, 使PI-3K p85蛋白的表达增加, 并且PI-3K p85蛋白的表达与小檗碱的剂量和作用时间呈依赖关系. 胰岛素信号转导途径是复杂多样的, 胰岛素转导通路中任一位点的异常都可能最终阻碍靶组织转运葡萄糖, 从而引起IR. 目前认为胰岛素受体底物(IRS)-磷脂酰肌醇-3-激酶(PI-3K)-Akt途径是介导胰岛素刺激细胞摄取利用葡萄糖的主要途径[9]. 胰岛素结合于其受体后, 受体β亚基特定部位酪氨酸自身磷酸化, 进一步使受体底物1(IRS-1)上的酪氨酸残基磷酸化, 磷酸化的IRS-1与PI-3K的p85调节亚单位结合, 催化p110而激活PI-3K激酶, PI-3K激酶是GLUT4转位的关键酶, 作用于PI-3K的下游分子Akt, 其第308位苏氨酸和473位丝氨酸被磷酸化后激活, 能使细胞膜的脂质双分子层磷酸化, 从而促进GLUT4转位, 使葡萄糖转运进入细胞内. 由此可见PI-3K是胰岛素刺激葡萄糖摄取和GLUT4转位的重要介导分子[9]. 进一步研究显示, 2型糖尿病鼠(ob/ob小鼠和fa/fa鼠)肝细胞中PI-3K中的P85亚基较正常组降低一半左右, 而肌肉和脂肪中无明显改变[10-11]; 高脂喂养的SD大鼠肌肉和脂肪中的PI-3K活性明显低于正常对照[10]; 2型糖尿患者的骨骼肌和脂肪细胞中PI-3K基因表达调控有缺陷[12]. 以上证据说明IR时, 胰岛素靶细胞中的PI-3K的含量和活性均降低, 并存在对胰岛素刺激的敏感性缺陷. 此外, 多种致IR物质, 如FFA、TNF-α等也可影响PI-3K活性, 说明PI-3K是这些物质导致IR的中介分子之一[9]. 前期动物实验我们采用小剂量链脲佐菌素尾静脉注射加高脂高糖饲料喂养方法建立Wistar大鼠胰岛素抵抗模型, 予以小檗碱干预治疗10 wk后, 动物的空腹血糖和胰岛素水平明显降低, OGTT明显改善, 同时脂肪、肌肉组织的PI-3K p85亚基的mRNA表达水平明显增高. 说明小檗碱可能通过上调PI-3K p85亚基的mRNA改善IR, 防治2型糖尿病[13]. 本实验从细胞水平进一步证实, 小檗碱可能通过提高PI-3K p85蛋白的表达而改善IR.
总之, 我们的研究结果表明: 小檗碱可以明显改善高游离脂肪酸和高糖诱导的IR, 而PI-3K作为胰岛素信号转导通路中的一个关键靶点可能在小檗碱改善IR的分子机制中起着一定的作用. 同时这也为"糖尿病从毒论治"的假说和清热解毒法防治2型糖尿病的临床运用提供了实验依据.
小檗碱是从黄连等植物中提取的一种异喹啉类生物碱, 最初作为清热解毒药和抗炎药应用于临床. 最新报道指出小檗碱还具有改善胰岛素抵抗, 降低血糖, 纠正脂质紊乱的作用. IR是指胰岛素信号转导能力的减低, 磷脂酰肌醇-3激酶(PI-3K)是胰岛素信号转导中的关键分子. 那么小檗碱是否通过促进PI-3K p85蛋白的表达而改善胰岛素抵抗, 有待深入研究.
唐文富, 副教授, 四川大学华西医院中西医结合科
小檗碱改善胰岛素抵抗(IR)的分子机制一直是人们研究的热点. 近年来, IR的发病机制, 尤其是其分子靶点及其信号转导机制受到极大关注.
有研究显示, 2型糖尿病鼠(ob/ob小鼠和fa/fa鼠)肝细胞中PI-3K中的P85亚基较正常组降低一半左右, 而肌肉和脂肪中无明显改变; 高脂喂养的SD大鼠肌肉和脂肪中的PI-3K活性明显低于正常对照; 2型糖尿患者的骨骼肌和脂肪细胞中PI-3K基因表达调控有缺陷. 以上证据说明IR时, 胰岛素靶细胞中的PI-3K的含量和活性均降低, 并存在对胰岛素刺激的敏感性缺陷. 此外, 多种致IR物质, 如FFA、TNF-α等也可影响PI-3K活性, 说明PI-3K是这些物质导致IR的中介分子之一.
本实验通过研究小檗碱对3T3-L1 胰岛素抵抗细胞模型PI-3K p85蛋白表达的影响, 探讨了小檗碱改善胰岛素抵抗的分子机制, 为"糖尿病从毒论治"的假说和清热解毒法防治2型糖尿病的临床运用提供了实验依据.
本文具有科学性、创新性和一定的可读性, 但中医药特色相对缺乏.
编辑: 李军亮 电编:吴鹏朕
| 1. | Lee YS, Kim WS, Kim KH, Yoon MJ, Cho HJ, Shen Y, Ye JM, Lee CH, Oh WK, Kim CT. Berberine, a natural plant product, activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states. Diabetes. 2006;55:2256-2264. [PubMed] [DOI] |
| 2. | Yin J, Hu R, Chen M, Tang J, Li F, Yang Y, Chen J. Effects of berberine on glucose metabolism in vitro. Metabolism. 2002;51:1439-1443. [PubMed] [DOI] |
| 3. | Leng SH, Lu FE, Xu LJ. Therapeutic effects of berberine in impaired glucose tolerance rats and its influence on insulin secretion. Acta Pharmacol Sin. 2004;25:496-502. [PubMed] |
| 4. | Ko BS, Choi SB, Park SK, Jang JS, Kim YE, Park S. Insulin sensitizing and insulinotropic action of berberine from Cortidis rhizoma. Biol Pharm Bull. 2005;28:1431-1437. [PubMed] [DOI] |
| 5. | Nelson BA, Robinson KA, Buse MG. High glucose and glucosamine induce insulin resistance via different mechanisms in 3T3-L1 adipocytes. Diabetes. 2000;49:981-991. [PubMed] [DOI] |
| 6. | Romero R, Casanova B, Pulido N, Suarez AI, Rodriguez E, Rovira A. Stimulation of glucose transport by thyroid hormone in 3T3-L1 adipocytes: increased abundance of GLUT1 and GLUT4 glucose transporter proteins. J Endocrinol. 2000;164:187-195. [PubMed] [DOI] |
| 7. | Takeuchi A, Mishina Y, Miyaishi O, Kojima E, Hasegawa T, Isobe K. Heterozygosity with respect to Zfp148 causes complete loss of fetal germ cells during mouse embryogenesis. Nat Genet. 2003;33:172-176. [PubMed] [DOI] |
| 8. | Gao Z, Zhang X, Zuberi A, Hwang D, Quon MJ, Lefevre M, Ye J. Inhibition of insulin sensitivity by free fatty acids requires activation of multiple serine kinases in 3T3-L1 adipocytes. Mol Endocrinol. 2004;18:2024-2034. [PubMed] [DOI] |
| 9. | 王 军, 姜 宏卫. 磷脂酰肌醇3激酶与2型糖尿病. 国外医学·内分泌学分册. 2001;21:294-296. |
| 10. | Anai M, Funaki M, Ogihara T, Kanda A, Onishi Y, Sakoda H, Inukai K, Nawano M, Fukushima Y, Yazaki Y. Enhanced insulin-stimulated activation of phosphatidylinositol 3-kinase in the liver of high-fat-fed rats. Diabetes. 1999;48:158-169. [PubMed] [DOI] |
| 11. | Kerouz NJ, Horsch D, Pons S, Kahn CR. Differential regulation of insulin receptor substrates-1 and -2 (IRS-1 and IRS-2) and phosphatidylinositol 3-kinase isoforms in liver and muscle of the obese diabetic (ob/ob) mouse. J Clin Invest. 1997;100:3164-3172. [PubMed] [DOI] |
| 12. | Andreelli F, Laville M, Ducluzeau PH, Vega N, Vallier P, Khalfallah Y, Riou JP, Vidal H. Defective regulation of phosphatidylinositol-3-kinase gene expression in skeletal muscle and adipose tissue of non-insulin-dependent diabetes mellitus patients. Diabetologia. 1999;42:358-364. [PubMed] [DOI] |
| 13. | Jin D, Lu FE, Chen G, Sun H, Lu XH. [Effects of Huanglian Jiedu Decoction on phosphatidylinositol-3-kinase expression in target tissues of type 2 diabetic rats]. Zhongxiyi Jiehe Xuebao. 2007;5:541-545. [PubMed] |