修回日期: 2008-04-18
接受日期: 2008-04-28
在线出版日期: 2008-07-08
目的: 探索标记细胞肝内移植后磁共振成像技术.
方法: 获取猪自体骨髓间充质干细胞, 分离、培养. 应用菲立磁(Feridex)标记细胞, 普鲁士蓝染色鉴定, 标记细胞组(n = 6)和未标记细胞组(n = 4)行经门静脉行肝内移植, 分别于移植前, 移植后6 h、3 d、7 d行磁共振T1WI, T2WI, T2*WI序列成像, 同时行组织切片普鲁士蓝染色.
结果: 普鲁士蓝染色表明MSCs的标记率达接近100%, 磁标记MSCs肝内移植后行磁共振T2*WI序列呈明显低信号改变, 并持续至细胞移植后7 d, 组织切片普鲁士蓝染色显示7 d后肝内仍有移植的磁标记细胞存在于肝实质及肝血窦中.
结论: 利用Feridex可以在体外成功标记猪骨髓间充质干细胞, 肝脏移植后行磁共振可以对标记细胞进行活体成像.
引文著录: 方亮, 施晓雷, 丁义涛. 菲立磁标记猪骨髓间充质干细胞自体肝内移植的MR成像. 世界华人消化杂志 2008; 16(19): 2097-2101
Revised: April 18, 2008
Accepted: April 28, 2008
Published online: July 8, 2008
AIM: To label bone mesenchymal stem cells with Feridex and to evaluate the imaging of in vivo magnetic resonance imaging (MRI) of the labeled cells in swine liver.
METHODS: Mesenchymal stem cells (MSCs) were isolated from swine, cultured and expanded, then labeled with Feridex. Prussian blue staining was performed. Labeled MSCs group (n = 6) and unlabeled MSCs group (n = 4) were transplanted into swine liver via portal veins. MRI including T1WI, T2WI and T2*WI sequences was performed before and at 6 h, 3 d, 7 d after transplantation. MR imaging findings were analyzed histologically.
RESULTS: Prussian blue staining of Feridex-labeled MSCs showed approximately 100% labeling efficiency. Feridex labeling caused signal intensity loss in liver on T2*WI sequences until day 7 after transplantation. Prussian blue staining of histological analysis showed homing of labeled MSCs in liver after 7 days, primarily distributed in hepatic sinusoids and liver parenchyma.
CONCLUSION: Feridex can be used to label MSCs in vitro successfully. MRI can monitor Feridex-labeled MSCs transplanted into liver.
- Citation: Fang L, Shi XL, Ding YT. In vivo MRI of autologous swine Feridex-labeled mesenchymal stem cells transplantated into liver. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2097-2101
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2097.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2097
骨髓间充质干细胞(mesenchymal stem cells, MSCs)已被证实在体内、外均能分化为具有正常功能的肝样细胞, 因此干细胞移植在治疗急慢性肝衰竭及遗传代谢性肝脏疾病方面具有很好的前景, 但移植细胞在活体内转归、迁移却一直是研究难题. 1999年Weissleder et al提出分子影像学(molecular imaging, MI)的概念[1], 现已成为影像医学和相关临床医学的研究热点, 使得活体细胞示踪成为可能. 我们采用菲立磁(Feridex)标记自体骨髓间充质干细胞, 通过门静脉肝内移植后进行活体MR成像研究, 探讨其在正常肝脏内的成像特点, 为进一步动物肝衰模型进行细胞移植活体示踪研究奠定基础.
成年健康家猪10头, 雌雄不限, 20 kg左右, 由南京大学附属鼓楼医院实验动物中心提供. Feridex购自美国Advanced Magnetics公司, L-DMEM培养液、特级胎牛血清、胰蛋白酶购自Gibco公司, 淋巴细胞分离液购自TBD公司, 台盼蓝, 多聚赖氨酸(PLL, p1524)购自Sigma公司, 普鲁士蓝染色试剂盒购自上海元象生物公司.
1.2.1 MSCs的分离和培养: 实验家猪用氯胺酮(10 mg/kg)肌肉麻醉后, 于髂后上棘穿刺, 抽取骨髓液15 mL. 将获取骨髓液按1:1比例缓慢加入到密度为1.077的淋巴细胞分离液中, 以2200 r/min离心25 min, 收集中间云雾状的界面层, L-DMEM重悬2次后, 接种于25 mL的培养瓶中, 培养液为90% L-DMEM, 及100 mL/L胎牛血清, 置于37℃, 50 mL/L CO2环境中培养, 24 h后首次换液弃去未贴壁悬浮细胞, 以后根据细胞生长情况每3天换液, 第7-10天细胞生长占瓶底面积超过90%形成融合时, 用2.5 g/L的胰酶消化, 按1:2进行传代, 重复操作, 传至第5代, 培养过程中倒置相差显微镜下对培养中的细胞进行观察.
1.2.2 Feridex体外标记MSCs及普鲁士蓝染色鉴定: 将含铁浓度为11.2 mg/L的Feridex用L-DMEM稀释至50 mg/L, PLL用L-DMEM稀释至1.5 mg/L, 两者混合振荡60 min形成耦联复合物[2], 即终浓度分别为含铁25 mg/L和含多聚赖氨酸 0.75 mg/L的L-DMEM培养液. P5代MSCs加入此培养液接种于培养瓶及置有盖玻片的六孔培养板中, 在37℃, 50 mL/L CO2培养箱中孵育12 h进行细胞标记. 普鲁士蓝染色: 上述接种于六孔培养板的P5代细胞, 取出盖玻片, 用磷酸盐缓冲夜(PBS)洗涤3次, 40 g/L多聚甲醛4℃下固定30 min, 蒸馏水冲洗2次, 20 g/L酸性亚铁氰化钾(含6%盐酸)孵育染色20 min, 蒸馏水冲洗2次, 核固红复染, 光学显微镜下观察.
1.2.3 Feridex标记MSCs后肝内移植: 所有动物均同室同条件下饲养, 随机分为2组: 对照组, n = 4, 经门静脉移植未标记的自体MSCs; 实验组, n = 6, 经门静脉移植Feridex标记的自体MSCs.
标记细胞及未标记细胞均用2.5 g/L胰酶消化, PBS洗涤3次, 分别制成2 mL细胞悬液, 含细胞数量约1×107. 移植方法: 动物麻醉后, 消毒腹部皮肤, 分层进入腹腔, 暴露肝脏, 解剖肝门部, 寻找门静脉, 用头皮针斜行穿刺入门静脉, 注射器在向门静脉内缓慢推注2 mL细胞悬液. 拔针后局部按压止血, 见无明显渗血后, 生理盐水冲洗腹腔, 逐层关腹.
1.2.4 MRI检查: 实验组与对照组分别于移植前、移植后6、3、7 d行MRI检查. 动物麻醉后, 采用Philips 1.5T超导磁共振扫描仪进行扫描, 膝关节线圈检查. 动物取仰卧位, 四肢固定于塑料平板上. 扫描序列: SE序列: T1WI, TR 120 s, TE 14 ms; 快速自旋回波序列(FSE): T2WI, TR 3000 ms, TE 96 ms; 梯度回波序列(GRE): T2*WI, TR 485 ms, TE 14 ms, 反转角18度.
1.2.5 组织学检查: MRI检查1 wk后处死动物, 取出肝脏, 随机取肝血管及周围组织, 甲醛固定后制成石蜡切片, 行普鲁士蓝染色.
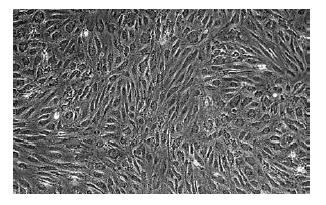
接种后24 h后首次换液, 可见少量类圆形细胞贴壁生长. 原代培养3 d后, 镜下可见单个或少量成集落生长贴壁细胞, 形态大多呈短梭形, 7-10 d后, 细胞集落不断扩大并形成融合单层, 细胞形态大多呈长梭形或多角形, 传至第5代, MSCs逐渐纯化, 类似成纤维细胞, 呈均匀分布生长(图1), Feridex标记的MSCs与未标记的MSCs镜下观察形态上无明显区别.
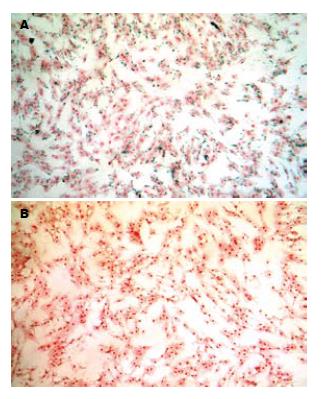
Feridex标记MSCs后普鲁士蓝染色可见几乎每个标记细胞内均有数量不等的蓝染颗粒(图2A), 镜下随机计数标记细胞, 标记率接近100%, 高倍视野下可见蓝染颗粒分布于胞质内, 而未标记细胞内无蓝染颗粒(图2B).
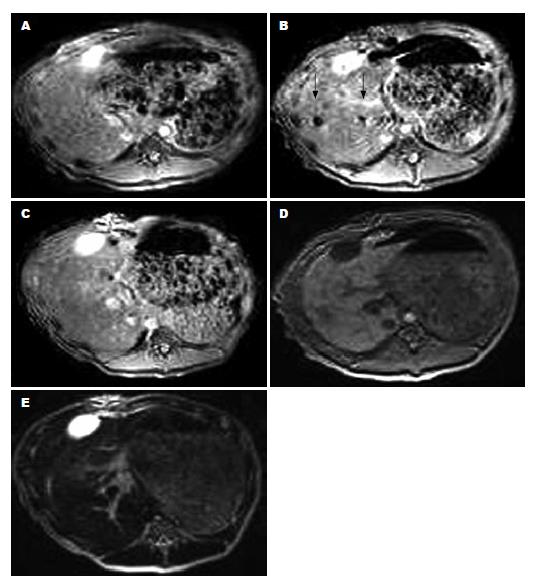
实验组磁标记MSCs经门静脉移植前磁共振图像(图3A), 6 h后行磁共振在T2*WI序列可见门静脉主干及分支内有明显的低信号改变(图3B箭头所示), 随时间延长, 该处低信号强度逐渐减弱, 7 d后无明显低信号改变(图3C); 而T1WI和T2WI序列各时间点未见明显低信号变化(图3D-E). 对照组门静脉移植未标记的干细胞, 行磁共振各序列扫描均未见低信号变化.
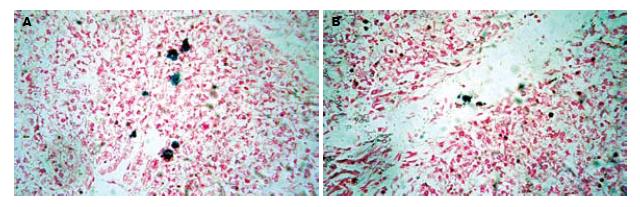
实验组可见点状蓝染细胞散在分布于肝血管及周围实质中(图4). 对照组普鲁士蓝染色未见蓝染阳性细胞.
近年来已发现MSCs在体内与体外均能诱导分化为具有正常功能的肝样细胞. 1999年, Petersen et al[3]通过对不同性别、不同品系的大鼠骨髓移植后的肝细胞的研究发现, 接受骨髓移植的鼠肝内存在骨髓来源的肝细胞. Theise et al[4]和Alison et al[5]证实这种现象不仅出现在大鼠体内, 而且也同样存在于人体内. Theise et al[6]进一步发现在接受骨髓移植和肝移植患者的体内, 约4%-43%的肝细胞和4%-38%的胆管细胞来源于骨髓干细胞的横向分化, 而这种细胞的转化量有随肝脏损伤的程度和时间的增加而增加的倾向. 国内有报道[7]在体外诱导小鼠骨髓干细胞分化为肝样细胞, 并表达HNF-3β、ALB、CK-18、TTR、G-6-Pase和TAT等肝细胞特异性标志物. 以上体内及体外实验结果均表明骨髓干细胞是肝细胞的重要肝外来源, 在特定的条件下可分化为肝细胞, 参与肝脏的再生. 但是, 干细胞移植入肝内后, 是怎样的一个转归过程, 其定位、迁移、分裂及分化的过程是怎样的? 目前, 国内外的方法基本是通过离体状态下组织切片的分析, 无法进行动态的监测, 而建立无创伤的活体示踪技术不仅可以解决这些问题, 也可作为干细胞肝内移植的客观、安全的评估标准.
分子影像学提出后, 细胞活体示踪成为可能, 众多影像学技术中MRI有效成像时间长, 可观察细胞的动态迁徙过程, 且空间、时间分辨率高, 对比度好等特点, 适合用于研究活体细胞示踪. 应用MRI进行活体示踪需要先体外标记示踪剂, 超顺磁性氧化铁(superparamagnetic iron oxide, SPIO)是目前研究最多, 最有前景的一类对比示踪剂, 其特点是粒径小, 一般直径在nm数量级, 穿透力及驰豫率强, 对外加磁场具有高敏感性, 在较弱的磁场中, 即可产生较大的磁性, 而撤除外加磁场后磁性也迅速消失.
SPIO类最初被用来标记淋巴细胞、白细胞等进行免疫研究[8], 近年来由于干细胞移植的开展, 开始应用于标记干细胞后移植到动物心脏、肾脏等进行活体示踪[9-11]. Feridex是美国FDA认可的一种临床上使用的SPIO对比剂, 基本结构是以葡聚糖包裹氧化铁颗粒, 进入人体后主要分布在肝脏的枯否细胞内, 被细胞代谢后进入正常血浆铁池, 参与体内铁的再利用[12]. 由于细胞膜和Feridex表面都带有负电荷, 两者相互排斥, 所以未经修饰的Feridex不能有效标记细胞, 国内外多利用特异性抗体或转染剂介导进行细胞标记[13-16], 我们采用PLL作为转染剂介导进行磁标记, 主要是通过静电相互作用, 带负电荷的Feridex与带正电荷的PLL形成耦联复合物, 刺激细胞膜内吞作用, 将铁颗粒转运至细胞内, 实验表明其标记有效率高达99%以上[9]. Feridex作为临床常用的MR对比剂, 已证实对机体是安全的, 而作为细胞标记物, 研究也表明在一定浓度范围内, 对细胞增殖无明显影响[2,17], 至于对细胞功能及分化有无影响, 则还需进一步研究证实.
由于SPIO类的特殊形态结构, 在磁共振成像时主要是磁标记细胞起周围组织的质子弛豫时间改变, 即加速质子去相位的T2弛豫, 使组织信号降低, 故信号改变主要发生梯度回波T2*WI序列, 而在T1WI及T2WI无明显信号改变. 在我们的实验中, 磁标记细胞移植后6 h行磁共振显示门静脉主干及分支有明显低信号改变, 以后随着时间的延长, 低信号改变逐渐减弱, 1 wk后基本不显影, 但此时处死动物行组织普鲁士蓝染色仍可发现少量蓝染的含铁颗粒细胞, 提示Feridex标记的干细胞移植后1 wk仍然在肝脏内有残留, 只是因为数量不足, 此时已不能在磁共振上引起低信号改变. 有报道磁标记细胞被移植于心肌或脑等致密性组织器官[18-19], 移植细胞多局限分布, 很少发生迁移, 活体MR成像表现为移植局部低信号影, 其余器官无信号改变, 本实验是经门静脉肝脏细胞移植, 故移植细胞有随血管迁移至肝外的可能, 从而信号改变逐渐降低; 同时考虑到正常肝脏内并无适合干细胞定植及生长增殖的微环境, 因此这种信号的减低亦有可能是因为移植的干细胞不断死亡, 铁颗粒弥散出细胞参与体内代谢而被清除导致的. 这些都表明细胞数量变化与信号强度改变之间存在一定的关系, 因此是否可以根据信号的改变来监测移植细胞在肝内的增殖和分布还需要进一步实验研究.
本次实验的结果表明Feridex联合PLL可以有效地标记猪骨髓间充质干细胞, 细胞移植肝脏后在梯度回波T2*WI序列的低信号变化最明显, 在此基础上, 我们下一步将在动物急性肝衰竭模型中进行自体骨髓干细胞磁标记移植后的MRI动态示踪, 进一步研究干细胞在肝内的分布、迁移及转归.
干细胞移植在治疗急慢性肝衰竭及遗传代谢性肝脏疾病方面具有很好的前景, 但移植细胞在活体内的转归、迁移却一直是研究难题.
邱双健, 副教授, 复旦大学附属中山医院肝癌研究所、肝肿瘤外科
骨髓间充质干细胞可以作为种子细胞用于肝移植的替代治疗, 建立无创伤的活体示踪技术可以解决干细胞移植后如何定位、迁移及转归.
本文首次研究猪骨髓间充质干细胞移植后在活体肝脏内细胞动态变化及其转归过程.
菲立磁: 是美国FDA认可的一种临床上使用的磁共振对比剂, 基本结构是以葡聚糖包裹氧化铁颗粒, 属于超顺磁性氧化铁, 可用于标记细胞进行磁共振活体示踪.
本研究充分利用分子影像学技术, 为进一步动物肝衰模型进行细胞活体示踪研究奠定基础, 具有一定的临床应用价值.
编辑: 李军亮 电编:何基才
| 1. | Weissleder R. Molecular imaging: exploring the next frontier. Radiology. 1999;212:609-614. [PubMed] |
| 2. | Arbab AS, Bashaw LA, Miller BR, Jordan EK, Lewis BK, Kalish H, Frank JA. Characterization of biophysical and metabolic properties of cells labeled with superparamagnetic iron oxide nanoparticles and transfection agent for cellular MR imaging. Radiology. 2003;229:838-846. [PubMed] [DOI] |
| 3. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 4. | Theise ND, Badve S, Saxena R, Henegariu O, Sell S, Crawford JM, Krause DS. Derivation of hepatocytes from bone marrow cells in mice after radiation-induced myeloablation. Hepatology. 2000;31:235-240. [PubMed] [DOI] |
| 5. | Alison MR, Poulsom R, Jeffery R, Dhillon AP, Quaglia A, Jacob J, Novelli M, Prentice G, Williamson J, Wright NA. Hepatocytes from non-hepatic adult stem cells. Nature. 2000;406:257. [PubMed] [DOI] |
| 6. | Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, Henegariu O, Krause DS. Liver from bone marrow in humans. Hepatology. 2000;32:11-16. [PubMed] [DOI] |
| 7. | Shi XL, Qiu YD, Wu XY, Xie T, Zhu ZH, Chen LL, Li L, Ding YT. In vitro differentiation of mouse bone marrow mononuclear cells into hepatocyte-like cells. Hepatol Res. 2005;31:223-231. [PubMed] [DOI] |
| 8. | Dodd CH, Hsu HC, Chu WJ, Yang P, Zhang HG, Mountz JD Jr, Zinn K, Forder J, Josephson L, Weissleder R, Mountz JM, Mountz JD. Normal T-cell response and in vivo magnetic resonance imaging of T cells loaded with HIV transactivator-peptide-derived superparamagnetic nanoparticles. J Immunol Methods. 2001;256:89-105. [PubMed] [DOI] |
| 9. | Frank JA, Zywicke H, Jordan EK, Mitchell J, Lewis BK, Miller B, Bryant LH Jr, Bulte JW. Magnetic intracellular labeling of mammalian cells by combining (FDA-approved) superparamagnetic iron oxide MR contrast agents and commonly used transfection agents. Acad Radiol. 2002;9 Suppl 2:S484-S487. [PubMed] [DOI] |
| 10. | Bos C, Delmas Y, Desmoulière A, Solanilla A, Hauger O, Grosset C, Dubus I, Ivanovic Z, Rosenbaum J, Charbord P. In vivo MR imaging of intravascularly injected magnetically labeled mesenchymal stem cells in rat kidney and liver. Radiology. 2004;233:781-789. [PubMed] [DOI] |
| 11. | Küstermann E, Roell W, Breitbach M, Wecker S, Wiedermann D, Buehrle C, Welz A, Hescheler J, Fleischmann BK, Hoehn M. Stem cell implantation in ischemic mouse heart: a high-resolution magnetic resonance imaging investigation. NMR Biomed. 2005;18:362-370. [PubMed] [DOI] |
| 12. | Weissleder R, Stark DD, Engelstad BL, Bacon BR, Compton CC, White DL, Jacobs P, Lewis J. Superparamagnetic iron oxide: pharmacokinetics and toxicity. AJR Am J Roentgenol. 1989;152:167-173. [PubMed] |
| 13. | Josephson L, Tung CH, Moore A, Weissleder R. High-efficiency intracellular magnetic labeling with novel superparamagnetic-Tat peptide conjugates. Bioconjug Chem. 1999;10:186-191. [PubMed] [DOI] |
| 14. | Bulte JW, Zhang S, van Gelderen P, Herynek V, Jordan EK, Duncan ID, Frank JA. Neurotransplantation of magnetically labeled oligodendrocyte progenitors: magnetic resonance tracking of cell migration and myelination. Proc Natl Acad Sci U S A. 1999;96:15256-15261. [PubMed] [DOI] |
| 15. | Lewin M, Carlesso N, Tung CH, Tang XW, Cory D, Scadden DT, Weissleder R. Tat peptide-derivatized magnetic nanoparticles allow in vivo tracking and recovery of progenitor cells. Nat Biotechnol. 2000;18:410-414. [PubMed] [DOI] |
| 16. | Bulte JW, Douglas T, Witwer B, Zhang SC, Strable E, Lewis BK, Zywicke H, Miller B, van Gelderen P, Moskowitz BM. Magnetodendrimers allow endosomal magnetic labeling and in vivo tracking of stem cells. Nat Biotechnol. 2001;19:1141-1147. [PubMed] [DOI] |
| 17. | Arbab AS, Bashaw LA, Miller BR, Jordan EK, Bulte JW, Frank JA. Intracytoplasmic tagging of cells with ferumoxides and transfection agent for cellular magnetic resonance imaging after cell transplantation: methods and techniques. Transplantation. 2003;76:1123-1130. [PubMed] [DOI] |
| 18. | Hoehn M, Küstermann E, Blunk J, Wiedermann D, Trapp T, Wecker S, Föcking M, Arnold H, Hescheler J, Fleischmann BK. Monitoring of implanted stem cell migration in vivo: a highly resolved in vivo magnetic resonance imaging investigation of experimental stroke in rat. Proc Natl Acad Sci U S A. 2002;99:16267-16272. [PubMed] [DOI] |
| 19. | Hill JM, Dick AJ, Raman VK, Thompson RB, Yu ZX, Hinds KA, Pessanha BS, Guttman MA, Varney TR, Martin BJ. Serial cardiac magnetic resonance imaging of injected mesenchymal stem cells. Circulation. 2003;108:1009-1014. [PubMed] [DOI] |