修回日期: 2008-04-12
接受日期: 2008-05-14
在线出版日期: 2008-06-28
目的: 探讨慢性乙型肝炎患者外周血中CD11c+髓样树突状细胞(mDC)相对数量和细胞表型的变化, 以及与HBV持续感染之间的关系.
方法: 2007-03/2007-10瑞金医院感染科住院及门诊慢性乙型肝炎患者28例, 另设健康对照组21例(均为本院职工). 流式细胞分析技术检测受试者外周血mDC的百分比数. 磁珠分选方法分离纯化mDC, 流式细胞仪检测mDC表面共刺激分子CD80和CD86.
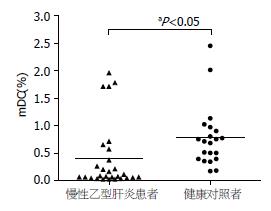
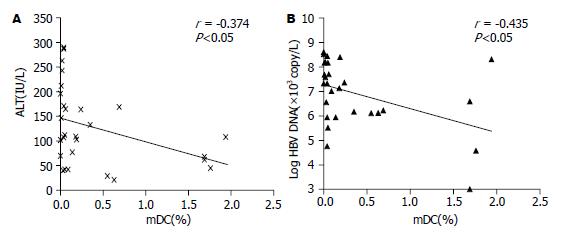
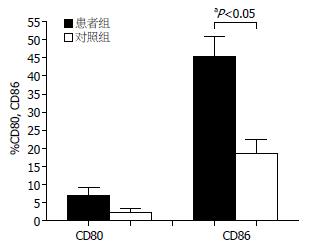
结果: 与健康对照组相比, 慢性乙肝患者CD11c+ mDC占外周血单个核细胞的频数明显降低, 差异有统计学意义(0.38%±0.61% vs 0.77%±0.56%, P<0.05). 慢性乙肝患者外周血mDC频数与血清ALT水平、病毒载量呈负相关(r = -0.374, -0.435, 均P<0.05), 患者组不同肝脏炎症程度mDC频数存在差异. 新鲜分离的mDC表面共刺激分子CD80和CD86表达较低, 但患者组CD86的表达明显高于正常对照组, 差异有统计学意义(45.26%±21.54% vs 18.71%±10.93%, P<0.05).
结论: 慢性乙型肝炎患者外周血CD11c+ mDC亚群百分比降低, 但mDC表面共刺激分子表达率并未严重受损, 外周血中CD11c+ mDC数量减少可能与血清病毒载量及肝脏炎症程度相关.
引文著录: 朱文静, 谢青, 陈榕, 贾妮娜, 项晓刚, 林兰意, 郭斯敏, 王晖. CD11c+髓样树突状细胞在慢性乙型肝炎中频数与细胞表型的变化. 世界华人消化杂志 2008; 16(18): 2007-2011
Revised: April 12, 2008
Accepted: May 14, 2008
Published online: June 28, 2008
AIM: To investigate the frequency and phenotype of circulating myeloid dendritic cells (mDCs) in patients with persistent hepatitis B virus (HBV) infection.
METHODS: Peripheral blood was collected from 28 chronic hepatitis B patients and 21 healthy blood donors (used as controls). CD11c+ mDCs were isolated by immunomagnetic selection. Flow cytometry was used to analyze the frequency of circulating CD11c+ mDCs and costimulatory molecules CD80 and CD86 on freshly isolated mDCs.
RESULTS: The frequency of peripheral mDCs in patients with chronic HBV infection was significantly decreased as compared with that in the healthy controls (0.38% ± 0.61% vs 0.77% ± 0.56%, P < 0.05). Respectively, mDCs frequency inversely was correlated with ALT levels (r = -0.374, P < 0.05) and HBV DNA level (r = -0.435, P < 0.05). Statistic differences of the mDCs frequency also existed among patients with different liver inflammatory levels. Both CD80 and CD86 expression on freshly isolated mDCs surface were lower; however, CD86 expression in the patients was relatively higher than that in the control (45.26% ± 21.54% vs 18.71% ± 10.93%, P < 0.05).
CONCLUSION: The percentage of CD11c+ mDCs decreases but its CD80 and CD86 expression levels are not impaired in chronic HBV patients. Serum HBV DNA load and liver inflammatory level may have some influences on the percentage of peripheral mDCs.
- Citation: Zhu WJ, Xie Q, Chen R, Jia NN, Xiang XG, Lin LY, Guo SM, Wang H. Changes in frequency and phenotype of circulating CD11c+ myeloid dendritic cells in patients with chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 2007-2011
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/2007.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.2007
慢性乙型肝炎病毒持续感染及疾病进展与HBV病毒作用、宿主免疫应答及肝细胞受损等多重因素有关. 树突状细胞(dendritic cells, DC)作为一个重要的抗原递呈细胞在其中发挥着联络作用. 外周血CD11c+髓样树突状细胞(mDC)相对单核细胞来源树突状细胞(monocyte-derived dendritic cells, moDC)更能体现出DC的免疫监视作用[1]. 对于CD11c+ mDC数量、表型和功能等特点的分析有助于我们更好地了解DC在慢性乙型肝炎发病机制中的作用, 也为今后可能开展的利用DC为载体的免疫治疗提供有益的准备. 本研究拟对慢乙肝患者外周血CD11c+ mDC亚群相对数量及细胞表型进行检测, 并分析其与慢乙肝患者肝炎活动程度、病毒载量的相关性.
2007-03/2007-10瑞金医院感染科住院及门诊慢性乙型肝炎患者28例, 男19例, 女9例, 年龄25-52(平均34.8)岁, 诊断符合2005年中华医学会肝病学会中华医学会感染病学分会联合制定的《慢性乙型肝炎防治指南》诊断标准. 排除丙型、丁型、戊型肝炎及免疫缺陷疾病, 6 mo内未使用任何抗病毒药物及免疫调节剂, 所有患者均行肝活检. 慢性乙型肝炎患者血清ALT水平范围为21-290 IU/L, 血清HBV病毒载量范围为3.82×107-4.10×1011 copy/L. 健康对照组21例(均为本院职工, 体检排除乙、丙型肝炎病毒及其他感染, 肝功能正常), 年龄19-53(平均33.1)岁, 男13例, 女8例. 所有患者及健康志愿者血液采集均经本人知情同意. 淋巴细胞分离液购自Sigma公司; 异硫氰酸(FITC)标记鼠抗人谱系标记(Lineage, 包括CD3、CD14、CD16、CD19、CD20、CD56)mAb及同型对照鼠IgG1购自Caltag公司; 藻红蛋白(PE)标记鼠抗人CD11c+ mAb, 别藻蓝蛋白(APC)标记HLA-DR mAb, FITC标记鼠抗人CD80 mAb, PE标记鼠抗人CD86 mAb及用于同型对照的鼠IgG2a/IgGb购自eBioscience公司; BDCA-1树突状细胞分离试剂盒购自德国美天妮公司; FACScalibur流式细胞仪购自美国BD公司.
1.2.1 外周血mDC频率检测: 分离外周血单个核细胞(PBMC), 磷酸盐缓冲液(PBS)洗涤细胞3次, 加入FITC标记的Lineage(CD3、CD14、CD16、CD19、CD20、CD56), PE标记的CD11c, APC标记的HLA-DR mAb各10 μL, 室温避光孵育30 min, 1500 r/min离心5 min, 10 g/L多聚甲醛固定, 同时设同型对照, 上流式细胞仪检测. Lineage-、CD11c+和HLA-DR+双阳性的细胞为mDC.
1.2.2 外周血髓样树突状细胞的分离: 将上述获得的PBMC计数定容后, 加入FcR-阻断剂、CD19磁珠、BDCA-1生物素抗体各100 μL, 低温孵育15 min, 在磁分选操作台上用LD柱阴选去除CD19+ B细胞群, 收集过柱后的细胞重新定容并加入抗生物素磁珠100 μL, 低温孵育15 min, 在磁分选单位上用MS柱阳选出BDCA1+ mDC(即CD11c+ mDC).
1.2.3 新鲜分离的CD11c+ mDC细胞表型测定: 收集新鲜分离后的CD11c+ mDC, 取>2×104细胞,用FITC-标记鼠抗人CD80 mAb和PE-标记鼠抗人CD86 mAb各10 μL标记细胞, 室温避光孵育30 min, 1500 r/min离心5 min, 10 g/L多聚甲醛固定, 同时设同型对照.
1.2.4 肝脏组织学炎症评分: 与采集血标本同时, 患者签署知情同意书, B超定位下以1 s负压吸引法行肝脏活检, 肝组织经40 g/L甲醛溶液固定, 石蜡包埋, 连续切片(5 μm), 进行苏木素-伊红(HE)染色. 由有经验的病理专家进行肝脏组织学炎症评分, 肝脏组织炎症分级用改良HAI评分方法(0-18). 按无炎症HAI = 0, 极轻度炎症HAI = 1-3, 轻度炎症HAI = 4-8, 中度炎症 HAI = 9-12, 重度炎症HAI = 13-18来划分肝脏炎症坏死程度.
统计学处理 应用SPSS13.0软件进行统计学处理, 正态分布数据用mean±SD表示, 两组均数比较采用t检验, 多组均数的显著性检验采用单因素方差分析. 非参数相关分析采用Spearman相关分析. P<0.05差异有统计学意义.
通过流式细胞仪技术检测特异性表面膜标志, 谱系标记lineage(CD3、CD14、CD16、CD19、CD20、CD56)阴性, CD11c、HLA-DR双阳性为mDC亚群. 对于28例慢性乙肝患者及21例正常对照者外周血mDC占PBMC的百分比进行团体t检验, 差异有统计学意义(P<0.05), 健康对照组外周血mDC占PBMC的百分比明显高于慢性乙型肝炎患者(0.77%±0.56% vs 0.38%±0.61%, P<0.05, 图1).
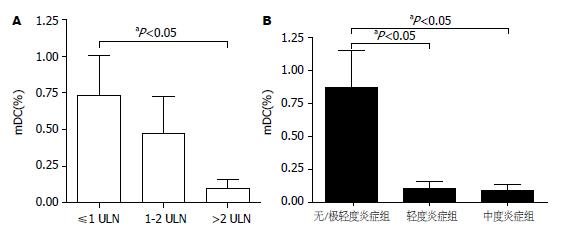
慢性乙肝患者外周血mDC频数与血清谷丙转氨酶ALT水平呈负相关(r = -0.374, P<0.05, 图2A), 与血清病毒载量呈明显负相关(r = -0.435, P<0.05, 图2B). 我们根据患者ALT水平进一步将患者分为: ≤1倍正常上限范围组(≤1 ULN, 7例), 1-2倍正常上限范围组(1-2 ULN, 9例), >2倍正常上限范围组(>2 ULN, 12例), 3组外周血mDC占PBMC的百分比分别为0.73%±0.71%, 0.47%±0.77%, 0.10%±0.20%. ALT≤1 ULN患者组mDC相对百分数高于ALT>2 ULN患者组, 差异有统计学意义(P<0.05, 图3A).
慢性乙肝患者按肝组织病理活检炎症等级分为3组, 无炎症和极轻度炎症组(HAI 0-3, 共8例), 轻度炎症组(HAI 4-8, 12例), 中度炎症组(HAI 9-12, 8例). 3组mDC频数分别为0.87%±0.81%, 0.11%±0.15%, 0.09%±0.12%. 轻度炎症组和中度炎症组mDC相对百分数均低于无炎症和极轻度炎症组, 差异有统计学意义(P<0.05). 轻度炎症组和中度炎症组mDC相对百分数比较差异无统计学意义(图3B).
流式细胞仪技术检测新鲜分离纯化后的CD11c+ mDC表面共刺激分子, 慢性乙肝患者组CD80和CD86表达率分别为6.87%±8.15%, 45.26%±21.54%, 健康对照组CD80和CD86表达率为2.35%±2.72%, 18.71%±10.93%, 慢性乙肝患者组CD86表达率高于健康对照组(P<0.05), 而两组CD80表达率比较差异无统计学意义(图4).
DC是功能强大的抗原递呈细胞, 在诱导特异T细胞反应中起非常重要的作用[2-3]. 近几年, 国内外诸多文献报道慢性乙型肝炎患者外周血树突状细胞数量、表型及功能均存在异常[4-6]. 最近, Tavakoli et al[7]提出不同看法, 既往研究多以单核细胞来源的DC在细胞因子的刺激下长时间体外培养, 因此DC本身的免疫应答会发生改变. 将外周血DCs的前体细胞CD11c+ mDC和CD123+浆样树突状细胞(plasmacytoid dendritic cell, pDC)分选研究可能有助于进一步阐明不同DC亚群在机体免疫中的不同作用及与慢性乙型肝炎持续化感染的关系. mDC主要发挥抗原提呈功能, 促进Th1细胞极化和细胞免疫的发生[8]. pDC是机体内源性Ⅰ型干扰素(Ⅰ-IFN)产生的主要细胞, Ⅰ-IFN不仅对病毒复制产生直接抑制作用, 还能激活NK细胞、B细胞、T细胞和mDC细胞, 从而诱导并增强抗病毒的免疫应答[8-9]. 有报道在慢乙肝患者单核细胞来源的DC内发现病毒颗粒和HBV复制中间物, 而mDC和pDC细胞内却仅能检测到HBV DNA, HBV RNA复制中间体及共价闭合环状DNA(covalently closed circular DNA, cccDNA)却不存在, 这提示HBV病毒在mDC和pDC内不能核转录和复制[7,10]. 因而, 对mDC和pDC分离研究可能会完善以往我们对树突状细胞缺陷引起免疫耐受的新认识.
由于慢性乙型肝炎为HBV病毒感染诱发的免疫相关性疾病, HBV病毒对免疫细胞的感染影响着宿主的免疫功能. 但慢性乙型肝炎病毒持续感染状态下, 外周血中DCs数量是否也同样存在缺陷, 目前研究结论不一[7,11-12]. 若单纯比较DCs亚群数量变化意义不大, 但本实验结合患者转氨酶水平、血清病毒载量及肝脏炎症程度等综合指标来探讨临床现象与免疫研究之间的相关性. 实验结果显示: 慢性乙型肝炎患者外周血mDC亚群比例下降, 可能与下列因素有关: (1)HBV直接感染mDC, 诱导其凋亡, 导致DC数量下降. 本实验中发现慢性乙型肝炎患者外周血mDC频数与血清HBV病毒载量呈明显负相关, 临床上我们认为病毒载量是肝脏损害加剧的最大危险因素, HBV复制的直接指标为HBV DNA水平, HBV DNA水平高低与机体免疫功能相关[13]. (2)mDC参与机体免疫活动而转移到炎症部位或其他靶器官等[14]. 本实验中慢性乙型肝炎患者外周血mDC频率与血清ALT水平存在负相关, 且ALT>2 ULN的慢乙肝患者外周血mDC频率明显低于ALT正常患者. 进一步根据肝脏组织学病理结果, 将不同程度肝脏炎症等级慢性乙型肝炎患者mDC相对数量作比较, 发现轻度炎症组和中度炎症组mDC相对百分数均低于无炎症和极轻度炎症组. 这间接提示外周血中感染HBV病毒的DC, 激活后向肝脏炎症部位趋化, 从而使外周循环DC数量减少, 加之病毒诱导DC功能的缺陷, 机体无法产生强大而特异性的CTL反应. 最近也有研究发现在HBV感染免疫激活期循环中的DCs亚群数量减少, 而浸润至肝脏的DCs有所增加, 肝脏DCs数量与血清ALT水平呈正相关[12].
CD80(B7-1)、CD86(B7-2)与T细胞表面CD28的结合为T细胞激活提供第二信号, 形成强烈的共刺激信号后, 活化CTL等免疫活性细胞以清除病毒. 以往研究中从外周血中分离PBMC在体外经细胞因子刺激诱导10-14 d, 健康对照者DC表面共刺激分子CD80、CD86表达率可达到80%-90%, 而慢性乙型肝炎患者仅30%-40%, DC表型成熟存在障碍[15]. 本研究与以往不同, 直接对CD11c+ mDC分离纯化, 通过检测未经刺激DC细胞表型反映其外周血中活化状态. 实验结果显示正常对照与患者组CD11c+ mDC表面共刺激分子CD80、CD86表达率均低下, 说明循环中DC绝大部分为未成熟DC, 这与之前Kunitani et al[16]研究结果一致. 患者组CD86表达率稍高于正常对照组, 原因可能是慢乙肝患者外周血中mDC吞噬HBV病毒颗粒后加工递呈抗原, 迁移至淋巴组织成为成熟mDC, 同时表面共刺激分子表达增加, 在这个动态的过程中, 可能会检测到外周血中mDC的CD86表达升高. 同时也提示, 慢性乙型肝炎患者外周血mDC在受到病毒抗原刺激后形成共刺激信号的能力并未受明显影响.
DC作为体内免疫反应的始动子、调节子和效应子, 一旦受损会影响到机体免疫的各个环节. 本研究表明, 慢性乙型肝炎患者中CD11c+ mDC数量减少可能与病毒作用及肝脏炎症相关, CD11c+ mDC数量减少是导致机体无法产生强大特异性CTL反应的原因之一, 但细胞表面共刺激能力并无缺陷, 今后我们将对CD11c+ mDC细胞亚群的功能状态作进一步深入研究, 这对于探讨HBV持续感染的免疫机制及未来制备高效的DCs疫苗运用于临床治疗具有重要意义.
以往研究普遍认为HBV感染引起的免疫耐受与慢性乙型肝炎患者DC数量、表型及功能缺陷有关. 外周血中存在两类DC亚群前体, 对其分选研究将有助于进一步阐明不同DC亚群在机体免疫中的不同作用及与慢性乙型肝炎持续化感染的关系.
范小玲, 主任医师, 北京地坛医院综合科.
磁分选细胞技术获得纯化CD11c+ mDC, 与以往传统方法分离单个核细胞体外培养诱导DCs不同, 长时间外源性细胞因子的刺激会改变DC本身的性质, 直接分选能更准确反映细胞在循环中的真实状态.
Tavakoli et al对慢性乙型肝炎患者外周血mDC和pDC作分选研究, 发现两类DC亚群数量、表型及功能均无明显受损, 且病毒在mDC和pDC无法复制.
本文收集了完整的临床资料, 结合患者转氨酶水平、血清病毒载量及肝脏炎症程度等综合指标来探讨临床现象与免疫研究之间的相关性.
本文对CDHC+在不同状态的慢性乙型肝炎的数量的变化进行了研究, 并进行了合理的机制解释, 对进一步研究CD11c+ mDC在慢性乙型肝炎的发病机制中的作用打下一定的基础, 也为将来可能的DC疫苗研究提供了理论依据, 具有较好的临床学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Osugi Y, Vuckovic S, Hart DN. Myeloid blood CD11c(+) dendritic cells and monocyte-derived dendritic cells differ in their ability to stimulate T lymphocytes. Blood. 2002;100:2858-2866. [PubMed] [DOI] |
| 2. | Huang Y, Chen Z, Jia H, Wu W, Zhong S, Zhou C. Induction of Tc1 response and enhanced cytotoxic T lymphocyte activity in mice by dendritic cells transduced with adenovirus expressing HBsAg. Clin Immunol. 2006;119:280-290. [PubMed] [DOI] |
| 4. | Beckebaum S, Cicinnati VR, Zhang X, Ferencik S, Frilling A, Grosse-Wilde H, Broelsch CE, Gerken G. Hepatitis B virus- induced defect of monocyte-derived dendritic cells leads to impaired T helper type 1 response in vitro: mechanisms for viral immune escape. Immunology. 2003;109:487-495. [PubMed] [DOI] |
| 5. | 翁 永强, 邱 双健, 汤 钊猷, 叶 胜龙, 刘 银坤, 樊 嘉, 孙 瑞霞, 赵 燕. 乙型肝炎相关肝癌外周血树突状细胞负载肿瘤抗原 前后免疫功能的变化. 中华肝脏病杂志. 2005;13:339-342. |
| 6. | Zheng BJ, Zhou J, Qu D, Siu KL, Lam TW, Lo HY, Lee SS, Wen YM. Selective functional deficit in dendritic cell--T cell interaction is a crucial mechanism in chronic hepatitis B virus infection. J Viral Hepat. 2004;11:217-224. [PubMed] [DOI] |
| 7. | Tavakoli S, Mederacke I, Herzog-Hauff S, Glebe D, Grün S, Strand D, Urban S, Gehring A, Galle PR, Böcher WO. Peripheral blood dendritic cells are phenotypically and functionally intact in chronic hepatitis B virus (HBV) infection. Clin Exp Immunol. 2008;151:61-70. [PubMed] |
| 8. | Duan XZ, Zhuang H, Wang M, Li HW, Liu JC, Wang FS. Decreased numbers and impaired function of circulating dendritic cell subsets in patients with chronic hepatitis B infection (R2). J Gastroenterol Hepatol. 2005;20:234-242. [PubMed] [DOI] |
| 9. | McKenna K, Beignon AS, Bhardwaj N. Plasmacytoid dendritic cells: linking innate and adaptive immunity. J Virol. 2005;79:17-27. [PubMed] [DOI] |
| 10. | Untergasser A, Zedler U, Langenkamp A, Hösel M, Quasdorff M, Esser K, Dienes HP, Tappertzhofen B, Kolanus W, Protzer U. Dendritic cells take up viral antigens but do not support the early steps of hepatitis B virus infection. Hepatology. 2006;43:539-547. [PubMed] [DOI] |
| 11. | van der Molen RG, Sprengers D, Binda RS, de Jong EC, Niesters HG, Kusters JG, Kwekkeboom J, Janssen HL. Functional impairment of myeloid and plasmacytoid dendritic cells of patients with chronic hepatitis B. Hepatology. 2004;40:738-746. [PubMed] [DOI] |
| 12. | Zhang Z, Chen D, Yao J, Zhang H, Jin L, Shi M, Zhang H, Wang FS. Increased infiltration of intrahepatic DC subsets closely correlate with viral control and liver injury in immune active pediatric patients with chronic hepatitis B. Clin Immunol. 2007;122:173-180. [PubMed] [DOI] |
| 14. | Woltman AM, de Fijter JW, Zuidwijk K, Vlug AG, Bajema IM, van der Kooij SW, van Ham V, van Kooten C. Quantification of dendritic cell subsets in human renal tissue under normal and pathological conditions. Kidney Int. 2007;71:1001-1008. [PubMed] [DOI] |