修回日期: 2008-04-16
接受日期: 2008-05-18
在线出版日期: 2008-06-28
目的: 探讨胃癌(gastric carcinoma, GC)组织肿瘤坏死因子受体6(tumor necrosis factor receptor 6, TR6)蛋白过度表达的临床意义.
方法: 2001/2005年手术切除或内镜活检的胃黏膜标本151例,包括慢性浅表性胃炎(CSG)42例, 胃黏膜肠上皮化生(IM)37例, 异型增生(Dys)45例, GC27例, 另外, GC52例为组织微阵列产品. 所有病例每例取2处, 作成组织微阵列6组: GC 24例、GC 27例、GC 28例、Dys 45例、IM 37例、CSG 42例. 应用免疫组织化学检测TR6蛋白的表达水平, 并分析其与临床病理特征的关系.
结果: GC组织TR6阳性率明显高于Dys、IM及CSG组织(χ2 = 2.288, P = 0.022; χ2 = 2.639, P = 0.008; χ2 = 3.593, P = 0.000). GC高分化组TR6阳性率明显低于低分化组(χ2 = 2.183, P = 0.029); TNMⅠ、Ⅱ期阳性率明显低于Ⅲ、Ⅳ期(χ2 = 2.194, P = 0.028); 无淋巴结转移组阳性率明显低于淋巴结转移组(χ2 = 2.891, P = 0.004); 无远处转移组阳性率明显低于远处转移组(χ2 = 5.021, P = 0.000); TR6表达与年龄、性别及肿瘤浸润深度无关.
结论: TR6高表达在GC的发生发展及转移中起重要作用; 检测TR6蛋白指标有助于GC诊断和判断患者预后.
引文著录: 陈罡, 党裔武, 罗殿中. 应用组织微阵列技术检测胃癌组织肿瘤坏死因子受体6的表达及意义. 世界华人消化杂志 2008; 16(18): 1997-2001
Revised: April 16, 2008
Accepted: May 18, 2008
Published online: June 28, 2008
AIM: To investigate the expression of tumor necrosis factor receptor 6 (TR6) protein in gastric carcinoma (GC) and its clinical significance.
METHODS: Tissue microarray was constructed using 79 cases of GC tissues, 45 dysplasia (Dys) tissues, 37 intestinal metaplasia (IM) and 42 chronic superficial gastritis (CSG) tissues. Immunohistochemistry was employed to detect the expression of TR6 protein. Statistical analysis was performed to figure out the correlation between TR6 expression and the clinicopathological features of GC.
RESULTS: The positive rate of TR6 protein in GC tissues was significantly higher than that in Dys (χ2 = 2.288, P = 0.022), IM (χ2 = 2.639, P = 0.008) and CSG tissues (χ2 = 3.593, P = 0.000). The expression of TR6 protein in the well-differentiated GC tissues was significantly lower than that in the poorly-differentiated ones (χ2 = 2.183, P = 0.029). Moreover, the positive rate of TR6 protein was markedly lower in the groups of TNM stage Ⅰ, Ⅱ or without lymph node metastasis than that in the groups of stage Ⅲ, Ⅳ (χ2 = 2.194, P = 0.028) or with lymph node metastasis (χ2 = 5.021, P = 0.000). The expression of TR6 was not associated with the age, sex of patients, or the tumor invasive depth.
CONCLUSION: Over-expression of TR6 may play an important role in the pathogenesis, development and metastases of GC. TR6 gene may serve as an important molecular biological indicator in diagnosing and predicating the biological behavior of GC.
- Citation: Chen G, Dang YW, Luo DZ. Expression of tumor necrosis factor receptor 6 in the tissue microarrays of gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 1997-2001
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/1997.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.1997
肿瘤坏死因子受体6(tumor necrosis factor receptor 6, TR6)1998年首先由Pitti et al[1]报告, 又名DcR3或M68, 是肿瘤坏死因子受体超家族(TNFR super family)的成员之一. TR6是一类可以和某些蛋白配体特异性结合的受体蛋白分子, 他们竞争性的抑制该配体与死亡受体(death receptor)的结合, 从而阻断该配体诱导产生的凋亡[2-4]. 三种配体分别为: (1)可诱导表达的, 并可与单纯疱疹病毒(herpes simplex virus, HSV)的包膜糖蛋白D(gD)竞争结合T细胞上疱疹病毒侵入介体(HVEM, 又称TR2)受体的淋巴毒素的同源体(homologous to lymphotoxins, inducible, competes with HSV glycoprotein D for HVEM, expressed by T lymphocyte, LIGHT), 又名TNFSF-14或HVEM-L[5-10]; (2)Fas的配体(Fas Ligand, FasL), 亦称CD95L[1,11-13]; (3)肿瘤坏死因子样因子1A(tumor necrosis factor-like 1A, TNF-like1A, TL1A)[14-16]. 研究发现, TR6基因的表达和扩增与人类多种恶性肿瘤的发生、发展以及肿瘤的免疫逃逸密切相关[1,17-18], 但胃癌(gastric carcinoma, GC)中TR6基因的表达与临床病理特征的关系尚少见报道. 为此, 我们采用组织微阵列技术高通量的优势回顾性的检测了TR6蛋白在GC79例、异型增生(dysplasia, Dys)45例、胃黏膜肠上皮化生(intestinal metaplasia, IM)37例、慢性浅表性胃炎(chronic superficial gastritis, CSG)42例的表达及意义, 报告如下.
2001/2005年手术切除或内镜活检的胃黏膜标本151例, 包括CSG 42例, IM 37例, Dys 45例, GC 27例, 另外, GC 52例为桂林泛浦生物技术有限公司组织微阵列产品. 胃癌按组织学类型和分化程度分为2组: 乳头状腺癌和管状腺癌为高分化组共51例; 低分化腺癌、黏液腺癌、印戒细胞癌及未分化癌归类为低分化组共28例. 临床病理分期按WHO国际抗癌联盟制定的胃癌分期标准(pTNM)进行[19]: Ⅰ期12例, Ⅱ期25例, Ⅲ期20例, Ⅳ期22例. 所有病例均为病理学检查证实, 男123例, 女80例, 年龄20-82(47.3±12.7)岁. 抗TR6兔多克隆抗体购自美国Santa Cruz公司, 稀释度为1:300. 抗TR6已知阳性组织切片作阳性对照, 以PBS代替一抗作阴性对照. 免疫组化二步法试剂盒(Polymer Detection System for Immuno-Histological Staining, PV-9000)为北京中杉金桥生物技术有限公司产品.
对供体组织HE染色切片作形态学观察, 并在供体蜡块上准确标记所需要的靶点; 参照Kononen et al[20]创建的方法, 利用组织微阵列制作仪(Beecher)钻取靶点组织, 并转移至受体蜡块相应的孔位上, 制成所需的阵列蜡块; 203例病例每例取2处, 常规方法作4 µm切片制作成组织微阵列6组: (1)GC 24例; (2)GC 27例; (3)GC 28例; (4)Dys 45例; (5)IM 37例; (6)CSG 42例. HE染色, 确定组织微阵列中的组织样本及形态学表现[21-22]. 免疫组织化学检测按试剂盒说明进行, 凡细胞质中出现明显的棕黄色颗粒者为阳性细胞, 由两名病理医师采用双盲法阅片和双评分半定量法进行评分: 靶细胞阳性率<25%为0分, 25%-50%为1分, 51%-75%为2分, >75%为3分; 显色程度按切片中细胞显色有无及染色深浅记分, 细胞无染色为0分, 浅棕黄色为1分, 棕黄色为2分, 棕褐色为3分; 将两分相加, <2分为(-), 2-3分为(+), 4-5分为(++), 6分为(+++)[23].
统计学处理 应用SPSS13.0统计软件对数据进行χ2检验, P<0.05为差异有显著性意义.
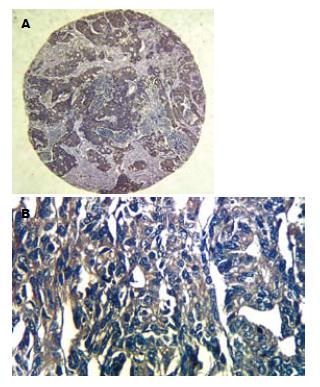
TR6蛋白阳性反应明显定位于胞质内, 为胞质内棕黄色颗粒状或斑片状染色, 阳性细胞的分布呈弥漫性片状、小巢状或散在分布(图1). 四组标本中, 从GC→Dys→IM→CSG TR6的表达率呈递减关系, GC组织中的TR6蛋白的阳性率34.2%(27/79)明显高于Dys 15.6%(7/45, χ2 = 2.288, P = 0.022); IM 10.8%(4/37, χ2 = 2.639, P = 0.008)及CSG组织4.9%(2/42, χ2 = 3.593, P = 0.000), 但Dys, IM, CSG之间未见显著性差异. TR6表达与年龄、性别及原发肿瘤浸润深度无关(表1).
GC高分化组TR6阳性率25.5%(13/51), 明显低于低分化组50.0%(14/28, χ2 = 2.183, P = 0.029). GC TNMⅠ,Ⅱ期TR6阳性率21.6%(8/37), 明显低于Ⅲ, Ⅳ期45.2%(19/42, χ2 = 2.194, P = 0.028). 无淋巴结转移组TR6阳性率13.8%(4/29), 明显低于淋巴结转移组46.0%(23/50, χ2 = 2.891, P = 0.004); 无远处转移组TR6阳性率16.4%(9/55), 明显低于远处转移组75.0%(18/24, χ2 = 5.021, P = 0.000, 表1).
组织微阵列(tissue microarrays), 也称组织芯片(tissue chip)于1998年首先由Kononen et al[20]报道. 因具有体积小、高通量、经济、省时省力、易于重复、易于标准化, 实验误差小和节约开支等优点, 目前在科研工作中得到了广泛的应用. TR6是新近发现的一种可溶性TNFR超家族成员, 属于TNFR超家族的第3类(包括OPG和被称为诱捕受体的DcR1, DcR2和DcR3). 他在肿瘤的发生发展、肿瘤免疫中发挥重要的作用. 研究发现多种人类恶性肿瘤(如胃肠道肿瘤[1,17,24]、肺癌[1]、神经胶质瘤[25-26]、病毒相关淋巴瘤[27]、胰腺癌[18]、食管癌[28]、肝癌[23,29]和喉癌[30]等)均能检测到TR6的高表达. 国内外报道, 胃癌组织中TR6蛋白和mRNA阳性表达率均明显高于正常胃组织[1,17,23,31-33], 与本研究结果类似, 提示在GC的恶性形成过程中, TR6的异常表达发挥重要的作用.
Takahama et al[17]发现胃癌癌旁组织有TR6 mRNA的表达. Li et al[28]发现, TR6在正常食管黏膜, Barrett食管, 轻度异型增生均有轻重不一的表达. Kim et al[34]发现正常及急性阑尾炎组织有TR6蛋白阳性表达. 另外, Wu et al[32]发现, 在肝硬化中出现了TR6蛋白的阳性表达. 我们在肝硬化和正常肝组织中也发现了TR6的表达[35]. 本研究在Dys, IM, CSG组织发现TR6有不同程度的表达, 与以上结果类似. 从癌前病变到胃癌组织(CSG→IM→Dys→GC)TR6蛋白的表达未见报道, 我们的结果显示从正常胃黏膜组织到癌前病变到癌组织TR6的表达是呈递增趋势的, 虽然Dys中TR6的表达与IM及CSG相比没有显著性差异, 我们仍考虑TR6蛋白在非癌组织中的表达可能与GC癌前病变有一定的关系, 该设想尚有待于进一步的实验研究.
李平 et al[31]发现高分化GC TR6蛋白阳性率低于低分化组; Takahama et al[17]发现TR6在胃癌组织中的过表达与胃癌肿瘤组织分化程度密切相关, 分化好者TR6表达低. 我们也发现, GC中高分化组TR6阳性率明显低于低分化组, 提示GC中TR6蛋白表达与癌细 胞分化程度密切相关, 分化程度越低, 肿瘤恶性程度越高, TR6蛋白表达也越高. 我们还发现, 临床TNM Ⅲ, Ⅳ期GC的TR6的表达明显高于Ⅰ, Ⅱ期, 说明TR6的表达与肿瘤的生长和进展有关, 临床分期越靠后, TR6的表达越高. 同时, 有淋巴结转移和远处转移的病例的TR6的表达明显高于无转移组, 与李平 et al[31]及Takahama et al[17]的研究结果类似, 说明TR6与代表肿瘤生物学行为的浸润转移因素有关, TR6高表达者, 肿瘤细胞转移能力增强, 易发生肿瘤的浸润转移.
总之, TR6在GC组织中表达增高, 尤其在伴有淋巴结及远处转移的癌组织中表达增高, 表明其在GC的发生、发展以及转移中发挥重要的作用, 为GC的治疗提供了一个新的靶点. 同时由于TR6基因表达发生于肿瘤形成期, 理论上, 可以通过外周血TR6蛋白水平的监测, 进行TR6阳性表达或者高危人群的早期筛查. 国内外已经有报道[29,32-33]在胃癌等肿瘤患者的血清中, 检测到TR6蛋白明显增高, 部分阳性患者的血清TR6水平可达到正常人群平均值的20倍. 我们也正在进行TR6蛋白在多种肿瘤外周血中的表达的研究, 希望TR6能成为包括GC在内的多种肿瘤早期诊断和评价预后的重要分子生物学检测指标. 同时在肿瘤治疗的角度上, TR6也有着广大的应用前景, 从蛋白水平甚至RNA水平减少肿瘤组织中TR6的表达或抑制他的活性, 将使机体正常发挥清除肿瘤细胞功能, 从而积极推动TR6阳性肿瘤的基因治疗发展.
感谢广西桂林泛浦生物技术有限公司提供的组织微阵列技术服务.
肿瘤坏死因子受体6(TR6)是肿瘤坏死因子受体超家族(TNFR super family)的成员, 可以和LIGHT, FasL及TL1A结合, 从而阻断这些配体诱导的凋亡. 组织微阵列技术作为一项高通量的科研技术在肿瘤基因研究领域中已得到广泛应用.
马大烈, 教授, 中国人民解放军第二军医大学长海医院病理科.
本文应用组织微阵列技术回顾性的检测了TR6蛋白在GC及癌前病变胃组织中的表达及临床意义, 探讨检测TR6蛋白指标对GC诊断和判断患者预后方面的价值和意义.
有研究发现TR6在多种恶性肿瘤中异常高表达, 而相应的正常组织不表达或者低表达. Takahama et al的研究也发现, GC组织TR6表达显著高于癌旁胃组织.
本研究首次使用组织微阵列技术研究TR6表达与GC癌前病变以及与GC发生发展的关系.
本实验结果说明TR6高表达在GC的发生、发展及转移中发挥作用, 检测TR6蛋白指标可能有助于GC诊断和判断患者预后.
LIGHT: 可诱导表达, 并可与单纯疱疹病毒的包膜糖蛋白D竞争结合T细胞上疱疹病毒侵入介体受体的淋巴毒素的同源体, 又名TNFSF-14或HVEM-L, 是TNF家族新发现的凋亡诱导配体之一.
本文研究内容及结果有一定的科学意义, 但讨论不充分, 表述矛盾之处较多.
编辑: 李军亮 电编:吴鹏朕
| 1. | Pitti RM, Marsters SA, Lawrence DA, Roy M, Kischkel FC, Dowd P, Huang A, Donahue CJ, Sherwood SW, Baldwin DT. Genomic amplification of a decoy receptor for Fas ligand in lung and colon cancer. Nature. 1998;396:699-703. [PubMed] [DOI] |
| 2. | Takeda K, Stagg J, Yagita H, Okumura K, Smyth MJ. Targeting death-inducing receptors in cancer therapy. Oncogene. 2007;26:3745-3757. [PubMed] [DOI] |
| 3. | Chang YC, Chan YH, Jackson DG, Hsieh SL. The glycosaminoglycan-binding domain of decoy receptor 3 is essential for induction of monocyte adhesion. J Immunol. 2006;176:173-180. [PubMed] |
| 4. | Lee CS, Hu CY, Tsai HF, Wu CS, Hsieh SL, Liu LC, Hsu PN. Elevated serum decoy receptor 3 with enhanced T cell activation in systemic lupus erythematosus. Clin Exp Immunol. 2008;151:383-390. [PubMed] |
| 5. | Gill RM, Coleman NM, Hunt JS. Differential cellular expression of LIGHT and its receptors in early gestation human placentas. J Reprod Immunol. 2007;74:1-6. [PubMed] [DOI] |
| 6. | Edwards JR, Sun SG, Locklin R, Shipman CM, Adamopoulos IE, Athanasou NA, Sabokbar A. LIGHT (TNFSF14), a novel mediator of bone resorption, is elevated in rheumatoid arthritis. Arthritis Rheum. 2006;54:1451-1462. [PubMed] [DOI] |
| 7. | Chang YH, Hsieh SL, Chao Y, Chou YC, Lin WW. Proinflammatory effects of LIGHT through HVEM and LTbetaR interactions in cultured human umbilical vein endothelial cells. J Biomed Sci. 2005;12:363-375. [PubMed] [DOI] |
| 8. | Gill RM, Hunt JS. Soluble receptor (DcR3) and cellular inhibitor of apoptosis-2 (cIAP-2) protect human cytotrophoblast cells against LIGHT-mediated apoptosis. Am J Pathol. 2004;165:309-317. [PubMed] |
| 9. | Wan X, Zhang J, Luo H, Shi G, Kapnik E, Kim S, Kanakaraj P, Wu J. A TNF family member LIGHT transduces costimulatory signals into human T cells. J Immunol. 2002;169:6813-6821. [PubMed] |
| 10. | Shi G, Luo H, Wan X, Salcedo TW, Zhang J, Wu J. Mouse T cells receive costimulatory signals from LIGHT, a TNF family member. Blood. 2002;100:3279-3286. [PubMed] [DOI] |
| 11. | Wortinger MA, Foley JW, Larocque P, Witcher DR, Lahn M, Jakubowski JA, Glasebrook A, Song HY. Fas ligand-induced murine pulmonary inflammation is reduced by a stable decoy receptor 3 analogue. Immunology. 2003;110:225-233. [PubMed] [DOI] |
| 12. | Yamana K, Bilim V, Hara N, Kasahara T, Itoi T, Maruyama R, Nishiyama T, Takahashi K, Tomita Y. Prognostic impact of FAS/CD95/APO-1 in urothelial cancers: decreased expression of Fas is associated with disease progression. Br J Cancer. 2005;93:544-551. [PubMed] [DOI] |
| 13. | Li W, Zhang C, Chen C, Zhuang G. Correlation between expression of DcR3 on tumor cells and sensitivity to FasL. Cell Mol Immunol. 2007;4:455-460. [PubMed] |
| 14. | Jin T, Kim S, Guo F, Howard A, Zhang YZ. Purification and crystallization of recombinant human TNF-like ligand TL1A. Cytokine. 2007;40:115-122. [PubMed] [DOI] |
| 15. | Yang CR, Hsieh SL, Teng CM, Ho FM, Su WL, Lin WW. Soluble decoy receptor 3 induces angiogenesis by neutralization of TL1A, a cytokine belonging to tumor necrosis factor superfamily and exhibiting angiostatic action. Cancer Res. 2004;64:1122-1129. [PubMed] [DOI] |
| 16. | Migone TS, Zhang J, Luo X, Zhuang L, Chen C, Hu B, Hong JS, Perry JW, Chen SF, Zhou JX. TL1A is a TNF-like ligand for DR3 and TR6/DcR3 and functions as a T cell costimulator. Immunity. 2002;16:479-492. [PubMed] [DOI] |
| 17. | Takahama Y, Yamada Y, Emoto K, Fujimoto H, Takayama T, Ueno M, Uchida H, Hirao S, Mizuno T, Nakajima Y. The prognostic significance of overexpression of the decoy receptor for Fas ligand (DcR3) in patients with gastric carcinomas. Gastric Cancer. 2002;5:61-68. [PubMed] [DOI] |
| 18. | Tsuji S, Hosotani R, Yonehara S, Masui T, Tulachan SS, Nakajima S, Kobayashi H, Koizumi M, Toyoda E, Ito D. Endogenous decoy receptor 3 blocks the growth inhibition signals mediated by Fas ligand in human pancreatic adenocarcinoma. Int J Cancer. 2003;106:17-25. [PubMed] [DOI] |
| 19. | Tsendsuren T, Jun SM, Mian XH. Usefulness of endoscopic ultrasonography in preoperative TNM staging of gastric cancer. World J Gastroenterol. 2006;12:43-47. [PubMed] |
| 20. | Kononen J, Bubendorf L, Kallioniemi A, Bärlund M, Schraml P, Leighton S, Torhorst J, Mihatsch MJ, Sauter G, Kallioniemi OP. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med. 1998;4:844-847. [PubMed] [DOI] |
| 21. | Mao XY, Wang XG, Lv XJ, Xu L, Han CB. COX-2 expression in gastric cancer and its relationship with angiogenesis using tissue microarray. World J Gastroenterol. 2007;13:3466-3471. [PubMed] |
| 22. | Chen WC, Lin MS, Zhang BF, Fang J, Zhou Q, Hu Y, Gao HJ. Survey of molecular profiling during human colon cancer development and progression by immunohistochemical staining on tissue microarray. World J Gastroenterol. 2007;13:699-708. [PubMed] |
| 23. | Chen G, Luo DZ, Wang Y, Liao ZL, Zhang MY. Relationship between expression of decoy receptor 3 and apoptosis in hepatocellular carcinoma. Zhonghua Binglixue Zazhi. 2007;36:113-117. [PubMed] |
| 24. | Bai C, Connolly B, Metzker ML, Hilliard CA, Liu X, Sandig V, Soderman A, Galloway SM, Liu Q, Austin CP. Overexpression of M68/DcR3 in human gastrointestinal tract tumors independent of gene amplification and its location in a four-gene cluster. Proc Natl Acad Sci U S A. 2000;97:1230-1235. [PubMed] [DOI] |
| 25. | Roth W, Isenmann S, Nakamura M, Platten M, Wick W, Kleihues P, Bähr M, Ohgaki H, Ashkenazi A, Weller M. Soluble decoy receptor 3 is expressed by malignant gliomas and suppresses CD95 ligand-induced apoptosis and chemotaxis. Cancer Res. 2001;61:2759-2765. [PubMed] |
| 26. | Arakawa Y, Tachibana O, Hasegawa M, Miyamori T, Yamashita J, Hayashi Y. Frequent gene amplification and overexpression of decoy receptor 3 in glioblastoma. Acta Neuropathol. 2005;109:294-298. [PubMed] [DOI] |
| 27. | Ohshima K, Haraoka S, Sugihara M, Suzumiya J, Kawasaki C, Kanda M, Kikuchi M. Amplification and expression of a decoy receptor for fas ligand (DcR3) in virus (EBV or HTLV-I) associated lymphomas. Cancer Lett. 2000;160:89-97. [PubMed] [DOI] |
| 28. | Li H, Zhang L, Lou H, Ding I, Kim S, Wang L, Huang J, Di Sant'Agnese PA, Lei JY. Overexpression of decoy receptor 3 in precancerous lesions and adenocarcinoma of the esophagus. Am J Clin Pathol. 2005;124:282-287. [PubMed] [DOI] |
| 29. | Shen HW, Gao SL, Wu YL, Peng SY. Overexpression of decoy receptor 3 in hepatocellular carcinoma and its association with resistance to Fas ligand-mediated apoptosis. World J Gastroenterol. 2005;11:5926-5930. [PubMed] |
| 30. | Li L, Hu J, Zhao R, Yue Z. Expression of DcR3 protein and its significance in laryngeal carcinoma. Linchung Erbi Yanhou Toujing Waike Zazhi. 2007;21:537-539. [PubMed] |
| 32. | Wu Y, Han B, Sheng H, Lin M, Moore PA, Zhang J, Wu J. Clinical significance of detecting elevated serum DcR3/TR6/M68 in malignant tumor patients. Int J Cancer. 2003;105:724-732. [PubMed] [DOI] |
| 33. | Wu YL, Yu JX, Shen HW, Han B, Gao SL. Clinical significance and correlation between elevated serum TR6 and lympho- metastasis in gastric cancer. Zhonghua Waike Zazhi. 2003;41:928-931. [PubMed] |
| 34. | Kim S, Fotiadu A, Kotoula V. Increased expression of soluble decoy receptor 3 in acutely inflamed intestinal epithelia. Clin Immunol. 2005;115:286-294. [PubMed] [DOI] |
| 35. | Chen G, Luo DZ. The relationship between the expression of TR6 mRNA and protein in the apoptosis of hepatocellular carcinoma cells. Zhonghua Ganzangbing Zazhi. 2007;15:302-303. [PubMed] |