修回日期: 2008-06-03
接受日期: 2008-06-14
在线出版日期: 2008-06-28
目的: 探讨适宜的人胚胎肝细胞培养条件.
方法: 采用胶原酶两步灌流法分离20-24 wk人胚胎肝细胞, 非连续性Percoll密度梯度离心法纯化细胞, 用Ham's F12普通培养基和条件培养基培养胚胎肝细胞. 观察培养细胞的形态特征, 免疫荧光法检测胚胎肝细胞角蛋白18 (Cytokeratin 18, CK18)和甲胎蛋白(alpha-1-fetoprotein, AFP)表达, MTT法检测细胞活力和增殖能力.
结果: 在条件培养基培养不同时间的胚胎肝细胞始终呈现特异性多角形形态, 100%表达CK18和AFP, 细胞增殖活跃, 活力无明显下降. 而在普通培养基培养24 h时, 部分细胞即呈现成纤维细胞梭样形态, 仅56%细胞表达CK18, 43%细胞表达AFP, 在培养72 h细胞均呈现成纤维细胞梭样形态, 细胞增殖及活力下降(0.25±0.03 vs 1.01±0.12, P<0.001), 至培养第7天细胞CK18及AFP表达呈阴性, 细胞增殖及活力显著下降(0.17±0.04 vs 0.94±0.12, P<0.001).
结论: Ham's F12条件培养基体外能够显著促进人胚胎肝细胞增殖, 维持胚胎肝细胞的特异性形态和表型的稳定.
引文著录: 李建听, 兰延莉. 不同培养条件对人胚胎肝细胞形态和表型的影响. 世界华人消化杂志 2008; 16(18): 1974-1979
Revised: June 3, 2008
Accepted: June 14, 2008
Published online: June 28, 2008
AIM: To explore an optimal culture condition for human fetal hepatocytes (HFHs).
METHODS: A two-step collagenase perfusion technique was used to isolate HFHs. The freshly isolated cell suspension was purified by means of discontinuous Percoll density gradients centrifugation. After purification, cells were cultured in Ham's F12 medium or Ham's F12 hormonally defined medium for different time respectively, and the specific expression of cytokeratin 18 (CK18) and alpha-1-fetoprotein (AFP) in the primary cultures was characterized by indirect immunofluorescence method. Cell growth and proliferation was checked by MTT method.
RESULTS: In the condition of Ham's F12 hormonally defined medium, HFHs exhibited typical hepatocyte-specific polygonal morphology; the cultures consisted of 100% CK18- and AFP-positive cells during different time; HFHs retained higher proliferative potential. However, in the condition of Ham's F12 medium, some cells in the cultures showed a sharp and spindle feature, and only 56% cells of the cultures expressed CK18 and 43% expressed AFP at the 24th hour. And at the 72nd hour, all cells presented a sharp and spindle feature, and had poorer proliferative potential and viability (0.25 ± 0.03 vs 1.01 ± 0.12, P < 0.001). On the 7th day, there were not CK18- and AFP-positive cells in the cultures, and the cells had worst proliferative potential and viability (0.17 ± 0.04 vs 0.94 ± 0.12, P < 0.001).
CONCLUSION: Using Ham's F12 hormonally defined medium, we are able to maintain the specific polygonal morphology and stable phenotype of primary HFHs for 1 week, and moreover, the cells retain a higher proliferative potential.
- Citation: Li JT, Lan YL. Morphological and phenotypic characteristics of human fetal hepatocytes in different culture medium. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 1974-1979
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/1974.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.1974
体外培养的人肝细胞具有广泛的应用价值, 包括肝细胞对肝炎病毒的反应研究、外源性毒物的代谢研究、药物在肝脏代谢与分布研究、肝细胞移植以及重症肝衰竭的治疗等[1-4]. 但是, 肝细胞在体外培养时活力和增殖能力迅速下降, 发生转分化而失去肝细胞功能, 培养非常困难[5]. 成人肝细胞体外增殖能力差, 临床标本缺乏, 而人胚胎肝细胞体外增殖能力强, 标本来源相对较多. 既往研究表明一定胎龄的胚胎肝细胞是体外研究肝细胞特异基因表达的合适模型[6], 但人胚胎肝细胞体外培养方法尚少见报道. 本研究旨在探讨适宜的体外人胚胎肝细胞培养条件.
Ⅳ型胶原酶(Sigma公司), Percoll(Amer-sham公司), 胎牛血清(杭州四季青公司), Ham's F12培养基(Hyclone公司), 地塞米松, 胰岛素, 胰升糖素(Sigma公司), 表皮生长因子(Peprotech公司), 生长激素(R&D Systems公司), 转铁蛋白, 亚油酸(Sigma公司), L-谷氨酰胺(Hyclone公司), MTT(Amersham公司). 鼠抗人cytokeratin 18 (CK18), 兔抗人alpha-1-fetoprotein(AFP), 鼠抗人CD68, 兔抗人von willebrand factor(VWF)和鼠抗人desmin(DAKO公司), 非相关小鼠IgG1和正常兔IgG(Zymed Lab公司), 羊抗兔IgG-FITC和羊抗鼠IgG1-Texas Red(Santa Cruz公司), DAPI (Pierce公司). 倒置相差显微镜(Nikon公司), 激光共聚焦显微镜(Leica TCS SP2 AOBS), 550ELISA酶标仪(Bio-Rad公司).
1.2.1 人胚胎肝细胞的分离、纯化和培养: 此研究获得了和平医院伦理委员会的批准, 并获患者的知情同意. 选用临床上正常孕妇自然流产废弃的孕期为20-24 wk的胚胎肝脏标本[6-7], 采用经典的Ⅳ型胶原酶两步灌流法[5-8]分离胚胎肝细胞. 用非连续性Percoll密度梯度离心法[9-10]纯化初步分离的肝细胞. 按照比重从高至低将不同比重的SIP(Stock Isotonic Percoll)加入离心管中, 即80%(1.099 kg/L)SIP 5 mL, 70%(1.087 kg/L)SIP 5 mL, 60% SIP(1.075 kg/L)5 mL, 50% SIP(1.063 kg/L)5 mL, 45% SIP(1.057 kg/L)5 mL, 40% SIP(1.052 kg/L)5 mL, 30% SIP(1.040 kg/L)5 mL, 10% SIP(1.016 kg/L)5 mL, 最后加入3 mL 1×1010 cells/L细胞混悬液, 4℃ 1000 g离心20 min. 收集不同条带细胞悬液, 加入5倍体积的PBS, 离心洗涤细胞3次. 重悬细胞计数. 4 g/L的台盼兰染色计算细胞存活率.
将Percoll纯化后的肝细胞重悬于含100 mL/L胎牛血清的Ham's F12普通培养基(简称为: 普通培养基)或含10-7 mol/L地塞米松, 10-7 mol/L胰岛素, 10-8 mol/L胰升糖素, 50 μg/L表皮生长因子, 6.5 μg/L生长激素, 5 mg/L转铁蛋白, 0.5 mg/L亚油酸, 2 mmol/L L-谷氨酰胺, 1×107 mol/L CuSO4·5H2O, 5×10-10 mol/L ZnSO4·7H2O和3×10-8 mol/L SeO2无血清的Ham's F12条件培养基(简称为: 条件培养基)中, 于37℃, 50 mL/L CO2条件下培养[5,7]. 倒置显微镜下观察培养不同时间细胞形态特征.
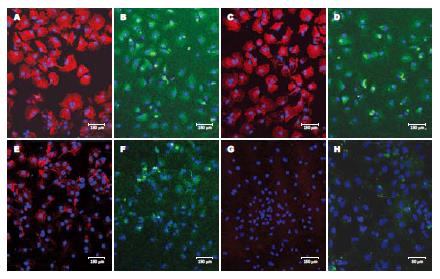
1.2.2 免疫荧光法检测胚胎肝细胞特异性抗原的表达: 人胚胎肝细胞以2×105 cells/L种植于22 mm×22 mm的盖玻片, 分别在Ham's F12普通培养基和Ham's F12条件培养基培养. 于培养24 h或7 d, 取一定数量盖玻片分别与鼠抗人CK18(1:50), 兔抗人AFP(1:200), 鼠抗人CD68(1:50), 兔抗人VWF(1:200)和鼠抗人desmin(1:50)室温孵育1 h, 并用相同浓度的非相关小鼠IgG1和正常兔IgG作为阴性对照. 二抗与羊抗兔IgG-FITC(1:200)和羊抗鼠IgG1-Texas Red(1:200)室温下孵育30 min, DAPI复染细胞核, 用激光共聚焦显微镜于不同波长处检测其红色、绿色和蓝色荧光. 在显微镜下随机选择10个视野, 至少计算200个细胞及其阳性细胞数, 计算阳性细胞比率.
1.2.3 MTT法检测不同培养条件下胚胎肝细胞增殖状态: 人胚胎肝细胞以1.5×105 cells/L接种于96孔板, 分别在Ham's F12普通培养基和Ham's F12条件培养基培养. 分别于培养6, 12, 24, 48和72 h, 及7 d采用噻唑兰染色法(MTT)测定胚胎肝细胞生长增殖状况. 用550ELISA酶标仪于570 nm处测定的吸光度(A)表示细胞活力及增殖状态, 并计算不同时间的增殖率. 细胞增殖率 = 实验组A值/对照组A值×100%
统计学处理 所有数据均为3次以上独立实验的结果. 数据处理采用SPSS10.0版统计软件完成. 计量资料用mean±SD表示, 3组以上数据单因素方差分析(One-way ANOVA), LSD, SNK法比较, 2组数据采用独立样本的t检验比较. P<0.05为具有统计学意义.
初步分离的肝细胞活力在82.01%±3.41%, 经Percoll纯化后细胞活力达97.06%±2.47%. 起初培养时肝细胞呈球形, 在Ham's F12条件培养基中培养12 h时肝细胞体积增大, 变为扁平不规则多角形(图1A). 培养24 h时细胞部分融合成片状, 胞体隆起, 呈现特异性的规则多角形形态, 增殖活跃(图1B). 培养48-72 h时绝大多数细胞融合成片状, 增殖明显活跃(图1C-D), 至培养第7天肝细胞始终呈现特异性多角形形态, 细胞活力及增殖无明显降低(图1E). 在Ham's F12普通培养基中培养12 h的肝细胞也呈现扁平不规则多角形, 与Ham's F12条件培养基相似(图1F). 但培养24 h的胚胎肝细胞胞体扁平, 色泽灰暗, 多数细胞呈成纤维细胞的形态, 细胞增殖欠佳(图1G). 培养48-72 h时细胞仍呈现成纤维细胞样形态, 部分细胞脱落坏死, 增殖明显低下(图1H-I), 至培养第7天肝细胞大多数细胞脱落坏死, 部分残留细胞仍呈现成纤维细胞样形态(图1J).
在Ham's F12条件培养基中培养24 h的胚胎肝细胞几乎100% CK18和AFP染色阳性(图2A-B), 在培养第7天时胚胎肝细胞仍100% CK18和AFP染色阳性, 但AFP表达有所减弱(图2C-D). 而在Ham's F12普通培养基中培养24 h的胚胎肝细胞仅约56%细胞CK18染色阳性, 43%细胞AFP染色阳性(图2E-F), 在培养第7天时胚胎肝细胞无明显CK18和AFP阳性染色(图2G-H). CD68, VWF和desmin, 以及阴性对照均呈现阴性染色(结果未显示).
成人肝细胞体外培养非常困难, 主要原因为在传统的培养条件下, 肝细胞不能维持其表型的稳定性, 活力和增殖能力迅速下降, 在1-2 d内失分化, 失去肝细胞特异性形态和功能[11], 因此对肝细胞体外培养体系的要求即是能够维持肝细胞分化和特异性的功能状态, 主要方法是应用不同的培养基质和添加有多种激素和生长因子的条件培养基[12]. 胚胎肝细胞具有较强的增殖能力, 但如何诱导胚胎肝细胞的成熟分化及维持胚胎肝细胞功能是亟待解决的问题. 既往研究报道一定胎龄的胚胎肝细胞是体外研究肝细胞特异基因表达的合适模型[6], 但目前关于胚胎肝细胞的培养条件尚无统一的认识. 多数文献采用无血清的条件培养基[5,7], 部分应用胶原基质和条件培养基[1]以及胶原三明治夹心培养法[11]等. 有报道认为血清能够抑制肝细胞增殖, 对肝细胞有毒性作用[13]. 但也有文献认为血清可以促进肝细胞增殖, 维持肝细胞功能和表型的稳定[14].
本研究结果显示, 在无血清而含有多种激素和生长因子的条件培养基中培养的胚胎肝细胞在培养1 wk内始终呈现肝细胞特异性的形态, 100%表达胚胎肝细胞特异性功能性抗原CK18和AFP, 且细胞增殖明显. 然而在含血清的普通培养基中培养24 h胚胎肝细胞即失去肝细胞特异性的形态, 部分呈现成纤维细胞样形态, 仅部分细胞表达胚胎肝细胞特异性抗原CK18和AFP. 从培养48 h起细胞活力逐渐下降, 部分细胞脱落坏死, 至培养第7天细胞活力及增殖明显低下, 大多数细胞脱落, 细胞呈现成纤维细胞样形态, 无胚胎肝细胞特异性抗原CK18和AFP表达. 这表明在含有血清的普通培养基中培养的胚胎肝细胞活力及增殖能力会迅速下降, 发生转分化而失去肝细胞的形态和特异性抗原的表达. 而在含有多种激素和生长因子的条件培养基中培养的胚胎肝细胞至少在培养1 wk内始终呈现肝细胞特异性的形态, 表达肝细胞特异性的抗原, 增殖明显, 活力无明显下降. 因此, Ham's F12普通培养基不适宜于胚胎肝细胞的培养, 而Ham's F12条件培养基适宜于体外胚胎肝细胞的培养.
目前有许多研究都致力于能够维持肝细胞表型和功能的条件培养基中添加成分的探索. 有文献报道地塞米松能够诱导肝细胞白蛋白的合成[15], 增强细胞色素P450活性, 与胰岛素合用还能够诱导肝细胞糖原的合成[16], 表皮生长因子能够刺激肝细胞增殖[13-14]等, 这些都是肝细胞培养体系中的主要成分. 我们应用添加有地塞米松、胰岛素、转铁蛋白、表皮生长因子、胰高血糖素和生长激素等成分的条件培养基体不仅外能够显著刺激胚胎肝细胞增殖, 而且能够维持胚胎肝细胞特异性形态和表型至少1 wk时间.
体外培养的人肝细胞在肝细胞对肝炎病毒反应的研究、外源性毒物代谢研究、药物在肝脏代谢与分布研究、肝细胞移植以及重症肝衰竭治疗等方面具有重要的应用价值[1-4]. 然而由于人肝细胞来源和培养非常困难, 目前有关肝细胞功能和应用的研究多采用HepG2、Hep3B等肝癌细胞株[17-18]和动物肝细胞[4,19], 但已有文献报道体外培养的肝癌细胞株与正常肝细胞蛋白质谱的表达有明显差异[20], 因此原代人肝细胞可能是研究肝细胞功能和应用最适当的细胞模型. 由于适当胎龄的胚胎肝细胞具有成人肝细胞的部分或全部功能[6], 且与成人肝细胞相比人胚胎肝细胞来源较多, 以及从死亡的人胚胎分离出活力较高的肝细胞可以避免伦理方面的问题等原因使获得大量的人胚胎肝细胞成为可能. 因此, 进一步确立人胚胎肝细胞体外适宜的培养条件将为未来应用胚胎肝细胞深入研究肝细胞功能奠定基础.
由于我们采用的条件培养基中添加成分较多, 尚需要进一步研究各种成分对胚胎肝细胞结构和功能的具体影响, 进一步优化培养条件, 以期获得人胚胎肝细胞的标准培养基.
总之, 我们的结果表明添加有多种激素和生长因子的Ham's F12条件培养基是一种适宜的体外培养胚胎肝细胞的培养基, 这为未来进一步研究胚胎肝细胞的功能和应用提供了基础.
体外培养的人肝细胞在肝细胞对肝炎病毒反应研究、外源性毒物代谢研究、药物在肝脏代谢与分布研究、肝细胞移植以及人工肝治疗等方面具有重要的应用价值. 但成人肝细胞来源匮乏, 体外增殖能力差, 而胚胎肝细胞来源较多, 体外增殖能力强, 且一定胎龄的胚胎肝细胞已具有成人肝细胞的功能, 是体外研究肝细胞功能和应用的良好细胞模型. 目前关于人胚胎肝细胞的培养条件少见系统报道. 研究体外适宜的人胚胎肝细胞培养基, 将为下一步研究肝细胞在科研和临床方面的应用奠定基础, 具有较广泛应用前景.
洪天配, 教授, 北京大学第三医院内分泌科.
该领域的研究热点主要集中在胚胎肝细胞体外适宜培养条件的探索、分离培养的胚胎肝细胞中细胞种类的研究、胚胎肝细胞在肝移植和生物人工肝治疗方面的研究等.
Sells与Bauer研究表明应用无血清但添加有多种激素和生长因子的条件培养基体外培养的人胚胎肝细胞能够维持肝细胞的形态, 促使胚胎肝细胞合成白蛋白和甲胎蛋白, 但未对分离的胚胎肝细胞纯度及其他蛋白的表达进行测定; Lengyel报道了人胚胎肝细胞是一种体外适宜的研究肝细胞特异基因表达的细胞模型; Lazaro研究了在含有多种激素和生长因子的条件培养基中培养不同时间的胚胎肝细胞培养体系中细胞的种类和结构.
本研究首次对两种不同培养条件下培养不同时间的胚胎肝细胞的形态、特异性蛋白的表达及细胞增殖状态进行了检测比较, 初步结果表明此种含有多种激素和生长因子的条件培养基是一种体外适宜的培养人胚胎肝细胞的培养基, 能够维持胚胎肝细胞形态和表型稳定至少1 wk时间.
本研究确立的培养条件为未来应用体外培养的胚胎肝细胞深入研究肝细胞功能和应用奠定了基础. 同样为在此条件下进一步研究各种成分对胚胎肝细胞结构和功能的具体影响, 优化培养条件, 获得人胚胎肝细胞的标准培养基提供了必要的基础.
本研究内容较新, 实用性较强, 具有很好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Lázaro CA, Croager EJ, Mitchell C, Campbell JS, Yu C, Foraker J, Rhim JA, Yeoh GC, Fausto N. Establishment, characterization, and long-term maintenance of cultures of human fetal hepatocytes. Hepatology. 2003;38:1095-1106. [PubMed] [DOI] |
| 5. | Sells MA, Chernoff J, Cerda A, Bowers C, Shafritz DA, Kase N, Christman JK, Acs G. Long-term culture and passage of human fetal liver cells that synthesize albumin. In Vitro Cell Dev Biol. 1985;21:216-220. [PubMed] [DOI] |
| 6. | Lengyel G, Joachim B, Acs G, Fehér J. Liver specific gene expressions in human fetal hepatocyte culture. Orv Hetil. 1992;133:11-15. [PubMed] |
| 7. | Bauer J, Lengyel G, Thung SN, Jonas U, Gerok W, Acs G. Human fetal hepatocytes respond to inflammatory mediators and excrete bile. Hepatology. 1991;13:1131-1141. [PubMed] |
| 8. | Seglen PO. Preparation of isolated rat liver cells. Methods Cell Biol. 1976;13:29-83. [PubMed] [DOI] |
| 9. | Radford J, Bhathal PS. Purification of fetal rat hepatocytes. Cell Biol Int Rep. 1985;9:677-688. [PubMed] [DOI] |
| 10. | Kreamer BL, Staecker JL, Sawada N, Sattler GL, Hsia MT, Pitot HC. Use of a low-speed, iso-density percoll centrifugation method to increase the viability of isolated rat hepatocyte preparations. In Vitro Cell Dev Biol. 1986;22:201-211. [PubMed] [DOI] |
| 11. | Bader A, Borel Rinkes IH, Closs EI, Ryan CM, Toner M, Cunningham JM, Tompkins RG, Yarmush ML. A stable long-term hepatocyte culture system for studies of physiologic processes: cytokine stimulation of the acute phase response in rat and human hepatocytes. Biotechnol Prog. 1992;8:219-225. [PubMed] [DOI] |
| 12. | Runge D, Michalopoulos GK, Strom SC, Runge DM. Recent advances in human hepatocyte culture systems. Biochem Biophys Res Commun. 2000;274:1-3. [PubMed] [DOI] |
| 13. | Enat R, Jefferson DM, Ruiz-Opazo N, Gatmaitan Z, Leinwand LA, Reid LM. Hepatocyte proliferation in vitro: its dependence on the use of serum-free hormonally defined medium and substrata of extracellular matrix. Proc Natl Acad Sci U S A. 1984;81:1411-1415. [PubMed] [DOI] |
| 14. | Yamamoto N, Wu J, Zhang Y, Catana AM, Cai H, Strom S, Novikoff PM, Zern MA. An optimal culture condition maintains human hepatocyte phenotype after long-term culture. Hepatol Res. 2006;35:169-177. [PubMed] |
| 15. | Woodworth CD, Isom HC. Regulation of albumin gene expression in a series of rat hepatocyte cell lines immortalized by simian virus 40 and maintained in chemically defined medium. Mol Cell Biol. 1987;7:3740-3748. [PubMed] |
| 16. | Kim HM, Han SB, Hyun BH, Ahn CJ, Cha YN, Jeong KS, Oh GT. Functional human hepatocytes: isolation from small liver biopsy samples and primary cultivation with liver-specific functions. J Toxicol Sci. 1995;20:565-578. [PubMed] |
| 17. | Yoshida T, Yamagishi S, Nakamura K, Matsui T, Imaizumi T, Takeuchi M, Ueno T, Sata M. Pigment epithelium-derived factor (PEDF) inhibits advanced glycation end product (AGE)-induced C-reactive protein expression in hepatoma cells by suppressing Rac-1 activation. FEBS Lett. 2006;580:2788-2796. [PubMed] [DOI] |