修回日期: 2008-03-07
接受日期: 2008-05-02
在线出版日期: 2008-06-18
目的: 探讨NF-κB p65反义寡核苷酸对实验性结肠炎BALB/c小鼠肠黏膜NF-κB表达的抑制作用和对黏膜肿瘤坏死因子(TNF-α)、白细胞介素(IL-10、IL-1β)表达的影响, 研究其对肠道炎症的治疗作用.
方法: 将50只BALB/c小鼠均分为模型对照组(UC组)、NF-κB p65反义寡核苷酸组(ASODN组)、错义寡核苷酸组(MSODN组)和正义寡核苷酸组(SODN组), 采用2, 4, 6-三硝基苯磺酸(TNBS)灌肠造模. 造模后24 h后对各组进行相应灌肠治疗, 灌肠后第7天处死小鼠, 行光镜下观察肠黏膜炎症并评分, 免疫组化检测各组小鼠肠黏膜中TNF-α、IL-1β、IL-10和NF-κB表达.
结果: ASODN组小鼠在结肠炎症评分较UC组、MSODN组和SODN组明显改善(均P<0.05). ASODN组小鼠TNF-α、IL-1β、NF-κB表达较UC组、MSODN组和SODN组明显减少(82.68±14.30 vs 168.48±11.89, 166.49±11.63, 176.49±12.33, P<0.05; 42.42±5.77 vs 168.48±11.89, 120.43±28.21, 131.43±30.601, P<0.01; 62.66±11.32 vs 158.38±12.49, 161.09±12.73, 168.64±11.83, P<0.01), 而IL-10表达则显著增多(146.68±6.02 vs 62.50±11.57, 58.44±10.92, 54.24±10.64, P<0.01).
结论: NF-κB p65反义寡核苷酸可抑制NF-κB的活化, 降低TNF-α、IL-1β表达, 升高IL-10的表达, 减轻小鼠结肠炎症, 可用于治疗实验性结肠炎.
引文著录: 李弼民, 吕农华, 谢勇, 陈江, 朱萱, 易静. NF-κB p65反义寡核苷酸对TNBS结肠炎小鼠肠黏膜细胞因子和NF-κB表达的影响. 世界华人消化杂志 2008; 16(17): 1926-1931
Revised: March 7, 2008
Accepted: May 2, 2008
Published online: June 18, 2008
AIM: To evaluate the effects of nuclear factor kappa B (NF-κB) p65 antisense oligonucleotide on the inflammation, expression of cytokines such as tumor necrosis factor alpha (TNF-α), interleukins (IL-1β, IL-10) and NF-κB in colonic intestinal mucosa of mice with trinitrobenzene sulfonic acid-induced colitis.
METHODS: Fifty BALB/c mice were randomly divided into model control group (UC), antisense oligonucleotide treatment group (ASOND), missense oligonucleotide treatment group (MSOND), and sense oligonucleotide treatment group (SOND). Experimental colitis was induced by trinitrobenzene sulfonic acid (TNBS)/ethanol enema. Twenty-four hours after modeling, the mice in the ASOND, MSODN and SODN groups were administered with the corresponding oligonucleotides. Inflammatory scores and mucosal morphological changes were evaluated under light microscope. The leves of TNF-α, IL-1β, IL-10 and NF-κB were determined by immunohistochemistry.
RESULTS: The inflammatory scores in the ASOND group decreased as compared with those in the UC, MSOND and SOND group (all P < 0.05). The mucosal levels of TNF-α, IL-1β and NF-κB expression in the ASOND group were significantly lower than those in the UC, MSOND and SOND groups (82.68 ± 14.30 vs 168.48 ± 11.89, 166.49 ± 11.63, 176.49 ± 12.33, P < 0.05; 42.42 ± 5.77 vs 168.48 ± 11.89, 120.43 ± 28.21, 131.43 ± 30.601, P < 0.01; 62.66 ± 11.32 vs 158.38 ± 12.49, 161.09 ± 12.73, 168.64 ± 11.83, P < 0.01), while IL-10 levels were higher (146.68 ± 6.02 vs 62.50 ± 11.57, 58.44 ± 10.92, 54.24 ± 10.64, P < 0.01).
CONCLUSION: ASOND can attenuate the inflammatory degree in mice with experimental colitis and effectively down-regulates TNF-α, IL-1β and NF-κB expression while up-regulates IL-10 secretion. .
- Citation: Li BM, Lv NH, Xie Y, Chen J, Zhu X, Yi J. Effects of NF-κB p65 antisense oligonucletide on the expression of cytokines and NF-κB in colonic intestinal mucosa of mice with TNBS-induced colitis. Shijie Huaren Xiaohua Zazhi 2008; 16(17): 1926-1931
- URL: https://www.wjgnet.com/1009-3079/full/v16/i17/1926.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i17.1926
胃随着生活水平的提高, 炎性肠病的发病呈上升趋势. 目前认为其发生与遗传、免疫、感染、环境等因素密切相关, 其中许多细胞因子在炎性肠病的发病中起重要作用, 这些细胞因子有白介素(IL-1β、IL-10), 肿瘤坏死因子(TNF-α)等, 而他们的表达又与核因子NF-κB关系密切, 其相关性也日益受到人们的重视. 我们以半抗原法建立结肠炎BALB/c小鼠模型, 评价NF-κB p65反义寡核苷酸对2, 4, 6-三硝基苯磺酸(TNBS)所致结肠炎小鼠NF-κB的抑制作用、对黏膜细胞因子表达以及对结肠炎症的影响, 从而探讨NF-κB p65反义寡核苷酸治疗结肠炎的疗效及可能机制.
BALB/c小鼠50只, 体质量20-23 g, 购自南昌大学医学院实验动物中心, 由南昌大学医学院实验动物中心饲养. 称质量、编号后, 均分为模型对照组(UC组)和NF-κB p65反义寡核苷酸组(ASODN组)、NF-κB p65错义寡核苷酸组(MSODN组), NF-κB p65正义寡核苷酸组(SODN组). TNBS(购自Sigma公司)(100 g/L)溶液, 与无水乙醇配成1:1混合液. TNF-α、IL-1β、IL-10、 NF-κB免疫组化试剂盒由Santa Cruz工程有限公司提供. NF-κB p65寡核苷酸参照Murano等设计的序列[1], 由上海Generary Bioth公司合成, 其序列为: ASODN 5'-GAAACAGATCGTCCATGGT-3', MSODN 5'-ATGGAGAATATGAAAGTG-3', SOND: 5'- ACCATGGACGATCTGTTTC-3'并全部硫代磷酸化, PAGE纯化, 纯度>99.9%.
1.2.1 造模: 造模前小鼠在动物房饲养1 wk, 按照参考文献[2-4]方法采用TNBS灌肠诱导小鼠结肠炎模型. 造模第2天(24 h后), ASODN组、MSODN组、SODN组每只小鼠各自肛门灌25 nmol ASODN、MSODN、SODN, 而UC组则灌0.5 mL生理盐水, 于灌肠后第7天处死所有存活小鼠, 收集小鼠结肠及血液.
1.2.2 光镜观察及炎症评分: 在距肛门4cm处取结肠组织, 制备石蜡切片, 行HE染色, 以盲法观察, 光镜观察肠黏膜损伤情况, 参考文献[5]方法给予评分.
1.2.3 免疫组化测定细胞因子: 取距肛门4cm小鼠肠黏膜组织2块, 常规固定、切片, 染色程序严格按试剂说明书操作. 结果评定: 阳性反应物质定位于巨噬细胞、淋巴细胞或纤维母细胞胞质内, 呈黄褐色或棕色颗粒, 弥漫分布于黏膜固有层及部分上皮内. 随机选择5个视野, 取每视野内的平均阳性细胞数作为计数标准.
统计学处理 各组数据以mean±SD表示, 应用统计软件SPSS11.0处理, 计量资料多组间比较进行方差分析, 各组间两两比较行最小显著差异t检验(LSD-检验). 以P<0.05为差异有统计学意义.
UC组、MSODN组、SODN组BALB/c小鼠在灌肠后第1天起出现不同程度的血便、稀便、少动、毛发无光泽、身体蜷缩、食量减少、体质量下降; ASODN组小鼠在灌肠后第1天出现与上述对照组小鼠相似的情况, 在ASODN灌肠后则发生变化, 出现血便、稀便等情况的小鼠减少, 仅2只小鼠出现血便、3只小鼠出现持续3 d腹泻, 活动性较UC组、MSODN组、SODN组好.
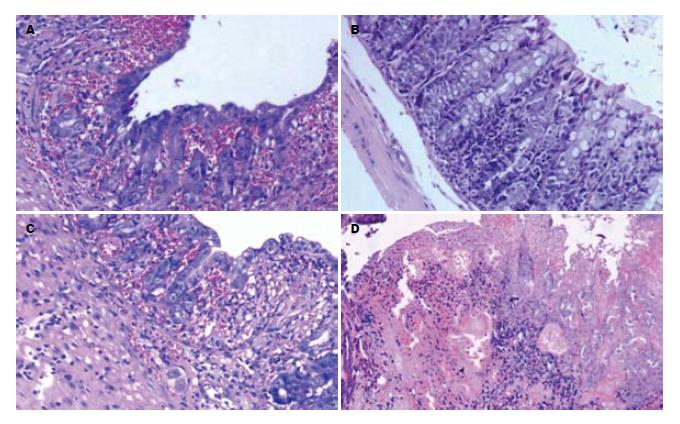
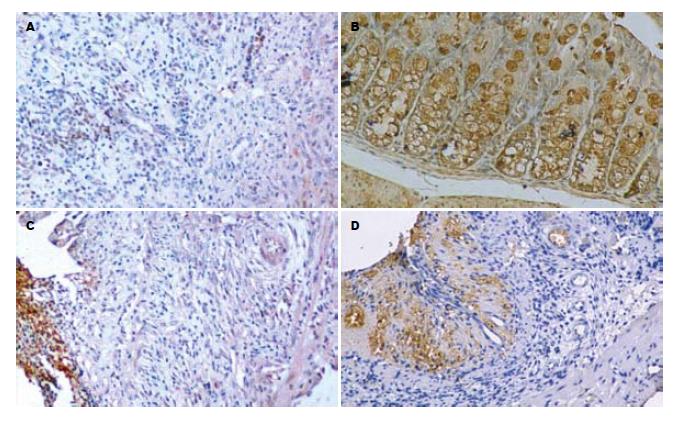
UC组、MSODN组、SODN组小鼠病变结肠连续性水肿, 肠壁明显增厚. 剪开肠壁可见黏膜有弥漫性充血、出血、糜烂, 镜下可见结肠黏膜上皮糜烂、溃疡及隐窝脓肿形成, 杯状细胞消失, 固有层中性粒细胞、淋巴细胞浸润, 最严重的见全层非局限性透壁性坏死, 肠上皮细胞坏死脱落, 甚至出现黏膜层、黏膜下层及肌层坏死脱落, 全层大量炎症细胞浸润, 隐窝变形直至破坏消失(图1A, C-D). 而ASODN组小鼠仅个别小鼠出现黏膜充血、糜烂, 所有小鼠炎症细胞浸润也明显减轻, 仅部分小鼠黏膜固有层内有少量炎性细胞浸润, 见图1B, 炎症积分较UC组、MSODN组、SODN组低(表1).
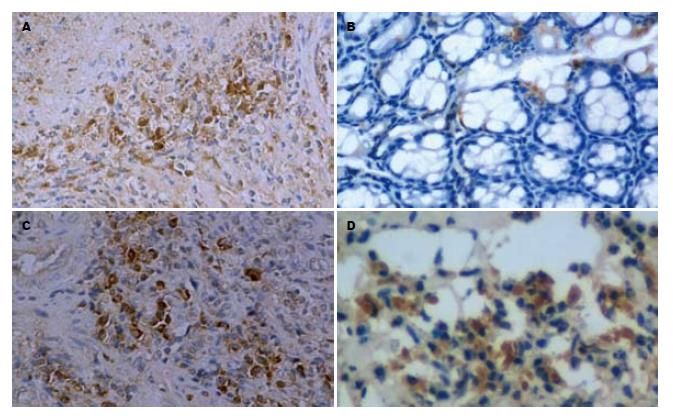
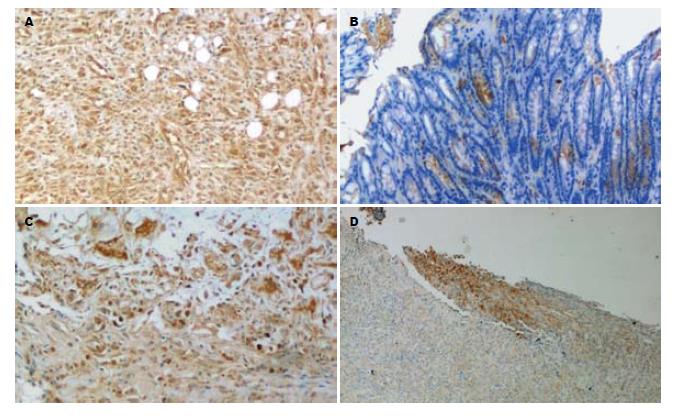
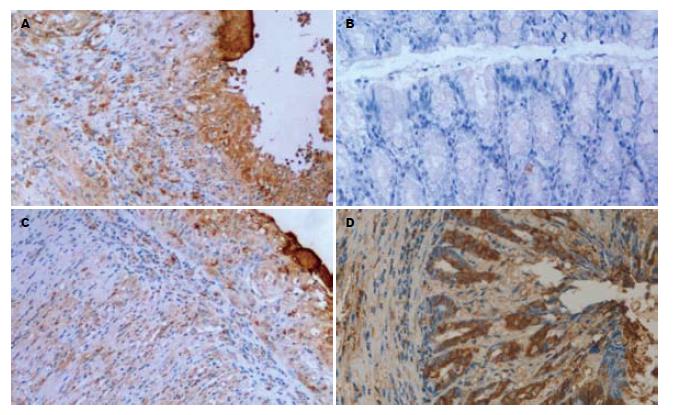
ASODN灌肠后可降低肠黏膜NF-κB、TNF-α、IL-1β表达, 提高IL-10的表达(表1). 表现为: (1)ASODN组NF-κB表达低于UC组、MSODN组、SODN组(图2); (2)ASODN组TNF-α、IL-1β表达也均低于UC组、MSODN组、SODN组(图3-4); (3)ASODN组IL-10表达高于UC组、MSODN组、SODN组(图5).
炎性肠病的病因和发病机制目前尚不明确. 大多数研究认为与免疫反应异常有关, 尤其与局部肠黏膜免疫反应异常关系密切[6-7]. 研究发现: 细胞因子、生长因子、黏附分子等均参与了肠黏膜局部的炎症和免疫反应. Akazawa, Brynskov et al证实, 在溃疡性结肠炎病人的血清或结肠黏膜内IL-1, TNF-α、IL-6, IL-8等促炎性细胞因子明显增加[8-9], 而Schottelius et al则直接证实了TNF-α、IL-1β在溃疡性结肠炎发病中的作用[9], 人们也使用抗TNF-α单克隆抗体, 重组IL-10来治疗炎性肠病并取得了一定的疗效[11-12], 这些研究进一步证明了细胞因子在IBD发生发展中所起的非常重要的作用. 由于各种细胞因子的表达均由核因子NF-κB来调控, 因而抑制NF-κB的活性可有效治疗IBD. IBD治疗药物如柳氮磺氨吡啶(SASP)和5-氨基水杨酸(5-ASA)、皮质类固醇等均直接或间接通过减少靶细胞中的IκBα来抑制NF-κB的活性, 从而减少炎症细胞因子的产生达到治疗目的[13-15]. 然而, SASP、5-ASA效果不佳及患者耐受性差则是其主要不足; 激素则有很多副作用, 如糖耐受能力降低, 肾上腺抑制、增加感染的危险性等; 因而, 寻找及研制新型炎性肠病药物, 尤其能直接抑制NF-κB活性的基因药物则成为研究热点.
甘华田 et al采用NF-κB p65反义核苷酸对溃疡性结肠炎患者肠道黏膜固有层单个核细胞进行干预, 结果发现NF-κB p65反义核苷酸可以明显减少LPS刺激引起IL-1β mRNA和IL-8 mRNA表达增强和相应细胞因子分泌水平的增高[16]. Neurath et al使用NF-κB p65反义核苷酸处理TNBS诱导的小鼠结肠炎模型, 成功地抑制了肠道的炎症[2]. 此外, Spink et al也分别使用NF-κB反义核苷酸使DSS诱导的小鼠结肠炎炎症明显缓解[17]. 上述研究表明NF-κB p65反义核苷酸抑制NF-κB活性的可行性, 且有望成为治疗炎性肠病的有效药物.
本研究成功建立了病理学特征与人类炎性肠病十分相似的TNBS BALB/c小鼠急性结肠炎模型. 小鼠经TNBS/Ethanol 灌肠后出现不同程度的血便、腹泻、体质量下降等症状, 大肠组织病理学改变发现肠黏膜弥漫性充血、出血、糜烂, 溃疡形成, 腺体破坏、炎性细胞浸润等. 而经ASODN灌肠治疗后的小鼠, 症状明显减轻, 病理组织学明显改善, 炎症积分较UC组、MSODN组和SODN组降低, 有统计学意义, 另外 ASODN组小鼠结肠TNF-α、IL-1β、NF-κB表达低于UC组、MSODN组、SODN组, 有统计学意义, 表明ASODN能通过抑制NF-κB活性, 下调促炎细胞因子的表达, 提高抑炎细胞因子的表达, 对结肠炎症的抑制作用, 与Lawrance et al的研究结果相似[18-19].
总之, 本研究证实了NF-κB p65反义寡核苷酸能抑制NF-κB的活化, 下调TNBS BALB/c小鼠结肠组织中TNF-α、IL-1β, 上调IL-10的表达, 降低病理组织学评分, 明显减轻结肠炎症. 因此NF-κB p65反义寡核苷酸可用于治疗小鼠实验性结肠炎.
炎症性肠病的病因和发病机制目前尚未完全明确, 也缺乏特异有效的治疗药物. 细胞因子在炎症性肠病发生发展中的作用己经被越来越多的研究所证实; 而细胞因子是由NF-κB所调控也得到了公认. 因此NF-κB己成为研究和开发炎症性肠病治疗新药物的靶标. 而p65作为NF-κB重要的亚基, 在调控靶基因的转录中起着关键性的作用. p65反义寡核苷酸能与mRNA互补杂交形成双股螺旋结构, 因此采用p65反义寡核苷酸能抑制p65 mRNA的成熟及翻译表达功能, 减少p65蛋白的合成, 阻断及抑制NF-κB的产生、活化, 最终可减少细胞因子的释放, 这些无疑对溃疡性结肠炎具有十分重要的治疗价值.
管冬元, 副教授, 上海中医药大学基础医学院实验中医学教研室
甘华田 et al采用NF-kB p65反义核苷酸对溃疡性结肠炎患者肠道黏膜固有层单个核细胞进行干预, 结果发现NF-kB p65反义核苷酸可以明显减少LPS刺激引起IL-1b mRNA和IL-8 mRNA表达增强和相应细胞因子分泌水平的增高.
本文结果显示应用反义寡核苷酸技术研究NF-κB基因得到抑制后, 小鼠实验性结肠炎病理状况明显得到改善, 对于从分子治疗探讨方面做了有益的研究, 选题与研究思路较新颖.
本研究探讨了NF-κB p65 ASODN对三硝基苯磺钠(TNBS)结肠炎模型的的治疗作用, 为寻找一种新的, 具有开发潜力的治疗IBD的新药提供实验论据.
本文立题新颖, 观点论述较合理, 具有较好的学术价值.
编辑: 李军亮 电编:郭海丽
| 1. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] [DOI] |
| 2. | Neurath MF, Pettersson S, Meyer zum Buschenfelde KH, Strober W. Local administration of antisense phosphorothioate oligonucleotides to the p65 subunit of NF-kappa B abrogates established experimental colitis in mice. Nat Med. 1996;2:998-1004. [PubMed] [DOI] |
| 3. | Menozzi A, Pozzoli C, Poli E, Lazzaretti M, Grandi D, Coruzzi G. Long-term study of TNBS-induced colitis in rats: focus on mast cells. Inflamm Res. 2006;55:416-422. [PubMed] [DOI] |
| 4. | te Velde AA, Verstege MI, Hommes DW. Critical appraisal of the current practice in murine TNBS-induced colitis. Inflamm Bowel Dis. 2006;12:995-999. [PubMed] [DOI] |
| 5. | McCarthy J, O'Mahony L, O'Callaghan L, Sheil B, Vaughan EE, Fitzsimons N, Fitzgibbon J, O'Sullivan GC, Kiely B, Collins JK. Double blind, placebo controlled trial of two probiotic strains in interleukin 10 knockout mice and mechanistic link with cytokine balance. Gut. 2003;52:975-980. [PubMed] [DOI] |
| 6. | Baumgart DC, Carding SR. Inflammatory bowel disease: cause and immunobiology. Lancet. 2007;369:1627-1640. [PubMed] [DOI] |
| 7. | Scaldaferri F, Fiocchi C. Inflammatory bowel disease: progress and current concepts of etiopathogenesis. J Dig Dis. 2007;8:171-178. [PubMed] [DOI] |
| 8. | Akazawa A, Sakaida I, Higaki S, Kubo Y, Uchida K, Okita K. Increased expression of tumor necrosis factor-alpha messenger RNA in the intestinal mucosa of inflammatory bowel disease, particularly in patients with disease in the inactive phase. J Gastroenterol. 2002;37:345-353. [PubMed] [DOI] |
| 9. | Melgar S, Yeung MM, Bas A, Forsberg G, Suhr O, Oberg A, Hammarstrom S, Danielsson A, Hammarstrom ML. Over-expression of interleukin 10 in mucosal T cells of patients with active ulcerative colitis. Clin Exp Immunol. 2003;134:127-137. [PubMed] [DOI] |
| 10. | Schottelius AJ, Baldwin AS Jr. A role for transcription factor NF-kappa B in intestinal inflammation. Int J Colorectal Dis. 1999;14:18-28. [PubMed] [DOI] |
| 11. | Stack WA, Mann SD, Roy AJ, Heath P, Sopwith M, Freeman J, Holmes G, Long R, Forbes A, Kamm MA. Randomised controlled trial of CDP571 antibody to tumour necrosis factor-alpha in Crohn's disease. Lancet. 1997;349:521-524. [PubMed] [DOI] |
| 12. | Kam LY, Targan SR. Cytokine-based therapies in inflammatory bowel disease. Curr Opin Gastroenterol. 1999;15:302-307. [PubMed] [DOI] |
| 13. | Scheinman RI, Cogswell PC, Lofquist AK, Baldwin AS Jr. Role of transcriptional activation of I kappa B alpha in mediation of immunosuppression by glucocorticoids. Science. 1995;270:283-286. [PubMed] [DOI] |
| 14. | Auphan N, DiDonato JA, Rosette C, Helmberg A, Karin M. Immunosuppression by glucocorticoids: inhibition of NF-kappa B activity through induction of I kappa B synthesis. Science. 1995;270:286-290. [PubMed] [DOI] |
| 15. | Weber CK, Liptay S, Wirth T, Adler G, Schmid RM. Suppression of NF-kappaB activity by sulfasalazine is mediated by direct inhibition of IkappaB kinases alpha and beta. Gastroenterology. 2000;119:1209-1218. [PubMed] [DOI] |
| 16. | Gan H, Ouyang Q, Chen Y, Liang F. The effects of nuclear factor-kappa B p65 antisense oligonucleotides on expression of proinflammatory cytokines in lamina propria mononuclear cells from patients with ulcerative colitis. Shengwu Yixue Gongchengxue Zazhi. 2003;20:268-272. [PubMed] |
| 17. | Spiik AK, Ridderstad A, Axelsson LG, Midtvedt T, Bjork L, Pettersson S. Abrogated lymphocyte infiltration and lowered CD14 in dextran sulfate induced colitis in mice treated with p65 antisense oligonucleotides. Int J Colorectal Dis. 2002;17:223-232. [PubMed] [DOI] |
| 18. | Lawrance IC, Wu F, Leite AZ, Willis J, West GA, Fiocchi C, Chakravarti S. A murine model of chronic inflammation-induced intestinal fibrosis down-regulated by antisense NF-kappa B. Gastroenterology. 2003;125:1750-1761. [PubMed] [DOI] |
| 19. | Segain JP, Raingeard de la Bletiere D, Sauzeau V, Bourreille A, Hilaret G, Cario-Toumaniantz C, Pacaud P, Galmiche JP, Loirand G. Rho kinase blockade prevents inflammation via nuclear factor kappa B inhibition: evidence in Crohn's disease and experimental colitis. Gastroenterology. 2003;124:1180-1187. [PubMed] [DOI] |