修回日期: 2008-03-14
接受日期: 2008-05-02
在线出版日期: 2008-06-18
目的: 探讨慢性乙型肝炎患者外周血树突状细胞中干扰素调节因子3(interferon regulate factor 3, IRF3)在HBV诱导的抗病毒免疫反应中的表达及作用.
方法: 选取HBeAg阳性的慢性乙型肝炎患者28例, 健康对照者27例, 用免疫磁珠细胞分选(MACS)法获得纯化的CD14+单核细胞, RPMI 1640培养基培养, 用hGM-CSF、hIL-4诱导单核细胞成为未成熟的MoDC, 加入PolyI:C刺激, 获得成熟的MoDC. PolyI:C刺激后0、12、24、48 h收集细胞培养的上清液及细胞, Real-Time PCR法检测IRF3和Toll样受体3(TLR3)的表达, ELISA方法检测MoDC细胞上清液中IFN-b的浓度变化.
结果: 12 h健康对照组MoDC中IRF3 mRNA表达水平明显升高, 并达高峰与0 h相比差异显著(P<0.05), 24、48 h表达逐渐下降. 而患者组MoDC中IRF3 mRNA的表达上升不明显. 24 h健康对照组MoDC中TLR3表达上调显著(86.27%±14.74% vs 70.78%±11.16%, P<0.05), 48 h TLR3表达与0 h相比无显著性差异, 而患者组0、12、24 h TLR3表达上调不明显, 48 h TLR3表达上调显著(85.46%±6.87% vs 69.17%±20.43%, P<0.05). 健康对照组IFN-β mRNA表达及细胞上清液中的浓度与0 h相比显著升高(P<0.05), 较患者组0、12、24和48 h IFN-β的表达显著升高(P<0.05).
结论: HBV慢性感染患者在感染病毒后不能激活IRF3从而导致宿主不能分泌足够的IFN-β以清除病毒, 这可能是HBV慢性持续感染的原因之一.
引文著录: 安宝燕, 谢青, 王晖, 贾妮娜, 沈怀诚, 蔡伟, 俞红, 郭清. 干扰素调节因子3在慢性乙型肝炎患者外周血树突状细胞中的表达及意义. 世界华人消化杂志 2008; 16(17): 1873-1879
Revised: March 14, 2008
Accepted: May 2, 2008
Published online: June 18, 2008
AIM: To elucidate the roles of interferon regulatory factor-3 (IRF3) of peripheral blood dendritic cells (DCs ) in immune response induced by hepatitis B virus (HBV) .
METHODS: Monocytes CD14+ were separated in 28 chronic HBV-infected patients (CH) group and 27 healthy volunteers group (control group) using magnetic activated cell sorting. Then, monocytes were placed on a culture medium of RPMI 1640, which were later induced into premature MoDC using hGM-CSF and hIL-4. We stimulated DCs with PolyI:C. The mRNA expressions of IRF3, TLR3 and IFN-β were detected using real time PCR, TLR3 expression was detected using flow cytometry and levels of IFN-β in supernatant were evaluated by ELISA.
RESULTS: In the control group, there was significant elevation of IRF3 and IFN-β level at 12 h following stimulation of PolyI:C compared with that at 0 h. Expression level of IRF3 rose and then declined gradually at 24h and 48 h (86.27% ± 14.74% vs 70.78% ± 11.16%, P < 0.05). In CH group, there was no significant up-regulation of TLR 3 at 0, 12, 24 h while a significant up-regulation was observed at 48 h (85.46% ± 6.87% vs 69.17% ± 20.43%, P < 0.05). The concentration of IFN-β had no significant changes at 0 h, 12 h, 24 h and 48 h in CH groups, while there was a significant higher up-regulation of IFN-β mRNA expression level at 0, 12, 24 h in the control group than in CH group (P < 0.05).
CONCLUSION: Chronic HBV-infected patients fail to activate IRF 3 following virus contraction and thereby are unable to secrete enough IFN-β to eradicate HBV virus, which may partly contribute to persistent infection of HBV.
- Citation: An BY, Xie Q, Wang H, Jia NN, Shen HC, Cai W, Yu H, Guo Q. Expression and significance of interferon regulatory factor 3 of peripheral blood dendritic cells in HBV-infected patients. Shijie Huaren Xiaohua Zazhi 2008; 16(17): 1873-1879
- URL: https://www.wjgnet.com/1009-3079/full/v16/i17/1873.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i17.1873
胃乙型肝炎病毒(hepatitis B virus, HBV)感染具有很高的发病率和死亡率, 是引起肝硬化及肝癌最常见的原因之一[1]. HBV感染后导致的慢性乙型肝炎(chronic hepatitis B, CHB)临床上治疗困难, 其发病机制尚未阐明, 因此对慢性HBV感染的免疫机制研究尤为重要. 目前, 国内外研究认为在HBV持续感染中, 宿主免疫应答异常是其主要的发病机制. 正确调节宿主免疫应答, 可以促进HBV持续感染患者对病毒的清除[2]. HBV感染后病毒在复制中产生的基因组DNA、RNA或dsRNA能够被宿主的模式识别受体(PRRs)识别, 然后PRRs激发了有效的、适当的抗病毒免疫反应, 包括产生各种细胞因子, 诱导炎性细胞因子和适应性免疫反应[3]. 目前研究认为, HBV复制过程中产生dsRNA可以与TLR3结合, 然后激活其下游信号传导途径, 通过干扰素调节因子3、7的协同激活, 在转录水平对IFN-β的表达进行调节, 启动抗病毒免疫[4-6]. 缺乏IRF3和IRF7的基因敲除小鼠, 在抗病毒的反应过程中, IFN-β的产生明显下降, 提示IRF3、IRF7在抗病毒的反应过程中起至关重要的作用[7-9]. 然而目前为止还没有研究报道在HBV感染后诱导的抗病毒免疫反应中IRF3的表达及作用, 以及IFN-β的分泌是否异常. 本研究探讨dsRNA(PolyI:C)刺激末成熟的单核细胞来源的树突状细胞(monocyet dendritic cell, MoDC), 检测IRF3的表达、IFN-β的分泌状态, 以及其上游受体TLR3的表达, 为进一步了解CHB的免疫发病机制提供实验依据.
选择2005-07/2007-02上海交通大学医学院附属瑞金医院门诊就诊的慢性乙型肝炎(CHB)患者28例, 按中华医学会肝病学分会、中华医学会感染病学分会联合制定的《2005年慢性乙型肝炎防治指南》诊断标准[10], 男女比例为3:1, 年龄19-50(平均32.1)岁. 肝功能异常以血清丙氨酸氨基转移酶(ALT)升高为主(67-432 IU/L), 平均149.96±87.53; 胆红素水平<51.3 μmol/L; HBV血清标志物均为HBsAg、HBeAg、抗-HBc阳性, HBV DNA定量范围为1.0×109 copies/L-2.35×1011 copies/L, 平均8.65±2.47×1010 copies/L. 所有患者在就诊前6 mo内未接受干扰素、拉米夫定、胸腺素(肽)等抗病毒或免疫调节药物治疗; 排除合并HAV、HCV、HEV、HIV、TTV等病毒感染, 排除自身免疫相关的其他疾病. 27名健康志愿者作为正常对照, 平均年龄30.4(18-60)岁, 排除各系统其他疾病, 无酗酒史, 最近6 wk内无感染、未服用抗生素, 肝功能正常.
1.2.1 外周血单核细胞(monocyte, Mo)分离、培养: 无菌采集患者及健康志愿者外周血20 mL, 淋巴细胞分离液分离出外周血单个核细胞, 获得PBMC, 进行细胞计数, 用适量PBS重悬沉淀细胞(80 μL/L×107个细胞), 用MACS(Miltenyi Biotec, Bergisch Gladbach, Germany)法获得纯化的CD14+的细胞. 以RPMI 1640完全培养基悬浮细胞, 每孔约1×106个细胞, 并按照每孔2 mL培养液的量加入hGM-CSF(Pepro Tech )500 kU/L、hIL-4(Pepro Tech)250 kU/L, 混匀后依次加入12孔培养板, 做好时间、日期等标记, 置于37℃, 50 mL/L CO2培养箱中培养. 于培养第5天在培养液中加入PolyI:C(浓度25 mg/L)继续置37℃, 50 mL/L CO2培养箱培养, 分别于0、12、24、48 h收集各孔细胞和培养上清.
1.2.2 Real-Time PCR检测IRF3、IFN-β和TLR3: 取1-2×106个MoDC抽提RNA, 用RNA逆转录试剂盒(Promega. Co)将RNA逆转录为cDNA, -20℃保存. Real-Time PCR用Sybr Green半定量法, Sybr Green荧光定量PCR试剂盒购自Applied Biosystems公司, 以GAPDH为内参, 每个样品同一引物设双复孔, 每次扩增均设阴性对照与阳性对照, 引物序列见表1.
| 目的基因 | 引物序列 | 产物长度(bp) | |
| IRF3 | Upper | 5'-GTG CCG GGG GAA GAG TGG GAG TTC-3' | 248 |
| Lower | 5'-TGC CCG GCC CGC CAG AGA-3' | ||
| TLR3 | Upper | 5'-GAGAGTGCCGTCTATTTGCCACAC-3' | 300 |
| Lower | 5'-GCGGCTGGTAATCTTCTGAGTTGA-3' | ||
| IFN-β | Upper | 5'-GAC GCC GCA GTG ACC ATC TAT-3' | 243 |
| Lower | 5'-CCCT CCT TGG CCT TCA GGT AAT G-3' | ||
| GAPDH | Upper | 5'-GAA GGT GAA GGT CGG AGT-3' | 228 |
| Lower | 5'-GAA GAT GGT GAT GGG ATT TC-3' | ||
1.2.3 细胞因子检测: 收集的MoDC培养上清液, 按酶联免疫吸附剂测定ELISA试剂盒说明检测IFN-β含量. 细胞因子检测步骤: (1)首先准备检测样品及试剂, 将检测样品及试剂平衡至室温. 20 mL 25×浓缩洗涤液用ddH2O稀释至500 mL, 放置室温备用. (2)用标准品稀释液配制一系列标准品. (3)按顺序每孔加入200 mL阴性对照、标准品、细胞上清液样品. (4)用试剂盒附带的粘纸覆盖. 室温孵育2 h. 记录样品与标准品的位置. (5)洗板. (6)每孔加辣根过氧化物酶结合的二抗200 mL, 室温孵育1 h. (7)等体积混合底物溶液A、B, 按每孔200 mL制备, 15 min内用完, 避光保存. (8)洗板. (9)每孔加入底物溶液200 mL, 避光、室温孵育30 min. (10)每孔加入终止液50 mL, 轻轻敲打反应板使其混匀. 30 min内检测吸光度, 在450 nm读板, 在540 nm波长校正, 用四参数对数曲线法建立标准曲线.
1.2.4 流式细胞仪检测TLR3的表达: 收集培养的MoDC, 每个标本均设定一同型对照管. 每管细胞数约5×105-1×106, 用40 g/L多聚甲醛固定10 min, 加入0.1%皂素常温孵育5 min破膜, 然后加入不同荧光标记的抗体(避光): 同型对照管分别加入PE-mouse IgG2b 15 μL(20 mL/1×106); 检测管同时加PE-抗人TLR3标记抗体, 常温、避光孵育30 min. 最后加入200 mL 10 g/L多聚甲醛代替PBS固定、送检.
统计学处理 用SPSS12.0统计软件计算各项观察指标的均数和标准差, 采用ONE-WAY ANOVA检验检测, P<0.05为差异有显著性.
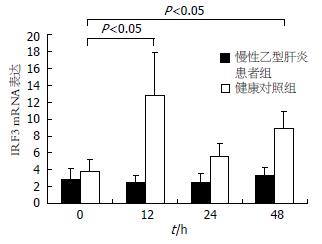
经PolyI:C刺激后0 h二组MoDC上IRF3 mRNA的表达无显著性差异(P>0.05). 在12 h对照组MoDC中IRF3 mRNA的表达上调到12.80±5.11, 与0 h相比升高显著(P<0.05), 而24 h、48 h IRF3 mRNA表达分别为5.57±3.50、8.85±4.05, 表达水平较12h虽有下降但是48 h IRF3 mRNA的表达仍然显著高于0 h(P<0.05). 患者组MoDC经PolyI:C刺激后12、24、48 h IRF3 mRNA的表达没有上升, 与0 h相比没有显著性差异(P<0.05, 图1). 患者组与对照组IRF3 mRNA在不同时间点的变化趋势, 对照组MoDC经PolyI:C刺激后12 h IRF3 mRNA的表达显著上升(P<0.05). 患者组IRF3 mRNA的表达没有随着PolyI:C的刺激而上调(图2).
(1)Real-Time PCR检测TLR3 mRNA的表达. 患者组与对照组0 h TLR3 mRNA的表达分别是0.042±0.020和0.115±0.062, 虽然对照组TLR3 mRNA表达较患者组高但两组比较无显著性差异(P>0.05). 与流式细胞仪检测结果一致, 患者组12、24 h TLR3 mRNA的表达上升不明显, 而48 h的表达水平为0.260±0.080, 较0 h表达水平显著上升(P<0.05). 而对照组TLR3 mRNA的表达于12 h达到高峰, 为0.335±0.107, 较0 h表达水平显著上升(P<0.05), 显著高于患者组0、12、24 h TLR3 mRNA的表达水平(表2). (2)流式细胞仪检测MoDC上TLR3的表达. 二组MoDC经PolyI:C刺激后于0、12、24、48 h用流式细胞仪检测TLR3的表达(表3). 患者组与对照组0 h TLR3的表达分别为69.17%±20.43%和70.78%±11.16%, 两组相比较无显著性差异(P>0.05). 患者组MoDC经PolyI:C刺激后12、24 h TLR3的表达上升不明显, 而在48 h TLR3的表达显著升高, 表达量为85.46%±6.87%, 与0 h相比有显著性差异(P<0.05). 健康对照组MoDC经PolyI:C刺激后于0 h时TLR3表达为70.78%±11.16%与患者组相近, 经PolyI:C刺激后12 h TLR3的表达为67.49%±20.89%, 与0 h相比无显著性差异, 而24 h时TLR3表达明显增加(86.27%±14.74%), 表达率较患者组提前达高峰, 48 h后TLR3表达逐渐下降, 与24 h相比有显著性差异(P<0.05, 图2).
当dsRNA与MoDC上的受体结合后, 最终可以使IFN-β的分泌增加, 从而启动天然免疫及特异性抗病毒免疫反应清除病毒, 所以最后我们检测了IFN-β的分子水平及蛋白质水平的表达.
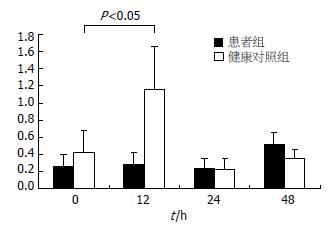
2.3.1 Real-Time PCR检测IFN-β mRNA的表达: 经PolyI:C刺激后0 h二组MoDC上IFN-β mRNA的表达无显著性差异(P>0.05). 在12 h对照组MoDC中IFN-β mRNA表达显著上调(1.16±0.50), 与0 h相比差异具有显著性(P<0.05). 患者组IFN-β mRNA 0 h表达水平非常低, 并且经PolyI:C刺激后12、24、48 h IFN-β mRNA的表达分别为0.28±0.14、0.24±0.11、0.52±0.13, 与0 h相比较几乎没有变化(P>0.05, 图3).
对照组MoDC受到PolyI:C刺激后12 h IFN-β mRNA的表达显著上升(P<0.05), 在24、48 h逐渐恢复到0 h水平, 患者组MoDC受到PolyI:C刺激后48 h IFN-β mRNA的表达虽有上调, 但是与0 h相比没有统计学意义(P>0.05).
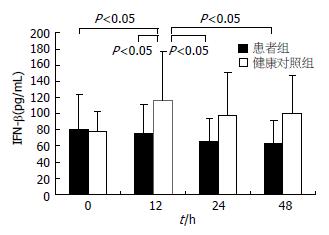
2.3.2 MoDC细胞培养上清液中IFN-β的浓度变化: MoDC经PolyI:C刺激后于0、12、24、48 h保留其细胞培养的上清液, 用ELISA法检测细胞上清液中IFN-β的浓度. 二组0 h的IFN-β的浓度分别为: 80.71±42.60 ng/L、78.21±23.89 ng/L, 二组表达水平相近(P>0.05). 健康对照者在12 h IFN-β的浓度与0 h相比明显上升, 有显著性差异(P<0.05), 较患者组0、12、24、48 h IFN-β的表达显著升高(P<0.05). 患者组12、24、48 h IFN-β的浓度分别为75.28±35.22 ng/L、64.69±29.62 ng/L、62.63±28.72 ng/L, 与0 h相比表达水平没有显著变化(图4).
二组MoDC经PolyI:C刺激后于0、12、24、48 h用ELISA方法检测MoDC培养上清液中IFN-β的浓度, 二组0 h的IFN-β的浓度相近, 患者组12、24、48 h IFN-β的浓度与0 h相比表达水平没有明显上升, 而健康对照组在12 h IFN-β的浓度上升明显与0 h相比较有显著性差异, 较患者组0、12、24、48 h IFN-β的表达显著升高(P<0.05).
Ⅰ类干扰素在宿主的抗病毒免疫中起关键作用. 当病毒复制过程中产生dsRNA与TLR3结合, 然后激活其下游信号传导途径, 诱导干扰素产生, 启动抗病毒免疫. TLR3的信号传导包括两条途径, 即MyD88依赖和非依赖途径[11-15]. MyD88非依赖途径主要通过IRF3磷酸化, 形成二聚体, 进入细胞核内诱导目标基因IFN-β的转录、表达[16-17].
IRF3属于一种磷酸化的蛋白, 持续表达在所有的细胞中, 主要以无功能的形式(Ⅰ型、Ⅱ型)存在细胞质中[18-19]. 他具有一个氨基末端, 包含多个色氨酸, 是DNA结合结构域, 和一个羧基末端是IRF结合结构域(IAD)及转录激活结构域. IRF3的转录活性是由羧基末端丝氨酸及苏氨酸磷酸化来控制的[20-22]. 病毒在复制过程中产生的dsRNA可以激活TLR3, TLR3激活TBK1, TBK1使IRF-3的羧基末端丝氨酸残基磷酸化, 磷酸化的IRF-3从细胞质转移到细胞核内. 然后IRF3与干扰素刺激的反应成份(IFN-Stimulated response elements, ISRES)诱导目标基因包括ISG56, IFN-β的转录、激活[23-26]. 有报道表明当敲除IRF-3基因的小鼠胚胎纤维原细胞(MEFs)被新城疫病毒(NDV)感染后, IFN-α/β基因表达低下. 缺乏IRF3的基因敲出小鼠, 在抗病毒的反应过程中, IFN-β的产生明显下降, 提示IRF3在抗病毒的反应过程中起至关重要的作用[27-28]. 本研究通过RT-PCR方法检测IRF3, 结果发现患者组MoDC经PolyI:C刺激后12、24、48 h IRF3 mRNA的表达没有明显上调, 这与TBK1 mRNA的检测结果一致, 表明患者组IRF3不能受到有效的信号激活. 提示, 患者组IRF3不能被磷酸化, 不能进入细胞核内诱导目标基因的转录、激活. 健康对照组MoDC经PolyI:C刺激后12 h IRF3 mRNA的表达水平显著升高, 而24、48 h IRF3 mRNA表达水平较12 h虽有下降但是48 h IRF3 mRNA的表达仍然显著高于0 h, 提示健康对照组TBK1可以使IRF-3的羧基末端丝氨酸残基磷酸化, IRF-3形成二聚体, 进入细胞核内, 诱导目标基因IFN-β的转录、激活[29-30].
为了进一步了解患者组IRF3表达低下的原因, 我们分别用Real-Time PCR和流式细胞仪法检测了TLR3的表达, 结果发现在健康对照组中MoDC经PolyI:C(25 mg/L)刺激后24 h TLR3表达上调显著(P<0.05), 48 h TLR3表达减少, 与0 h相比无显著性差异, 而患者组的0、12、24 h TLR3的表达上调不明显, 48 h TLR3表达上调显著(P<0.05). 患者组IRF3 mRNA的表达在48 h没有上升, 而TLR3的表达上升, 提示: IRF3表达低下可能存在另外的机制, 需要进一步研究. 患者组细胞培养液中IFN-β的浓度检测结果及DC细胞中IFN-β mRNA的检测结果与IRF3结果一致, 即IFN-β的浓度在PolyI:C刺激后各个时间点无显著性变化. 上述结果说明患者组dsRNA与TLR3结合后IRF3表达障碍, 最终不能激活IFN-β的转录、表达, MoDC分泌IFN-β的能力低下.
上述结果表明慢性乙型肝炎患者IRF3表达异常, 阻断了抗病毒的信号传导, 引起干扰素分泌异常, MoDC不能分化成熟、抗原递呈功能受损, 从而不能有效的诱导天然免疫、激活特异性抗病毒免疫反应, 使HBV感染后出现免疫耐受或者免疫清除障碍, 最终导致HBV持续感染.
乙型肝炎病毒(HBV)感染具有很高的发病率和死亡率, 是引起肝硬化及肝癌最常见的原因之一. HBV感染后导致的慢性乙型肝炎(CHB)临床上治疗困难, 其发病机理尚未阐明, 因此对慢性HBV感染的免疫机制研究尤为重要.
秦波, 教授, 重庆医科大学附属第二医院感染病科
HBV复制过程中产生dsRNA可以与TLR3结合, 然后激活其下游信号传导途径, 通过干扰素调节因子3、7的协同激活, 在转录水平对IFN-b的表达进行调节, 启动抗病毒免疫.
缺乏IRF3和IRF7的基因敲除小鼠, 在抗病毒的反应过程中, IFN-b的产生明显下降, 提示IRF3、 IRF7在抗病毒的反应过程中起至关重要的作用.
本研究通过对慢性乙型肝炎患者DC中IRF3、TLR3、IFN-b的研究发现HBV慢性感染患者在感染病毒后不能激活IRF3从而导致宿主不能分泌足够的IFN-b以清除病毒, 这可能是HBV慢性持续感染的原因之一.
本研究探讨dsRNA(PolyI:C)刺激末成熟的单核细胞来源的树突状细胞, 检测IRF3的表达、IFN-b的分泌状态, 以及其上游受体TLR3的表达, 为进一步了解CHB的免疫发病机制提供实验依据.
实时荧光定量PCR技术: 指在PCR反应体系中加入荧光基团, 利用荧光信号积累实时监测整个PCR进程, 最后通过标准曲线对未知模板进行定量分析的方法, 已广泛用于基因表达研究、转基因研究、病原体定量检测、疾病分类及其发病机制等生命科学领域.
本研究设计合理, 方法得当, 结果可信, 具有较好的理论和实际意义.
编辑: 李军亮 电编:郭海丽
| 1. | Wu GY, Chen HS. Novel approaches towards conquering hepatitis B virus infection. World J Gastroenterol. 2007;13:830-836. [PubMed] |
| 2. | Takeda K, Akira S. Toll-like receptors in innate immunity. Int Immunol. 2005;17:1-14. [PubMed] [DOI] |
| 3. | Krishnan J, Selvarajoo K, Tsuchiya M, Lee G, Choi S. Toll-like receptor signal transduction. Exp Mol Med. 2007;39:421-438. [PubMed] |
| 4. | Alexopoulou L, Holt AC, Medzhitov R, Flavell RA. Recognition of double-stranded RNA and activation of NF-kappaB by Toll-like receptor 3. Nature. 2001;413:732-738. [PubMed] [DOI] |
| 5. | Fitzgerald KA, McWhirter SM, Faia KL, Rowe DC, Latz E, Golenbock DT, Coyle AJ, Liao SM, Maniatis T. IKKepsilon and TBK1 are essential components of the IRF3 signaling pathway. Nat Immunol. 2003;4:491-496. [PubMed] [DOI] |
| 6. | Schulz O, Diebold SS, Chen M, Naslund TI, Nolte MA, Alexopoulou L, Azuma YT, Flavell RA, Liljestrim P, Reis e Sousa C. Toll-like receptor 3 promotes cross-priming to virus-infected cells. Nature. 2005;433:887-892. [PubMed] [DOI] |
| 7. | Grandvaux N, tenOever BR, Servant MJ, Hiscott J. The interferon antiviral response: from viral invasion to evasion. Curr Opin Infect Dis. 2002;15:259-267. [PubMed] |
| 8. | Moynagh PN. TLR signalling and activation of IRFs: revisiting old friends from the NF-kappaB pathway. Trends Immunol. 2005;26:469-476. [PubMed] [DOI] |
| 9. | Sharma S, tenOever BR, Grandvaux N, Zhou GP, Lin R, Hiscott J. Triggering the interferon antiviral response through an IKK-related pathway. Science. 2003;300:1148-1151. [PubMed] [DOI] |
| 11. | Brikos C, O'Neill LA. Signalling of toll-like receptors. Handb Exp Pharmacol. 2008;21-50. [PubMed] [DOI] |
| 12. | Salaun B, Romero P, Lebecque S. Toll-like receptors' two-edged sword: when immunity meets apoptosis. Eur J Immunol. 2007;37:3311-3318. [PubMed] [DOI] |
| 13. | Akira S, Takeda K. Toll-like receptor signalling. Nat Rev Immunol. 2004;4:499-511. [PubMed] [DOI] |
| 14. | Takeda K, Akira S. TLR signaling pathways. Semin Immunol. 2004;16:3-9. [PubMed] [DOI] |
| 15. | Kawai T, Akira S. Signaling to NF-kappaB by Toll-like receptors. Trends Mol Med. 2007;13:460-469. [PubMed] [DOI] |
| 16. | Takeuchi O, Akira S. Recognition of viruses by innate immunity. Immunol Rev. 2007;220:214-224. [PubMed] [DOI] |
| 17. | Jiang Z, Mak TW, Sen G, Li X. Toll-like receptor 3-mediated activation of NF-kappaB and IRF3 diverges at Toll-IL-1 receptor domain-containing adapter inducing IFN-beta. Proc Natl Acad Sci U S A. 2004;101:3533-3538. [PubMed] [DOI] |
| 18. | Peters KL, Smith HL, Stark GR, Sen GC. IRF-3-dependent, NFkappa B- and JNK-independent activation of the 561 and IFN-beta genes in response to double-stranded RNA. Proc Natl Acad Sci U S A. 2002;99:6322-6327. [PubMed] [DOI] |
| 19. | Juang YT, Lowther W, Kellum M, Au WC, Lin R, Hiscott J, Pitha PM. Primary activation of interferon A and interferon B gene transcription by interferon regulatory factor 3. Proc Natl Acad Sci U S A. 1998;95:9837-9842. [PubMed] [DOI] |
| 20. | McWhirter SM, Fitzgerald KA, Rosains J, Rowe DC, Golenbock DT, Maniatis T. IFN-regulatory factor 3-dependent gene expression is defective in Tbk1-deficient mouse embryonic fibroblasts. Proc Natl Acad Sci U S A. 2004;101:233-238. [PubMed] [DOI] |
| 21. | Mori M, Yoneyama M, Ito T, Takahashi K, Inagaki F, Fujita T. Identification of Ser-386 of interferon regulatory factor 3 as critical target for inducible phosphorylation that determines activation. J Biol Chem. 2004;279:9698-9702. [PubMed] [DOI] |
| 22. | Servant MJ, ten Oever B, LePage C, Conti L, Gessani S, Julkunen I, Lin R, Hiscott J. Identification of distinct signaling pathways leading to the phosphorylation of interferon regulatory factor 3. J Biol Chem. 2001;276:355-363. [PubMed] [DOI] |
| 23. | Kim T, Kim TY, Song YH, Min IM, Yim J, Kim TK. Activation of interferon regulatory factor 3 in response to DNA-damaging agents. J Biol Chem. 1999;274:30686-30689. [PubMed] [DOI] |
| 24. | Lin R, Mamane Y, Hiscott J. Structural and functional analysis of interferon regulatory factor 3: localization of the transactivation and autoinhibitory domains. Mol Cell Biol. 1999;19:2465-2474. [PubMed] |
| 25. | Karpova AY, Ronco LV, Howley PM. Functional characterization of interferon regulatory factor 3a (IRF-3a), an alternative splice isoform of IRF-3. Mol Cell Biol. 2001;21:4169-4176. [PubMed] [DOI] |
| 26. | Kumar KP, McBride KM, Weaver BK, Dingwall C, Reich NC. Regulated nuclear-cytoplasmic localization of interferon regulatory factor 3, a subunit of double-stranded RNA-activated factor 1. Mol Cell Biol. 2000;20:4159-4168. [PubMed] [DOI] |
| 27. | Weaver BK, Kumar KP, Reich NC. Interferon regulatory factor 3 and CREB-binding protein/p300 are subunits of double-stranded RNA-activated transcription factor DRAF1. Mol Cell Biol. 1998;18:1359-1368. [PubMed] |
| 28. | Grandvaux N, Servant MJ, tenOever B, Sen GC, Balachandran S, Barber GN, Lin R, Hiscott J. Transcriptional profiling of interferon regulatory factor 3 target genes: direct involvement in the regulation of interferon-stimulated genes. J Virol. 2002;76:5532-5539. [PubMed] [DOI] |