修回日期: 2008-04-30
接受日期: 2008-05-25
在线出版日期: 2008-06-08
目的: 探讨血管内皮生长因子受体-3(VEGFR-3)在肿瘤细胞生长中的作用.
方法: 根据人VEGFR-3 mRNA编码序列, 设计3个RNA干涉靶点, 构建siRNA表达载体, 并转染到LoVo细胞中, 应用半定量RT-PCR检测基因转染前后VEGFR-3 mRNA表达水平的变化, 采用四甲基偶氮唑蓝显色法(MTT)观察细胞生长变化, 并应用流式细胞计数仪分析细胞凋亡的情况.
结果: 针对VEGFR-3基因的siRNA表达载体成功构建, psiRNA-VEGFR-3可显著抑制LoVo细胞中VEGFR-3基因的表达, 转染psiRNA-VEGFR-3细胞生长明显抑制, 并可诱导LoVo细胞出现凋亡.
结论: psiRNA-VEGFR-3载体能够在LoVo细胞中引发RNA干扰效应, 下调VEGFR-3基因的表达可以抑制细胞增殖, 诱导细胞凋亡.
引文著录: 贾如江, 侯丽艳, 张有成, 吕志诚. VEGFR-3 siRNA体外对人结肠癌细胞生长的抑制作用. 世界华人消化杂志 2008; 16(16): 1797-1801
Revised: April 30, 2008
Accepted: May 25, 2008
Published online: June 8, 2008
AIM: To construct small interfering RNA (siRNA) expression vector (psiRNA-VEGFR-3) targeting vascular endothelial growth factor receptor-3 (VEGFR-3) gene and to investigate effects of psiRNA-VEGFR-3 on suppressing the VEGFR-3 gene expression in human colon cancer cell lines.
METHODS: Three pairs of 19 bp reverse repeated sequence targeting VEGFR-3 mRNA spaced by 9 bp nucleotide were designed and synthesized, through directional cloning plasmid pSUPER to construct siRNA eukaryotic expression vector. LoVo cells were transfected with psiRNA-VEGFR-3 vectors by lipofectamine 2000. The expression of VEGFR-3 mRNA was detected by semi-quantitative real time PCR. MTT assay was used to measure cell growth and flow cytometry was used to analyze apoptosis.
RESULTS: The VEGFR-3 siRNA expression vector was constructed successfully; psiRNA-VEGFR-3 significantly inhibited VEGFR-3 expression in LoVo cells. Transfected psiRNA-VEGFR-3 markedly inhibited cell growth, and induced apoptosis in LoVo cells.
CONCLUSION: psiRNA-VEGFR-3 vectors can initiate RNA interference, downreguate expression of VEGFR-3 gene, which can inhibit cell proliferation and induce cell apoptosis.
- Citation: Jia RJ, Hou LY, Zhang YC, Lv ZC. Ex vivo inhibitory effects of VEGFR-3 siRNA on growth of human colon cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1797-1801
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1797.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1797
血管内皮生长因子受体-3(vascular endothelial growth factor receptor-3, VEGFR-3)属于酪氨酸激酶受体家族, 在胚胎发生的初始阶段存在于所有的内皮细胞, 随后定位于小静脉和淋巴管, 是成熟淋巴管内皮细胞的特异性标志物. VEGFR-3主要通过与其配体VEGF-C、VEGF-D结合后, 促进淋巴内皮细胞的增殖、分化, 诱导淋巴管生成, 促进肿瘤细胞的侵袭和转移. 现有研究表明, VEGFR-3在多数肿瘤细胞上也有相应表达[1-2]. RNA干扰(RNA interference, RNAi)是由小分子干扰RNA(smalI interfering RNA, siRNA)介导的一种进化上保守的细胞防御机制, 他能够特异而有效的引起转录后mRNA水平关闭相应基因表达的过程[3]. 因此, 在功能基因研究方面, RNAi具有稳定、特异、细胞毒性低以及作用持久、强大等优点, RNAi技术在肿瘤、基因功能和病毒性疾病等的研究中均展现出良好的应用前景. siRNA现已被广泛用来抑制特定基因的表达. 本实验拟靶向VEGFR-3基因构建siRNA表达载体, 并探讨这一载体是否能在人结肠癌细胞株LoVo细胞中引发RNAi效应, 抑制VEGFR-3基因表达及其生物学效应.
pSUPER质粒由荷兰莱顿大学医学中心人类遗传学系Yvonne D Krom教授惠赠, DH5a大肠杆菌, Hind Ⅲ和Bgl Ⅱ限制性内切酶、T4DNA连接酶、Taq DNA聚合酶、RNA Extraction Kit购自TaKaRa公司(中国), 质粒小提试剂盒、琼脂糖凝胶回收试剂盒购自上海生工公司, RPMI 1640培养基购自Gibco公司, LoVo细胞株购自中国科学院上海细胞生物研究所, 胎牛血清购自杭州四季青生物制品有限公司, 脂质体Lipofectarmine 2000购自美国Invitrogen公司, TaKaRa One Step RNA PCR Kit购自TaKaRa公司(中国).
1.2.1 VEGFR-3 siRNA表达载体的构建: (1)VEGFR-3基因发夹siRNA模板寡核苷酸的设计: 在NCBI数据库中查找VEGFR-3全序列, 参照siRNA的设计原则, 从VEGFR-3编码区中寻找符合设计原则的靶序列, 按照pSUPER载体的要求设计3对6条能编码siRNA的寡核苷酸链. 寡核苷酸序列两端包含BglⅡ和Hind Ⅲ酶切位点, 能直接与经相同酶切的pSUPER载体连接. 编码区干涉位点的正义序列分别位于806-825位碱基CGGGAGGTGTGTATAGATG、1580-1599CATGCAGCTGTTACAGACG、1863-1882位碱基GGCCTCTTGTAAAGACTGG为作用靶点, 合成3对64 nt的寡核苷酸, 分别命名为no.1、no.2、no.3每条寡核苷酸链中有2个反向互补排列的19 nt的VEGFR-3靶序列. 另我们设计了可形成发夹结构短链RNA的对照序列. 此序列的19个核苷酸与806-825位碱基序列组成相同, 但是顺序不同, 命名为no.4. 此4个序列均经过通过BLAST软件确定与其他非相关基因无同源性, 不会影响其他基因的表达. 寡核苷酸序列由捷瑞生物工程(上海)有限公司合成. (2)siRNA表达载体的构建: 将2对寡核苷酸的正义链和反义链分别用TE液配成浓度为100 μm/L的溶液, 吸取正义链和反义链各2 μL, 加入退火缓冲液30 μL、双蒸水6 μL, 混匀, 95℃孵育5 min, 70℃孵育10 min, 缓慢冷却至室温得到退火双链DNA, -20℃保存. 各取2 μL退火产物, 10 μL经Bgl Ⅱ和Hind Ⅲ双酶切的线性pSUPER质粒, 1 μL T4 DNA连接酶缓冲液, 在1 μL T4 DNA连接酶的作用下于16℃连接反应过夜. (3)重组质粒的转化和克隆挑选: 将连接产物转化感受态的DH5a, 菌液涂于含氨苄青霉素的LB培养板上, 37℃过夜. 挑取单个菌落并提取质粒, 酶切鉴定重组质粒后, 送上海生工以T7启动子引物进行测序. 重组后的质粒分别命名为siRNA no.1、siRNA no.2、siRNA no.3和SCR no.4.
1.2.2 细胞培养及转染: LoVo细胞采用含100 mL/L新生牛血清、RPMI 1640培养基于37℃、50 mL/L CO2孵箱内培养, 每3天更换培养液, 细胞长满时用2.5 g/L胰酶消化传代. 将生长良好、处于对数生长期的细胞以1×106个/孔接种于6孔培养板, 等细胞融合达80%-90%时, 参照Lipofectamine 2000使用说明书进行转染. 实验分为以下5组: 转染siRNA no.1(A组)、siRNA no.2(B组)、siRNA no.3(C组), 转染SCR no.4组(D组); 转染pSUPER空质粒组(E组).
1.2.3 RT-PCR检测VEGFR-3表达水平: 转染72 h后, 收获各组细胞1×106, 按TRIzol的操作说明提取总RNA, 按反转录试剂盒操作方法获得单链cDNA, 以此为底物用PCR检测VEGFR-3的表达, VEGFR-3上游引物AGCCATTCATCAACAAGCCT, 下游引物GGCAACAGCTGGATGTCATA (扩增片段长度为298 bp); 内参照β-actin上游引物CCAAGGCCAACCGCGAGAAGATGAC, 下游引物AGGGTACATGGTGGTGCCGCCAGAC(扩增片段长度为587 bp), PCR引物均由捷瑞生物工程(上海)有限公司合成. 扩增产物经15 g/L琼脂糖凝胶电泳, YLN-2000凝胶成像分析系统, 测定各条带的积分吸光度(A), 每个条带测定10次.
1.2.4 流式细胞计数仪分析细胞增殖周期变化: 转染LoVo细胞24、48、72 h后取收集转染后的各组LoVo细胞5×105个. 1000 r/min离心10 min, 细胞沉淀用PBS洗1次, 分散成单细胞悬液, 加入700 mL/L冷乙醇4℃固定. 1000 r/min离心10 min, 少量PBS重悬细胞, 加入碘化丙啶(PI), 使终浓度为100 mg/L, 混匀后置于冰上30 min, 在流式细胞仪上检测细胞增殖周期的变化.
1.2.5 细胞生长曲线(MTT法)测定: 每组取200 μL加入96孔板中, 分别检测转染后第0、24、48和72 h MTT的吸光度值, 每组计数3孔, 取均值. 收获细胞前4 h, 每孔加入45 μg/L MTT液20 μL, 继续培养4 h后弃培养基, 每孔加入二甲基亚砜(DMSO)150 μL, 室温下振荡10 min. 应用酶标仪, 在570 nm波长测吸光度值(以不加血清的RPMI 1640为空白调零). 以时间为横轴, 细胞吸光度为纵轴绘制细胞生长曲线.
统计学处理 用SPSS10.0统计学软件进分析, 计量资料数据以mean±SD表示, 采用单因素方差分析(One-way ANOVA)进行方差分析并两两比较. α = 0.05为检验水准, P<0.05为差异有统计学意义.
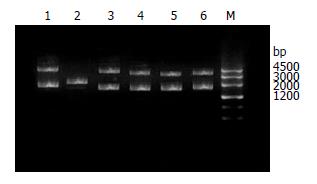
合成的64 nt寡核苷酸退火后, 将其插入Hind Ⅲ和BglⅡ双酶切后的pSUPER载体, 该载体原有的BglⅡ酶切位点被破坏. 酶切鉴定结果显示: 空pSUPER载体被BglⅡ单酶切成线形质粒, 阳性重组质粒siRNA no.1、siRNA no.2、siRNA no.3和SCR no.4不能被BglⅡ酶切(图1), DNA测序结果也证实重组质粒中已插入目的片段, 构建psiRNA-VEGFR-3表达载体成功.
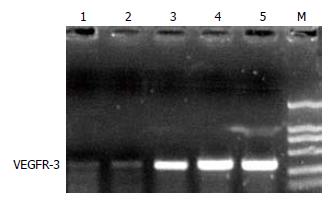
Real Time PCR检测结果显示, 转染siRNA no.1、siRNA no.2、siRNA no.3 72 h后LoVo细胞VEGFR-3 mRNA产物电泳带较转染和SCR no.4、转染pSUPER空载体组明显减弱, A、B、C组细胞VEGFR-3 mRNA较E组分别下降了79.76%、79.46%、28.15%, A、D、E组比较, F值为8.8×109, P均<0.01, B、D、E组比较, F值为8.6×109, P均<0.01, C、D、E组比较, F值为1.1×109, P均<0.01, 差异均有统计学意义, LSD两两比较, D组与E组比较, P>0.05, 差异无统计学意义. 结果表明转染siRNA no.1、siRNA no.2、siRNA no.3可明显抑制LoVo细胞VEGFR-3基因的表达, 其中以siRNA no.1组抑制效果最好(图2).
转染LoVo细胞24、48、72 h后取转染siRNA no.1、siRNA no.2、siRNA no.3、 SCR no.4和转染pSUPER空载体组LoVo细胞进行流式细胞技术分析: 结果显示, 转染后24 h各转染组细胞凋亡无明显差别, 48 h后转染siRNA no.1、siRNA no.2、siRNA no.3的3组细胞凋亡率开始增加, 72 h后3组细胞凋亡率明显增加, 其中以转染siRNA no.1组细胞凋亡率最高, 而转染SCR no.4和转染pSUPER空质粒组细胞凋亡率并无变化(表1).
| 时间点(h) | 细胞凋亡率 | ||||
| siRNA no.1 | siRNA no.2 | siRNA no.3 | SCR no.4 | pSUPER | |
| 24 | 1.61±0.55 | 1.52±0.42 | 1.48±0.47 | 1.35±0.62 | 1.36±0.56 |
| 48 | 9.55±0.69 | 9.48±0.58 | 4.65±0.57 | 1.58±0.53 | 1.55±0.59 |
| 72 | 15.78±0.52 | 14.96±0.45 | 9.56±0.39 | 1.65±0.45 | 1.64±0.46 |
根据MTT比色法结果绘制的生长曲线, 可见转染siRNA no.1、siRNA no.2、siRNA no.3后3组细胞生长均明显受到抑制, 而对照组细胞生长无明显影响. 根据公式: 细胞生长抑制率(%) = [对照组(A570)-实验组(A570)]/对照组(A570)×100%, 计算转染siRNA no.1、siRNA no.2、siRNA no.3后72 h的3组细胞生长与转染空质粒组相比较抑制率分别为56.91%、55.78%、28.80%, 同样显示以siRNA no.1组抑制效果最好(表2).
| 时间点(h) | A570 nm | ||||
| siRNA no.1 | siRNA no.2 | siRNA no.3 | SCR no.4 | pSUPER | |
| 0 | 0.501±0.024 | 0.510±0.032 | 0.505±0.036 | 0.538±0.037 | 0.527±0.029 |
| 24 | 0.921±0.035 | 0.922±0.042 | 0.933±0.040 | 0.945±0.032 | 0.961±0.036 |
| 48 | 0.821±0.039 | 0.848±0.038 | 1.125±0.051 | 1.580±0.053 | 1.625±0.050 |
| 72 | 0.760±0.052 | 0.780±0.045 | 1.256±0.039 | 1.659±0.045 | 1.764±0.046 |
VEGFR-3是VEGF家族成员VEGF-C的受体, 是第1个被发现的淋巴管内皮标志物, 特异地表达于淋巴管内皮细胞, 亦表达于某些血管内皮[4]. 国内外多数研究表明, VEGF-C/VEGFR-3在肿瘤周边的新生淋巴管内皮细胞呈高表达, 与肿瘤的淋巴结转移呈高度相关[5-6]. Wang et al[7]发现胃癌患者的血浆VEGF-C水平和淋巴管密度与肿瘤的淋巴管转移及其患者的预后有关. 实验研究发现, VEGF-C通过受体VEGFR-3的信号传导诱导淋巴管生成, 促进肿瘤的侵袭和淋巴转移[8-10], 而阻断VEGF-C的受体VEGFR-3的信号传导可抑制肿瘤的淋巴管生成和淋巴结转移, 而对其他现有的淋巴管功能无任何影响[11-12]. VEGF-C与VEGFR-3结合, 引起VEGFR-3自身磷酸化, 通过PI3K引起Akt的Ser473、Thr308磷酸化, 激活抗凋亡蛋白Akt/PKB, 而抑制癌细胞的凋亡. 研究表明胃癌细胞通过VEGF-C与VEGFR-3相互作用, 可调节自身生长, 促进增殖、抑制凋亡, 从而具有更高的增殖活性及浸润性[13].
siRNA可以高效、特异地阻断体内同源基因表达, 促使同源mRNA降解, 诱使细胞表现出特定基因缺失的表型, 称为RNAi. 体外实验证实siRNA与反义RNA相比, 具有稳定性高、抑制作用强、细胞摄取相对容易等不可比拟的优点[14], siRNA较单链反义DNA、反义RNA有更高效的表达基因抑制效果[15]. 与其他基因敲除技术相比, 此项技术具有高效性、高特异性、高稳定性、可传播性和可遗传性的分子生物学特征[16], 已被广泛应用于肿瘤的化疗耐药及逆转方面的研究, 并成为研究领域的热点研究中[17]. 在肿瘤基因治疗中, 通过人合成特定癌基因靶向的siRNA或构建siRNA的表达载体, 并将他导入肿瘤细胞中, 可以特异性地抑制目的基因的表达[18-21]. siRNA已成为肿瘤基因治疗领域新的热点.
本研究采用RNA干涉技术, 针对VEGFR-3构建了可在体内表达siRNA的真核表达载体. 我们设计、合成3对VEGFR-3编码基因的反向重复序列, 通过实验观察到siRNA可有效抑制LoVo细胞中VEGFR-3 mRNA的表达, 其中2对抑制效率较高. 转染psiRNA-VEGFR-3后LoVo 细胞中VEGFR-3 mRNA的表达下降, 部分LoVo细胞出现凋亡, 可引起LoVo细胞生长抑制, 增殖速度减慢. 推测可能是通过降低LoVo细胞VEGFR-3的表达, 继而抑制VEGFR-3所介导的信号通路发挥作用. 但是LoVo细胞中VEGFR-3 mRNA的表达抑制率与LoVo细胞生长抑制、凋亡率并不完全一致, 我们推测VEGFR-3所介导的信号通路在LoVo细胞生长和凋亡中只是起部分作用.
总之, 我们认为, 应用针对VEGFR-3 RNA干涉技术既可阻断肿瘤的淋巴道转移, 又可促使肿瘤细胞凋亡, 不失为未来临床抗肿瘤治疗的一个新的选择. 这一研究有望为肿瘤基因治疗提供一种新的思路.
研究发现, VEGFR-3基因在许多恶性肿瘤组织中高表达, VEGFR-3主要通过与其配体VEGF-C、VEGF-D结合后, 促进淋巴内皮细胞的增殖、分化, 诱导淋巴管生成, 促进肿瘤细胞的侵袭和转移. 抑制VEGFR-3的活性可以抑制肿瘤细胞的淋巴转移和远处转移. RNA干扰(RNAi)是通过短片断双链RNA(siRNA)引起同源mRNA降解, 致相应基因沉默, 高特异性, 高效率等优点, 因其简便、快速、经济,目前已广泛应用于抗肿瘤研究.
曹秀峰, 主任医师, 南京医科大学附属南京第一医院肿瘤中心; 杜雅菊, 主任医师, 哈尔滨医科大学附属第二医院消化内科
Roberts et al的动物实验研究显示VEGFR-3可以介导乳腺癌的淋巴转移和肺转移, 而通过对其抑制可以降低转移风险; Su et al在非小细胞肺癌研究发现, VEGF-C/VEGFR3生物轴有促进肿瘤细胞运动、增加其侵袭性、促进肿瘤细胞转移的效应, 肿瘤组织中VEGF-C的表达与临床转移发生正相关和生存率负相关.
本文设计合成3对靶向VEGFR-3的siRNA, 其中2对具有高效性, 寻找到了高效阻断VEGFR-3表达的基因序列.
以VEGFR-3为靶基因设计的siRNA表达框架构建iRNA表达载体, 转染后可通过抑制结肠癌细胞增殖,促进结肠癌细胞的凋亡而发挥抗肿瘤作用.
本研究过程复杂, 结论有一定的科学性, 为指导肿瘤的基因治疗研究提供了新线索.
编辑: 李军亮 电编:吴鹏朕
| 1. | Van Iterson V, Leidenius M, Von Smitten K, Bono P, Heikkilä P. VEGF-D in association with VEGFR-3 promotes nodal metastasis in human invasive lobular breast cancer. Am J Clin Pathol. 2007;128:759-766. [PubMed] [DOI] |
| 3. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 4. | Partanen TA, Alitalo K, Miettinen M. Lack of lymphatic vascular specificity of vascular endothelial growth factor receptor 3 in 185 vascular tumors. Cancer. 1999;86:2406-2412. [PubMed] [DOI] |
| 5. | Roberts N, Kloos B, Cassella M, Podgrabinska S, Persaud K, Wu Y, Pytowski B, Skobe M. Inhibition of VEGFR-3 activation with the antagonistic antibody more potently suppresses lymph node and distant metastases than inactivation of VEGFR-2. Cancer Res. 2006;66:2650-2657. [PubMed] [DOI] |
| 6. | He Y, Karpanen T, Alitalo K. Role of lymphan-giogenic factors in tumor metastasis. Biochim Biophys Acta. 2004;1654:3-12. [PubMed] |
| 7. | Wang TB, Deng MH, Qiu WS, Dong WG. Association of serum vascular endothelial growth factor-C and lymphatic vessel density with lymph node metastasis and prognosis of patients with gastric cancer. World J Gastroenterol. 2007;13:1794-1797; discussion 1797-1798. [PubMed] |
| 8. | Lin J, Lalani AS, Harding TC, Gonzalez M, Wu WW, Luan B, Tu GH, Koprivnikar K, VanRoey MJ, He Y. Inhibition of lymphogenous metastasis using adeno-associated virus-mediated gene transfer of a soluble VEGFR-3 decoy receptor. Cancer Res. 2005;65:6901-6909. [PubMed] [DOI] |
| 9. | Mandriota SJ, Jussila L, Jeltsch M, Compagni A, Baetens D, Prevo R, Banerji S, Huarte J, Montesano R, Jackson DG. Vascular endothelial growth factor-C-mediated lymphangiogenesis promotes tumour metastasis. EMBO J. 2001;20:672-682. [PubMed] [DOI] |
| 10. | Skobe M, Hawighorst T, Jackson DG, Prevo R, Janes L, Velasco P, Riccardi L, Alitalo K, Claffey K, Detmar M. Induction of tumor lymphangiogenesis by VEGF-C promotes breast cancer metastasis. Nat Med. 2001;7:192-198. [PubMed] [DOI] |
| 11. | He Y, Kozaki K, Karpanen T, Koshikawa K, Yla-Herttuala S, Takahashi T, Alitalo K. Suppression of tumor lymphangiogenesis and lymph node metastasis by blocking vascular endothelial growth factor receptor 3 signaling. J Natl Cancer Inst. 2002;94:819-825. [PubMed] |
| 12. | Pytowski B, Goldman J, Persaud K, Wu Y, Witte L, Hicklin DJ, Skobe M, Boardman KC, Swartz MA. Complete and specific inhibition of adult lymphatic regeneration by a novel VEGFR-3 neutralizing antibody. J Natl Cancer Inst. 2005;97:14-21. [PubMed] |
| 13. | Straume O, Jackson DG, Akslen LA. Independent prognostic impact of lymphatic vessel density and presence of low-grade lymphangiogenesis in cutaneous melanoma. Clin Cancer Res. 2003;9:250-256. [PubMed] |
| 14. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 15. | Caplen NJ, Parrish S, Imani F, Fire A, Morgan RA. Specific inhibition of gene expression by small double-stranded RNAs in invertebrate and vertebrate systems. Proc Natl Acad Sci U S A. 2001;98:9742-9747. [PubMed] [DOI] |
| 16. | Yoshida Y, Wang IC, Yoder HM, Davidson NO, Costa RH. The forkhead box M1 transcription factor contributes to the development and growth of mouse colorectal cancer. Gastroenterology. 2007;132:1420-1431. [PubMed] [DOI] |
| 17. | Iorns E, Lord CJ, Turner N, Ashworth A. Utilizing RNA interference to enhance cancer drug discovery. Nat Rev Drug Discov. 2007;6:556-568. [PubMed] [DOI] |
| 18. | Bulk E, Hascher A, Liersch R, Mesters RM, Diederichs S, Sargin B, Gerke V, Hotfilder M, Vormoor J, Berdel WE. Adjuvant therapy with small hairpin RNA interference prevents non-small cell lung cancer metastasis development in mice. Cancer Res. 2008;68:1896-1904. [PubMed] [DOI] |
| 19. | Davenport RJ. Gene silencing. A faster way to shut down genes. Science. 2001;292:1469-1471. [PubMed] [DOI] |
| 20. | Toiyama Y, Mizoguchi A, Kimura K, Hiro J, Inoue Y, Tutumi T, Miki C, Kusunoki M. TTYH2, a human homologue of the Drosophila melanogaster gene tweety, is up-regulated in colon carcinoma and involved in cell proliferation and cell aggregation. World J Gastroenterol. 2007;13:2717-2721. [PubMed] |