修回日期: 2008-03-12
接受日期: 2008-05-10
在线出版日期: 2008-06-08
目的: 探讨环氧合酶-2选择性抑制剂塞来昔布(celecoxib)对人肝癌细胞株HepG2细胞核转录因子-kB(nuclear factor-kappa B, NF-kB)活性和蛋白表达的影响.
方法: 不同浓度的塞来昔布作用于HepG2细胞后, 应用凝胶电泳迁移率改变分析技术检测HepG2细胞中NF-kB DNA结合活性; 用Western blotting法检测HepG2细胞NF-kB p65蛋白表达.
结果: 25、50 μmol/L塞来昔布作用于HepG2细胞后, 药物处理组HepG2细胞NF-kB DNA结合活性明显降低, 与空白对照组相比有显著性差异(t = 12.58, P = 0.000; t = 17.97, P = 0.000); 塞来昔布可明显抑制HepG2细胞NF-kB p65蛋白表达水平, 与空白对照组相比, 差异均有统计学意义(t = 4.24, P = 0.013; t = 6.38, P = 0.003).
结论: 塞来昔布能有效抑制HepG2细胞NF-kB活性及NF-kB p65蛋白表达.
引文著录: 卢栋, 李永华, 纪龙, 李龙嫚, 杜玉开, 余红平. 塞来昔布对人肝癌细胞株HepG2细胞核转录因子-kB活性及蛋白表达的抑制. 世界华人消化杂志 2008; 16(16): 1793-1796
Revised: March 12, 2008
Accepted: May 10, 2008
Published online: June 8, 2008
AIM: To investigate effects of COX-2 inhibitor celecoxib on activation of nuclear factor-kappa B (NF-kB) and on protein expression of NF-kB P65 in human liver cancer cell line HepG2.
METHODS: HepG2 cells were treated with various concentrations of celecoxib. The NF-kB DNA binding activation was detected using electrophoresis mobility shift assay and protein expression of NF-kB p65 was determined using western blotting in HepG2 cells.
RESULTS: After HepG2 cells were treated with different concentrations of celecoxib (25 and 50 μmol/L, respectively), NF-kB DNA binding activation were significantly reduced (t = 12.58, P = 0.000; t = 17.97, P = 0.000) and protein expression of NF-kB p65 were significantly inhibited in celecoxib-treated HepG2 cells as compared with those in the empty control group (t = 4.24, P = 0.013; P = 6.38, P = 0.003).
CONCLUSION: Activation of NF-kB and expression of NF-kB p65 protein in HepG2 cells are effectively inhibited by celecoxib.
- Citation: Lu D, Li YH, Ji L, Li LM, Du YK, Yu HP. Celecoxib inhibited activation of NF-kB and expression of NF-kB P65 protein in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1793-1796
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1793.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1793
近年来研究表明环氧合酶-2(cyclooxygenase-2, COX-2)在多种恶性肿瘤包括肝细胞癌组织以及癌前病变组织中表达明显增高, 提示COX-2在恶性肿瘤的发生发展过程中起重要作用, COX-2可能成为化学预防和化学辅助治疗恶性肿瘤新的靶点和选择[1-3]. 塞来昔布(celecoxib)是一种选择性COX-2抑制剂, 大量的流行病学、临床和体内外实验研究证实celecoxib可抑制多种肿瘤细胞增殖, 促进细胞凋亡, 抑制肿瘤新生血管形成以及预防肿瘤发生等抗肿瘤作用[4-6]. celecoxib抗肿瘤作用的确切机制仍不明确, 目前认为是通过COX-2依赖途径和COX-2非依赖途径发挥抗肿瘤作用[5].
作为转录调控因子的NF-κB(nuclear factor-kappa B, NF-κB)在细胞增殖、抑制细胞凋亡中起关键作用[7]. 近年来研究发现大多数肿瘤都表现出NF-κB活性高表达, 多种致癌因素可通过激活NF-κB促进细胞生长、抗凋亡、使细胞发生恶性转化并促进肿瘤细胞的转移等, NF-κB活性失控与肿瘤的形成有关[7-8]. 抑制NF-κB活性可以抑制肿瘤细胞增长、促进凋亡、增加抗肿瘤细胞对化疗的敏感性、抑制炎症、减少肿瘤血管生成等[7-8]. 因此我们推测celecoxib的抗肿瘤作用部分是通过调节NF-κB活性. 我们应用celecoxib作用于人肝癌细胞株HepG2细胞, 检测HepG2细胞NF-κB DNA结合活性及NF-κB p65蛋白表达变化, 探讨celecoxib对HepG2细胞NF-κB活性及NF-κB p65蛋白表达的影响.
celecoxib购自于美国Cayman公司, Gel shift试剂盒购自于美国Promega公司, γ-32P-ATP、Sephadex G-25购自于英国Pharmacia公司, 兔p65多克隆抗体购自于美国Santa Cruz公司, DAB显色试剂盒购自于北京中山公司. 其余试剂均为国产分析纯. 人肝癌细胞株HepG2由广西医科大学医学科学实验中心保存. 细胞用含100 mL/L小牛血清的RPMI 1640培养液传代.
1.2.1 细胞处理: 取对数生长期的HepG2细胞, 将1×106个细胞接种于100 mL培养瓶, 在37℃、饱和湿度及50 mL/L CO2的细胞培养箱内培养24 h, 细胞贴壁后换液, 分别加入celecoxib, 并调整celecoxib的工作浓度分别为25、50 μmol/L, 同时设不加药物组为空白对照组, 继续培养48 h.
1.2.2 Western blot检测NF-κB p65蛋白表达: 收集HepG2细胞, 用预冷的磷酸盐缓冲液漂洗细胞, 加入100 μL预冷的细胞裂解液[50 mmol/L 的Tris-Cl, 200 mmol/L的NaCl, 2 mmol/L的EDTA, 10 mL/L的Triton X-100、0.1 mmol/L的PMSF], 于冰上孵育20 min后, 15 000 g 4℃离心5 min, 提取蛋白, 用BCA试剂盒并按照其说明测定蛋白浓度. 以细胞裂解液将待测样品蛋白浓度稀释至4 g/L. 以20 μg总蛋白上样于SDS-PAGE, 电泳分离后转移至硝酸纤维素滤膜, 50 g/L脱脂奶粉溶液封闭, 加入兔抗人NF-κB p65多克隆抗体(1:50), 4℃冰箱过夜. 磷酸盐缓冲液漂洗滤膜3次, 每次10 min. 分别用羊抗兔二抗(1:1000)37℃温育1 h, PBS漂洗3次, 每次10 min, DAB显色. 岛津CS-930薄层扫描图像分析仪计算蛋白条带的积分A值.
1.2.3 凝胶电泳迁移率改变分析(electrophoresis mobility shift assay, EMSA): 检测NF-κB DNA结合活性NF-κB寡核苷酸序列为: 5'-AGTTGAGGGGACTTTCCCAGGC-3'. 收集1×107培养细胞, 磷酸盐缓冲液洗涤细胞后, 提取细胞核蛋白[9]. 用BCA试剂盒并按照其说明测定蛋白浓度, -80℃保存. 用γ-32P-ATP末端标记试剂盒并按其说明书对NF-κB寡核苷酸探针的5'末端进行标记. 用Sephadex G-25纯化标记的寡核苷酸. 取10 μg核蛋白与同位素标记的探针在室温下孵育30 min. 同时设特异性竞争试验, 在加标记探针之前, 在反应体系中先加入50、100倍未标记的特异性和100倍非特异性(SP1)寡核苷酸探针及阴性对照组(不加任何提取物). 将反应产物分别上样于40 g/L非变性聚丙烯酰胺凝胶, 电泳分离, 干胶, 于-70℃放射自显影于X线片上. 用 Image Pro Plus 5.0图像分析软件对电泳谱带进行半定量分析, 取其面积与灰度值的乘积(A值)表示核提取物中NF-κB与标记探针结合的活性.
统计学处理 所有结果用SPSS13.0软件进行t检验分析. 当P<0.05时, 认为差异有统计学意义.
在阴性对照组(未加核蛋白)未见电泳滞后带; 在空白对照组(未用celecoxib处理HepG2)可见电泳滞后带, 空白对照组NF-κB DNA结合活性为49.11±3.63; 25、50 μmol/L celecoxib处理组NF-κB DNA结合活性分别为18.57±2.13和8.59±1.45, 均显著低于空白对照组(t = 12.58, P = 0.000, t = 17.97, P = 0.000, 表1, 图1). 在特异性竞争抑制组中, 未标记探针(同源性寡核苷酸, 含NF-κB结合位点)的浓度达标记探针的50倍时, 电泳滞后带变淡, 达100倍时, 仅见一极弱滞后带; 而加入100倍非特异性(SP1)寡核苷酸探针, 电泳滞后带仍然存在, 证实滞后带由特异性的NF-κB DNA结合序列与核蛋白中的NF-κB蛋白结合合所形成(图2).
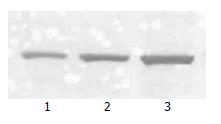
Western blot检测结果显示, celecoxib处理前, HepG2细胞NF-κB p65的蛋白条带的积分A值为25.55±2.35; 25、50 μmol/L celecoxib处理后, NF-κB p65的A值均明显降低, 分别为18.89±1.37和13.24±2.38, 与空白对照组相比差异具有统计学意义(表2, 图3).
选择性COX-2抑制剂celecoxib能抑制肺癌、胃癌、肝癌和结肠癌等多种肿瘤细胞增殖, 诱导细胞凋亡, 并能预防肿瘤的发生, 但其中机制尚不明确. NF-κB是一种重要的转录因子蛋白, 研究表明NF-κB除了具有调节炎症、免疫反应相关基因转录作用外, 还可以调节细胞增殖及抗凋亡基因的转录, 参与细胞的增殖、抑制细胞的凋亡, 与多种肿瘤的形成有关, 在肿瘤发生发展过程中具有重要作用[10-11]. 因此, 在本次实验中我们探讨celecoxib对HepG2细胞NF-κB活性及NF-κB p65蛋白表达的影响.
NF-κB几乎存在于所有细胞, 与p50/p65结合形成二聚体. 静息状态时, p65与κB抑制蛋白(inhibitory kappaB, IκB)结合, 以非活性状态存在于细胞质中, 不具有调节基因转录的能力. 当细胞受到内毒素、病毒蛋白、致癌物等细胞外信号刺激时, 蛋白激酶被激活, IκB磷酸化并降解, 从而释放NF-κB二聚体, 使其得以转位进入细胞核中, 与靶基因启动子区域中特定的DNA序列结合, 诱导抗凋亡基因和促生长基因等靶基因的转录. 我们的研究发现肝肿瘤细胞株HepG2细胞表达NF-κB活性. 用不同药物浓度的celecoxib处理HepG2细胞, EMSA检测结果显示药物处理后的HepG2细胞中NF-κB DNA结合活性明显受到抑制, 表明celecoxib可抑制HepG2细胞NF-κB与靶DNA的结合活性. Subhashini et al[12]亦报道celecoxib可抑制K562、HL60和U937等白血病细胞中NF-κB DNA结合活性. 另一些NSAIDs如阿司匹林(aspirin)、水杨酸钠盐和舒林酸等也有抑制NF-κB DNA结合活性的作用[13-14]. 同时Western blot检测结果显示celecoxib处理后的HepG2细胞NF-κB p65蛋白表达较处理前明显降低, celecoxib能显著抑制NF-κB p65蛋白表达. 提示celecoxib也可通过抑制HepG2细胞NF-κB p65蛋白表达而发挥抗肿瘤作用. 新近Márquez-Rosado et al[15]报道的研究结果与我们的相似, 他们观察了celeocxib对小鼠前列腺癌动物模型的体内抑瘤作用并探讨其机制, 结果发现celecoxib能促进肿瘤细胞凋亡, 有效抑制模型动物肿瘤生长, 其作用机制是通过抑制NF-κB p65和COX-2活性表达而实现.
我们的研究结果提示celecoxib可抑制HepG2细胞NF-κB DNA结合活性和NF-κB p65蛋白表达, 此可能为celecoxib抑制肿瘤细胞增殖, 促进细胞凋亡, 抑制肿瘤新生血管形成以及预防肿瘤发生等抗肿瘤作用的另一作用机制.
COX-2在恶性肿瘤的发生发展过程中起重要作用, COX-2可能成为化学预防和化学辅助治疗恶性肿瘤的新靶点. 塞来昔布(celecoxib)是一种选择性COX-2抑制剂, 可抑制多种肿瘤细胞增殖, 促进细胞凋亡, 抑制肿瘤新生血管形成以及预防肿瘤发生等抗肿瘤作用.
沈守荣, 教授, 中南大学湘雅三医院消化内科
celecoxib作为选择性COX-2抑制剂抗肿瘤药, 已成为近年恶性肿瘤化学预防和治疗的研究热点.
Subhashini et al报道celecoxib可通过抑制白血病细胞中NF-κB DNA结合活性而抑制肿瘤细胞增殖, 促进肿瘤细胞凋亡. Narayanan et al观察了celeocxib对小鼠前列腺癌动物模型的体内抑瘤作用并探讨其机制, 结果发现celecoxib能促进肿瘤细胞凋亡, 有效抑制模型动物肿瘤生长, 其作用机制是通过抑制NF-κB和COX-2活性表达而实现.
本研究结果有助于阐明celecoxib抗肿瘤作用的机制, 对选择性COX-2抑制剂在肝癌化学预防和治疗的应用提供了一定的实验依据.
本研究设计合理, 方法可靠, 结果可信, 结论中肯, 为COX-2抑制剂应用于肝癌的防治提供了一定的实验依据.
编辑: 李军亮 电编:何基才
| 1. | Castells A, Balaguer F, Gonzalo V, Castellví-Bel S. Cyclooxygenase 2 and colorectal cancer: therapeutic implications. Gastroenterol Hepatol. 2007;30:280-284. [PubMed] [DOI] |
| 2. | Chi-Man Tang T, Tung-Ping Poon R, Fan ST. The significance of cyclooxygenase-2 expression in human hepatocellular carcinoma. Biomed Pharmacother. 2005;59 Suppl 2:S311-S316. [PubMed] [DOI] |
| 3. | Amir M, Agarwal HK. Role of COX-2 selective inhibitors for prevention and treatment of cancer. Pharmazie. 2005;60:563-570. [PubMed] |
| 4. | Schönthal AH. Direct non-cyclooxygenase-2 targets of celecoxib and their potential relevance for cancer therapy. Br J Cancer. 2007;97:1465-1468. [PubMed] [DOI] |
| 5. | Grösch S, Maier TJ, Schiffmann S, Geisslinger G. Cyclooxygenase-2 (COX-2)-independent anticarcinogenic effects of selective COX-2 inhibitors. J Natl Cancer Inst. 2006;98:736-747. [PubMed] |
| 6. | Farooqui M, Li Y, Rogers T, Poonawala T, Griffin RJ, Song CW, Gupta K. COX-2 inhibitor celecoxib prevents chronic morphine-induced promotion of angiogenesis, tumour growth, metastasis and mortality, without compromising analgesia. Br J Cancer. 2007;97:1523-1531. [PubMed] [DOI] |
| 7. | Sarkar FH, Li Y. NF-kappaB: a potential target for cancer chemoprevention and therapy. Front Biosci. 2008;13:2950-2959. [PubMed] [DOI] |
| 8. | Sethi G, Sung B, Aggarwal BB. Nuclear factor-kappaB activation: from bench to bedside. Exp Biol Med (Maywood). 2008;233:21-31. [PubMed] [DOI] |
| 9. | Kamogawa Y, Minasi LA, Carding SR, Bottomly K, Flavell RA. The relationship of IL-4- and IFN gamma-producing T cells studied by lineage ablation of IL-4-producing cells. Cell. 1993;75:985-995. [PubMed] [DOI] |
| 10. | Verma A, Mehta K. Transglutaminase-mediated activation of nuclear transcription factor-kappaB in cancer cells: a new therapeutic opportunity. Curr Cancer Drug Targets. 2007;7:559-565. [PubMed] [DOI] |
| 11. | Lee CH, Jeon YT, Kim SH, Song YS. NF-kappaB as a potential molecular target for cancer therapy. Biofactors. 2007;29:19-35. [PubMed] |
| 12. | Subhashini J, Mahipal SV, Reddanna P. Anti-proliferative and apoptotic effects of celecoxib on human chronic myeloid leukemia in vitro. Cancer Lett. 2005;224:31-43. [PubMed] |
| 13. | Smalley WE, DuBois RN. Colorectal cancer and nonsteroidal anti-inflammatory drugs. Adv Pharmacol. 1997;39:1-20. [PubMed] |
| 14. | Yamamoto Y, Yin MJ, Lin KM, Gaynor RB. Sulindac inhibits activation of the NF-kappaB pathway. J Biol Chem. 1999;274:27307-27314. [PubMed] [DOI] |