修回日期: 2008-04-07
接受日期: 2008-05-14
在线出版日期: 2008-06-08
目的: 探讨人胎肝细胞移植联合使用JO2抗体的策略, 促进人胎肝细胞在小鼠肝内存活和增殖.
方法: 裸鼠经脾移植1×106人胎肝细胞, 移植后第1天ip JO2抗体, 剂量为0.2 mg/kg, 1次/wk, 持续12 wk为实验组, 裸鼠经人胎肝细胞移植后未给予JO2抗体为对照组, 建立人鼠嵌合肝动物模型. 采用HE染色、原位末端标记方法(TUNEL染色)观察未经人胎肝细胞移植而给予JO2抗体24 h后处死的裸鼠肝脏组织. 免疫组化、逆转录聚合酶链反应(RT-PCR)检测不同时相点实验组和对照组嵌合肝中肝组织人白蛋白、特异人增殖细胞核抗原(PCNA)和人白蛋白mRNA表达.
结果: 未经人胎肝细胞移植而给予JO2抗体的裸鼠病理组织切片发现肝组织出血、坏死和细胞凋亡. 实验组和对照组裸鼠均能存活至24 wk. 移植后嵌合鼠肝组织表达人白蛋白和人PCNA阳性细胞的时间: 实验组2-20 wk, 对照组2-12 wk; 白蛋白mRNA表达: 实验组4-16 wk, 对照组4-8 wk; 实验组与对照组移植后8、12 wk PCNA表达差异有显著性(25.7%±8.5% vs 13.4%±7.8%, 29.4%±5.0% vs 8.5%±2.3%, 均P<0.05).
结论: 人肝细胞异种移植于裸鼠体内能够存活, 经小剂量JO2抗体ip裸鼠,使人鼠嵌合肝中人肝细胞得以增殖, 存活时间延长.
引文著录: 蒋黎, 李俊刚, 兰林, 王宇明, 刘国栋. 鼠特异性Fas抗体对人鼠嵌合肝中人肝细胞增殖的促进作用. 世界华人消化杂志 2008; 16(16): 1734-1740
Revised: April 7, 2008
Accepted: May 14, 2008
Published online: June 8, 2008
AIM: To investigate repopulation of human fetal hepatocytes in an animal model of nude mice with chimeric human liver following induction of mouse hepatocyte apoptosis using a mouse-specific anti-Fas monoclonal antibody (Jo2 mAb) that does not engage xenogeneic fas.
METHODS: For experiment group, nude mice were transplanted with human fetal hepatocytes intrasplenically and treated with 0.2 mg/kg Jo2 mAb intraperitoneally once a week for 12 weeks consistently. Nude mice in the control group were transplanted with human fetal hepatocytes but not administrated with Jo2 mAb. Liver section from non-transplanted nude mice administered with Jo2 mAb were analyzed using hematoxylin and eosin staining and terminal uridine deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) staining. Reverse transcription-polymerase chain reaction (RT-PCR) and S-P immunohistochemistry were used to detect human albumin mRNA, human albumin and specific proliferating cell nuclear antigen (PCNA) in chimeric liver tissues.
RESULTS: Liver sections from non-transplanted nude mice administered with Jo2 mAb showed hepatocyte death, massive apoptosis and hemorrhage. Nude mice in both experiment group and control group survived 24 weeks after transplantation. Human albumin and specific human PCNA were detected from the week 2 to week 20 after transplantation, but they could only be detected from the week 2 to week 12 in the controls. Human albumin mRNA (356 bp) was detected in mice livers from the week 4 to week 16 after transplantation, but they could only be detected from the week 4 to week 8 in the controls. The number of PCNA in experiment group is significantly higher than in the control group at 8, 12 wk (25.7% ± 8.5% vs 13.4% ± 7.8%, 29.4%± 5.0% vs 8.5% ± 2.3%, both P < 0.05).
CONCLUSION: Human fetal hepatocytes of xenogeneic graft can survive in nude mice. The repopulation of human fetal hepatocytes can be promoted and prolonged in nude mouse model with chimeric human liver using mouse-specific anti-Fas antibody intraperitoneally.
- Citation: Jiang L, Li JG, Lan L, Wang YM, Liu GD. Repopulation of human fetal hepatocytes in nude mouse model with chimeric human liver using mouse-specific anti-Fas antibody. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1734-1740
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1734.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1734
将异种肝组织移植于小鼠体内可用于研究遗传毒性[1]、基因治疗[2]、肝再生[3]以及肝炎病毒的感染[4-6], 而将人肝细胞定植到鼠的肝脏构建"人鼠嵌合肝"动物模型, 不但解决肝炎病毒感染的种属特异性问题, 而且可用于已知和未知病毒感染的研究, 为病毒性肝炎及相关领域提供一种强有力的工具. 不过, 移植于鼠体内的人肝细胞能够长时间存活并保持功能是能够运用人鼠嵌合肝作为理想动物模型的首要条件. 要想使肝细胞在移植后大量增殖, 需赋予移植肝细胞更强的生长或生存优势, 和/或受体肝细胞增殖受到抑制[7-9]. Fas是一种细胞表面信号分子, 属于肿瘤坏死因子受体超家族成员[10]. 当与Fas配体或特异性抗体(如JO2)结合后, Fas启动细胞凋亡[11]. JO2是从仓鼠体内衍生而制的针对鼠特异性致凋亡的抗体[12-14], 且具有明显的嗜肝性, 肝细胞对JO2抗体所诱导的细胞凋亡非常敏感, 给小鼠注射小剂量的JO2不会引起肝外组织器官明显损伤, 却可造成肝细胞大面积的凋亡, 引起动物出现爆发性肝衰竭症状和死亡[15-16]. 因此, 采用小剂量JO2抗体多次注射裸鼠腹腔内, 诱导鼠肝细胞损伤, 使移植到裸鼠的人胎肝细胞具有增殖优势, 这种方便易行的利于异种细胞移植的方法国内尚无报道, 为建立人鼠嵌合肝探索一种新的策略.
BALB/C-nu/nu的♂无胸腺裸鼠65只购自北京实验动物中心, 本校实验室SPF级动物房饲养. 选择鼠龄6 wk, 体质量15-20 g为实验对象.
1.2.1 人胎肝细胞移植: 经西南医院伦理委员会同意, 并由产妇签署知情同意书. 选择孕期20 wk死胎. 采用体外两步灌注法[17]分离人胎肝细胞, 并用液氮罐保存以备用. 试验时取出冻存的人胎肝细胞, 移入离心管, 缓慢加入4℃培养液等倍稀释, 30 r/min离心3 min, 弃上清液, 重复2次; 重新混悬于培养液中. 于倒置相差显微镜(日本Olympus公司)下用血细胞计数板计算肝细胞的数量, 台盼蓝拒染法计算胎肝细胞的存活率, 超过80%的用于实验(其中90%为胎肝实质细胞). 戊巴比妥钠肌注麻醉, 小鼠腹白线逐层剪开, 暴露脾, 自脾系膜缘进针, 向脾体和脾尾方向, 将100 μL人胎肝细胞培养液(含1×106个细胞)缓慢注入, 轻压注射点, 退针处用吸收性海绵明胶止血.
1.2.2 JO2抗体给药方式和标本采集: 30只经人胎肝细胞移植的裸鼠于第2天, 给予JO2抗体(BD, pharmingen)ip, 剂量为 0.2 mg/kg, 1 次/wk, 共12 wk为实验组; 30只经人胎肝细胞移植后未ip JO2抗体为对照组; 5只裸鼠未经人胎肝细胞移植而用JO2抗体, 0.2 mg/kg, ip后24 h处死肝组织病理切片观察. 实验组和对照组从2 wk开始, 后4、8、12、16、20、24 wk各处死4只小鼠, 进行组织学观察.
1.2.3 JO2抗体: ip后肝组织HE染色和原位末端标记方法检测细胞凋亡(TUNEL染色): 40 g/L多聚甲醛固定肝组织, 经石蜡包埋、切片, 苏木精和伊红染色(HE染色), 光镜下常规病理检查. 按照TUNEL试剂盒(Roche)说明书操作, 最后常规DAB显色, 苏木素复染, 中性树胶封固可在显微镜下观察细胞核中棕黄着色的凋亡细胞.
1.2.4 免疫组织化学检测嵌合鼠肝组织人白蛋白(albumin, ALB)表达: 采用链酶菌亲生物素蛋白-过氧化酶法免疫组织化学染色(S-P试剂盒, Maixin公司), 获取新鲜鼠肝组织用40 g/L多聚甲醛固定, 石蜡包埋后切片, 常规脱蜡、洗涤、过氧化氢阻断10 min. 加鼠抗人ALB mAb为一抗(Sigma公司, 滴度1:200)4℃过夜. PBS替代一抗作阴性对照. 然后滴加生物素标记二抗, 底物用DAB. 最后以苏木精复染, 中性树胶封片, 光镜下观察染色情况.
1.2.5 免疫组织化学检测嵌合鼠肝组织特异人增殖细胞核抗原(PCNA)表达: 采用S-P法染色, 方法同上, 一抗为特异性人增殖细胞核抗原mAb(DAKO公司, 滴度1:100), 光镜观察结果. PCNA以细胞核呈界限清楚的棕色反应为阳性结果判定标准. 每张切片随机选取5个高倍视野, 半定量计算每个高倍视野下100个细胞内的阳性细胞数, 取均值, 以百分数表示细胞增殖指数.
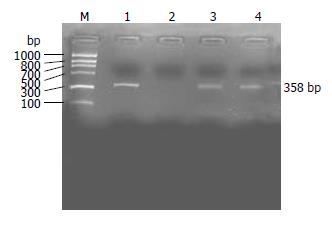
1.2.6 RT-PCR检测肝组织人ALB mRNA: 按照Tripure RNA提取试剂(Roche公司)操作说明抽提大鼠肝组织总RNA, 采用Promega一步法RT-PCR试剂盒(Promega公司)进行逆转录扩增.引物由上海Sangon公司合成. 人ALB mRNA引物, 正向引物Hs: 5'-GTAATCGGTTGGCAGCCAATG-3', 逆向引物Ha: 5'-GGTAGAAGTGATTTGTCAC-3', 扩增目的片断为358 bp[18]. 扩增引物序列经Pub-Med上比对与小鼠未发现同源性. PCR扩增条件: 48℃逆转录45 min, 95℃变性2 min, 而后94℃变性1 min; 55℃退火1 min; 72℃延伸1 min; 共35个循环, 最后72℃延伸10 min. 采用未加入AMV反转录酶的扩增作为阴性对照以排除假阳性的可能. 产物经150 g/L琼脂糖凝胶电泳, 溴化乙锭染色后于凝胶成像仪上获取图像.
统计学处理 SPSS统计软件包对实验结果进行统计分析. 检测指标以mean±SD表示, 各时间点两组间比较采用t检验, P<0.05为差异有统计学意义.
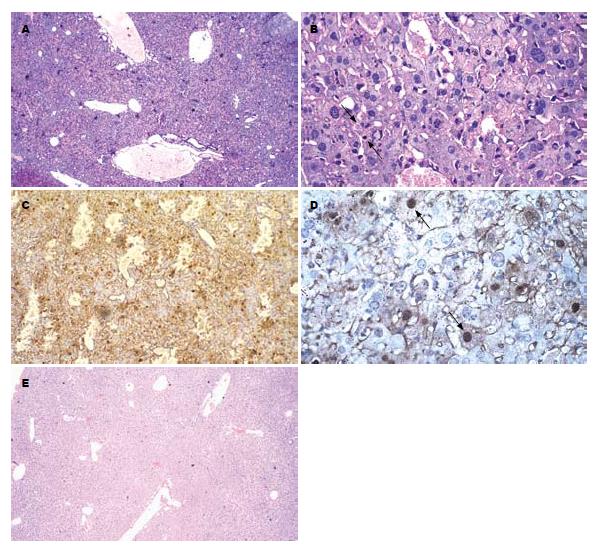
裸鼠未经人胎肝细胞移植而用JO2抗体ip后, 出现不同程度的懒动、倦怠、厌食, 24 h后处死. 取肝组织HE染色显示肝脏汇管区单核细胞浸润, 肝细胞点、灶状坏死灶, 并可见中央小静脉、肝窦和叶间静脉扩张, 出血, 肝细胞结构模糊, 有凋亡小体及弥漫性炎细胞浸润. TUNEL染色可见观察组肝组织大量细胞核被棕黄色深染的凋亡细胞(图1A-D). 而实验组和对照组小鼠外观、活动无异常, 存活超过24 wk. 实验组经JO2抗体4 wk处理, HE染色显示肝组织只见少量充血, 管腔无明显扩张, 肝组织结构完整, 无明显坏死灶(图1E).
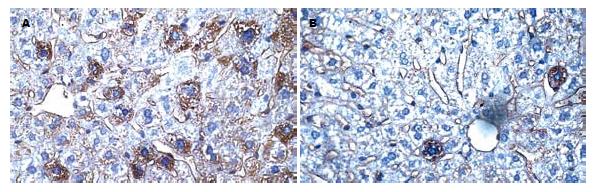
移植后2 wk处死的实验组和对照组鼠肝组织中即能检测到人ALB阳性细胞的表达, 主要位于肝细胞的胞质中, 呈棕黄色. 不过, 实验组鼠肝组织人ALB的表达可持续到移植后20 wk, 高峰期出现在12 wk, 而未用JO2抗体处理的对照组鼠肝组织人ALB的表达只持续到12 wk, 高峰期出现在4 wk. 比较实验组和对照组移植后8 wk的病理切片, 可见前者人ALB的阳性细胞表达明显多于后者(图2).
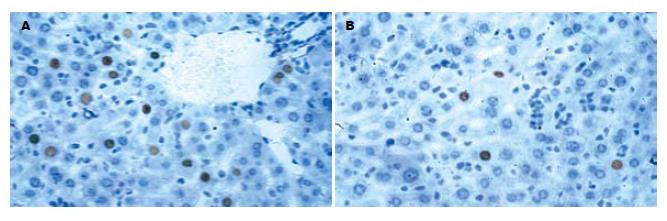
特异性人PCNA阳性细胞核经DAB显色后为棕色. 移植后2 wk处死的实验组和对照组鼠肝组织中即能检测到特异性人PCNA阳性细胞的表达. 实验组阳性细胞表达可持续到移植后20 wk, 12 wk表达最多, 而未用JO2抗体处理的对照组鼠肝组织只持续到12 wk, 4 wk表达最多(图3). 实验组与对照组移植后8、12 wk PCNA表达差异有显著性(P<0.05, 表1).
移植后4 wk实验组和对照组肝组织中即可检测到人ALB mRNA, 实验组持续到16 wk, 而对照组仅持续到8 wk. 采用人ALB mRNA引物作RT-PCR时, 可在嵌合鼠肝组织中检测到相应的人ALB mRNA条带(图4).
将人肝细胞移植到动物体内, 形成"嵌合肝", 甚至在动物体内重建人类肝组织, 以期获得理想的实验动物模型, 是当前肝病研究的一个重要方向. 对啮齿类动物的研究结果表明, 外源肝细胞移植到动物体内定植的基本条件有: 一是对外源肝细胞无免疫排斥; 二是必须削弱原有"土著"肝细胞对外源肝细胞生长的抑制作用; 三是需出现肝实质损害, 造成肝再生需求. 为解决免疫排斥的问题, 各国研究者多使用免疫缺陷小鼠, 如裸鼠(nu/nu)、RAG-2基因敲除小鼠(recombinase activing 2 gene, RAG-2)、SCID(severe combined immunodeficiency)小鼠以及为解决原有"土著"鼠肝细胞对进入的外源肝细胞增殖的竟争性抑制问题及造成肝再生需求, 采用的白蛋白-尿激酶型血浆素原激活剂转基因小鼠(albumin urokinase-type plasminogen activator, Alb-uPA)[19-21]. 同时, 如何使移植的细胞具有增殖优势对于人鼠嵌合肝的建立也意义重大: 在某些刺激增殖的信号存在时, 仅移植的细胞作出反应而受体肝细胞则不, 如生物碱(具有致癌性)[22], 可使受体肝细胞对刺激增殖信号变得无应答; 还可以人为地产生一些刺激增殖的信号, 能使移植的细胞优势生长, 如在移植前对受体进行部分肝切除、再灌注损伤、诱导Fas介导的肝细胞调亡等(均属于造成肝细胞损伤)和给与肝细胞有丝分裂刺激物(生长因子和甲状腺激素等)[23-25].
研究表明, 胎肝细胞有较高增殖能力、较低免疫原性和抵抗低温储存损伤等优点, 且易于操作、可重复性强是细胞移植的理想选择[26]. 人肝细胞可嵌入大/小鼠肝实质内, 形成"人鼠嵌合肝", 嵌入的人肝细胞形态及功能类似于人体内肝细胞, 并可成功感染HBV及HCV等人类嗜肝病毒[27-28]. 不过人胎肝细胞增殖能力虽然比成熟机体肝细胞要强些, 但他毕竟是一种正常细胞, 而且受宿主体内环境的影响, 不可能无限增殖下去. 裸鼠虽缺乏有功能的T淋巴细胞, 但仍有一定的自然杀伤细胞, 在我们未采取措施时, 对照组经脾移植人肝细胞在裸鼠体内能够存活, 人胎肝细胞分布稀疏, 数量较少, 嵌合鼠肝组织表达人ALB和人PCNA阳性细胞时间为2-12 wk, 检测到肝组织人ALB mRNA表达仅为4-8 wk. 人肝细胞存活时间短, 提示机体对肝细胞增殖的需求可能不足.
我们结合JO2抗体诱导受体小鼠肝细胞凋亡损伤的策略, 经人胎肝细胞脾脏移植裸鼠, 采用免疫组化发现实验组移植后2-20 wk肝组织均表达人ALB和PCNA阳性细胞, RT-PCR检测到鼠肝组织人ALB mRNA的时间为移植后4-16 wk. 肝脏是人体ALB唯一的合成器官, 蛋白质的合成是个复杂的耗能过程, 包括氨基酸的跨膜转运、多肽链的合成等. 因此, ALB的检测可代表肝脏的合成和储备功能. 实验组和对照组中人ALB的检测能够直观说明人肝细胞在小鼠肝组织中不仅存活, 而且具有正常人肝细胞一定的生物学功能. PCNA是一种与细胞周期相关的增殖细胞核抗原, 常用来评估细胞的增殖活跃程度, 他由261个氨基酸组成, 分子质量为36 kDa, 仅着色于核浆中. 静止细胞中PCNA含量很少, 其表达的多少与DNA复制和修复有关. 本研究中, 实验组和对照组均在人肝细胞移植后2 wk发现PCNA表达, 不过实验组PCNA的表达在不同时相点均高于对照组, 肝细胞PCNA标记指数的差异有统计学意义, 且表达时间明显延长, 提示JO2诱导小鼠肝细胞凋亡损伤给移植物生长提供了空间, 引发了移植人胎肝细胞持续增殖、再生的需求, 而人胎肝细胞在受体肝损伤状态下, 更有益于自身的定植生长、分化和存活.
另外, 我们用JO2抗体ip未移植人肝细胞的裸鼠, 24 h后获取病理组织切片发现鼠肝组织的严重出血、坏死损伤和细胞凋亡, 证实JO2抗体致小鼠肝细胞凋亡特性. Fas抗原在心、肺也有大量表达[29], 然而在我们试验中并未发现小剂量的JO2反复注射足够引发肝外组织的凋亡, 即使JO2抗体的使用达12 wk之久, 与文献报道一致[30].
Fas是重要的诱导凋亡的受体, 肝脏的许多细胞表达Fas, 小剂量JO2抗体特异性诱导体内小鼠肝细胞凋亡这种特性在小鼠作为肝移植受体的同种或异种基因移植中有重要的作用[31]. Gilgenkrantz et al巧妙的把Fas和抗Fas诱导凋亡的Bcl-2基因同应用于异源肝细胞移植: 首先使用逆转录病毒载体将Bcl-2基因转入异源鼠肝细胞中, 然后经过脾内注射途径植入正常的小鼠肝内, 接着用亚致死量的JO2抗体iv, 1 次/wk, 重复诱导10次, 并辅以一定量的免疫抑制剂[32-34]. 这一方法的原理是用Bcl-2赋予异源肝细胞抗凋亡的生存优势, 用亚致死剂量的JO2抗体逐步地凋亡不具有抗凋亡能力的原有"土著"鼠肝细胞, 一方面削弱了其对异源肝细胞的竟争性抑制作用, 并让出生长空间. 另一方面机体在失去大量原有肝细胞后产生了强烈的再生要求. 在这些多因素的共同作用下, 转基因异源肝细胞得以增殖而成为嵌合肝脏的主体细胞. 此外, Wilson et al将大鼠肝细胞移植到小鼠体内过程中, 经JO2抗体重复诱导, 使大鼠肝细胞重构小鼠肝脏超过50%[23]. 这种诱导小鼠肝细胞Fas凋亡特性提高移植物在嵌合肝中比例的实际效能, 在异体肝细胞移植中发挥着重要作用, 可为相关研究提供一种可靠、价廉、易用的动物模型.
人肝细胞移植到鼠体内能够长时间存活并保持功能是能够运用人鼠嵌合肝作为理想动物模型的首要条件. 要使移植肝细胞大量增殖, 需赋予移植肝细胞更强的生长或生存优势, 和/或受体肝细胞增殖受到抑制. 本文运用Fas受体激动剂JO2抗体能特异性诱导小鼠肝细胞凋亡的特性, 诱导鼠肝细胞逐步凋亡, 削弱其对植入的人肝细胞的竟争性抑制作用, 并让出生长空间, 同时也造成小鼠对肝细胞的再生需求, 使人肝细胞在JO2处理的人鼠嵌合肝中存活达20 wk.
朱传武, 副主任医师, 江苏省苏州市第五人民医院传染科; 赵桂鸣, 主任医师, 天津市肝病研究所天津市传染病医院慢性肝炎科
Wilson et al将大鼠肝细胞移植到小鼠体内, 经JO2抗体重复诱导, 可使大鼠肝细胞重构小鼠肝脏超过50%.
本文建立人鼠嵌合肝模型, 着重探讨诱导受体小鼠肝损伤而使移植的人肝细胞得以增殖和存活的可行性, 以期获得建立该实验动物模型较为理想的方法和途径.
人胎肝细胞移植及联合使用JO2抗体, 能延长人胎肝细胞在人鼠嵌合肝中的存活时间, 提高增殖能力, 有望获得稳定的持续性的动物模型.
本研究设计合理, 方法得当, 结果较为理想, 讨论充分, 有望为人类嗜肝病毒的研究提供简便的"人鼠嵌合肝"动模模型, 具有现实意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Kemper RA, Nabb DL, Gannon SA, Snow TA, Api AM. Comparative metabolism of geranyl nitrile and citronellyl nitrile in mouse, rat, and human hepatocytes. Drug Metab Dispos. 2006;34:1019-1029. [PubMed] |
| 2. | Ohashi K, Park F, Kay MA. Hepatocyte transplantation: clinical and experimental application. J Mol Med. 2001;79:617-630. [PubMed] [DOI] |
| 3. | Jirtle RL, Michalopoulos G, McLain JR, Crowley J. Transplantation system for determining the clonogenic survival of parenchymal hepatocytes exposed to ionizing radiation. Cancer Res. 1981;41:3512-3518. [PubMed] |
| 4. | Petersen J, Dandri M, Gupta S, Rogler CE. Liver repopulation with xenogenic hepatocytes in B and T cell-deficient mice leads to chronic hepadnavirus infection and clonal growth of hepatocellular carcinoma. Proc Natl Acad Sci U S A. 1998;95:310-315. [PubMed] [DOI] |
| 5. | Dandri M, Burda MR, Gocht A, Török E, Pollok JM, Rogler CE, Will H, Petersen J. Woodchuck hepatocytes remain permissive for hepadnavirus infection and mouse liver repopulation after cryopreservation. Hepatology. 2001;34:824-833. [PubMed] [DOI] |
| 6. | Mercer DF, Schiller DE, Elliott JF, Douglas DN, Hao C, Rinfret A, Addison WR, Fischer KP, Churchill TA, Lakey JR. Hepatitis C virus replication in mice with chimeric human livers. Nat Med. 2001;7:927-933. [PubMed] [DOI] |
| 7. | Grompe M. Principles of therapeutic liver repopulation. J Inherit Metab Dis. 2006;29:421-425. [PubMed] [DOI] |
| 8. | Brezillon N, Lambert-Blot M, Morosan S, Couton D, Mitchell C, Kremsdorf D, Costa RH, Gilgenkrantz H, Guidotti JE. Transplanted hepatocytes over-expressing FoxM1B efficiently repopulate chronically injured mouse liver independent of donor age. Mol Ther. 2007;15:1710-1715. [PubMed] [DOI] |
| 9. | Masumoto N, Tateno C, Tachibana A, Utoh R, Morikawa Y, Shimada T, Momisako H, Itamoto T, Asahara T, Yoshizato K. GH enhances proliferation of human hepatocytes grafted into immunodeficient mice with damaged liver. J Endocrinol. 2007;194:529-537. [PubMed] [DOI] |
| 10. | Itoh N, Yonehara S, Ishii A, Yonehara M, Mizushima S, Sameshima M, Hase A, Seto Y, Nagata S. The polypeptide encoded by the cDNA for human cell surface antigen Fas can mediate apoptosis. Cell. 1991;66:233-243. [PubMed] [DOI] |
| 12. | Huang DC, Hahne M, Schroeter M, Frei K, Fontana A, Villunger A, Newton K, Tschopp J, Strasser A. Activation of Fas by FasL induces apoptosis by a mechanism that cannot be blocked by Bcl-2 or Bcl-x(L). Proc Natl Acad Sci U S A. 1999;96:14871-14876. [PubMed] [DOI] |
| 13. | Malhi H, Gores GJ, Lemasters JJ. Apoptosis and necrosis in the liver: a tale of two deaths? Hepatology. 2006;43:S31-S44. [PubMed] [DOI] |
| 14. | Adachi M, Watanabe-Fukunaga R, Nagata S. Aberrant transcription caused by the insertion of an early transposable element in an intron of the Fas antigen gene of lpr mice. Proc Natl Acad Sci U S A. 1993;90:1756-1760. [PubMed] [DOI] |
| 15. | Zhang H, Taylor J, Luther D, Johnston J, Murray S, Wyatt JR, Watt AT, Koo S, York-DeFalco C, Stecker K. Antisense oligonucleotide inhibition of Bcl-xL and Bid expression in liver regulates responses in a mouse model of Fas-induced fulminant hepatitis. J Pharmacol Exp Ther. 2003;307:24-33. [PubMed] [DOI] |
| 16. | Yonehara S. Death receptor Fas and autoimmune disease: from the original generation to therapeutic application of agonistic anti-Fas monoclonal antibody. Cytokine Growth Factor Rev. 2002;13:393-402. [PubMed] [DOI] |
| 17. | Mito M, Kusano M, Kawaura Y. Hepatocyte transplantation in man. Transplant Proc. 1992;24:3052-3053. [PubMed] |
| 18. | Karligiotou E, Kollia P, Kallitsaris A, Messinis IE. Expression of human serum albumin (HSA) mRNA in human granulosa cells: potential correlation of the 95 amino acid long carboxyl terminal of HSA to gonadotrophin surge-attenuating factor. Hum Reprod. 2006;21:645-650. [PubMed] [DOI] |
| 19. | Dandri M, Burda MR, Török E, Pollok JM, Iwanska A, Sommer G, Rogiers X, Rogler CE, Gupta S, Will H. Repopulation of mouse liver with human hepatocytes and in vivo infection with hepatitis B virus. Hepatology. 2001;33:981-988. [PubMed] [DOI] |
| 20. | Nicolini FE, Cashman JD, Hogge DE, Humphries RK, Eaves CJ. NOD/SCID mice engineered to express human IL-3, GM-CSF and Steel factor constitutively mobilize engrafted human progenitors and compromise human stem cell regeneration. Leukemia. 2004;18:341-347. [PubMed] [DOI] |
| 21. | Turrini P, Sasso R, Germoni S, Marcucci I, Celluci A, Di Marco A, Marra E, Paonessa G, Eutropi A, Laufer R. Development of humanized mice for the study of hepatitis C virus infection. Transplant Proc. 2006;38:1181-1184. [PubMed] [DOI] |
| 22. | Koenig S, Stoesser C, Krause P, Becker H, Markus PM. Liver repopulation after hepatocellular transplantation: integration and interaction of transplanted hepatocytes in the host. Cell Transplant. 2005;14:31-40. [PubMed] [DOI] |
| 23. | Wilson JH, Paturzo FX, Johnson LK, Carreiro MP, Hixson DC, Mennone A, Boyer JL, Pober JS, Harding MJ. Rat hepatocyte engraftment in severe combined immunodeficient x beige mice using mouse-specific anti-fas antibody. Xenotransplantation. 2006;13:53-62. [PubMed] [DOI] |
| 24. | Kosone T, Takagi H, Horiguchi N, Kakizaki S, Sato K, Watanabe Y, Mori M. Transforming growth factor-alpha accelerates hepatocyte repopulation after hepatocyte transplantation. J Gastroenterol Hepatol. 2008;23:260-266. [PubMed] [DOI] |
| 25. | Oren R, Dabeva MD, Karnezis AN, Petkov PM, Rosencrantz R, Sandhu JP, Moss SF, Wang S, Hurston E, Laconi E. Role of thyroid hormone in stimulating liver repopulation in the rat by transplanted hepatocytes. Hepatology. 1999;30:903-913. [PubMed] [DOI] |
| 26. | Kulig KM, Vacanti JP. Hepatic tissue engineering. Transpl Immunol. 2004;12:303-310. [PubMed] [DOI] |
| 27. | Tsuge M, Hiraga N, Takaishi H, Noguchi C, Oga H, Imamura M, Takahashi S, Iwao E, Fujimoto Y, Ochi H. Infection of human hepatocyte chimeric mouse with genetically engineered hepatitis B virus. Hepatology. 2005;42:1046-1054. [PubMed] [DOI] |
| 28. | Hiraga N, Imamura M, Tsuge M, Noguchi C, Takahashi S, Iwao E, Fujimoto Y, Abe H, Maekawa T, Ochi H. Infection of human hepatocyte chimeric mouse with genetically engineered hepatitis C virus and its susceptibility to interferon. FEBS Lett. 2007;581:1983-1987. [PubMed] [DOI] |
| 29. | Watanabe-Fukunaga R, Brannan CI, Itoh N, Yonehara S, Copeland NG, Jenkins NA, Nagata S. The cDNA structure, expression, and chromosomal assignment of the mouse Fas antigen. J Immunol. 1992;148:1274-1279. [PubMed] |
| 30. | Jodo S, Kung JT, Xiao S, Chan DV, Kobayashi S, Tateno M, Lafyatis R, Ju ST. Anti-CD95-induced lethality requires radioresistant Fcgamma RII+ cells. A novel mechanism for fulminant hepatic failure. J Biol Chem. 2003;278:7553-7557. [PubMed] [DOI] |
| 31. | Faouzi S, Burckhardt BE, Hanson JC, Campe CB, Schrum LW, Rippe RA, Maher JJ. Anti-Fas induces hepatic chemokines and promotes inflammation by an NF-kappa B-independent, caspase-3-dependent pathway. J Biol Chem. 2001;276:49077-49082. [PubMed] [DOI] |
| 32. | Mignon A, Guidotti JE, Mitchell C, Fabre M, Wernet A, De La Coste A, Soubrane O, Gilgenkrantz H, Kahn A. Selective repopulation of normal mouse liver by Fas/CD95-resistant hepatocytes. Nat Med. 1998;4:1185-1188. [PubMed] [DOI] |
| 33. | Mitchell C, Mallet VO, Guidotti JE, Goulenok C, Kahn A, Gilgenkrantz H. Liver repopulation by Bcl-x(L) transgenic hepatocytes. Am J Pathol. 2002;160:31-35. [PubMed] |