修回日期: 2008-03-29
接受日期: 2008-05-10
在线出版日期: 2008-05-18
目的: 观察CpG-ODN 2216对乙型肝炎病毒(hepatitis B virus, HBV)感染者外周血单个核细胞(peripheral blood mononuclear cells, PBMC)中B淋巴细胞抗原提呈相关分子CD80、CD86、MHC-Ⅰ和MHC-Ⅱ分子表达的影响, 同时观察CpG对Th1型细胞因子分泌的影响.
方法: 取HBV感染者PBMC与CpG-ODN 2216共培养48 h, 用流式细胞技术检测B淋巴细胞表面CD80、CD86、MHC-Ⅰ和MHC-Ⅱ分子的表达, 并与未加CpG组进行比较, 同时检测培养液中Th1型细胞因子白介素-12(IL-12)和干扰素-γ(IFN-γ)的水平.
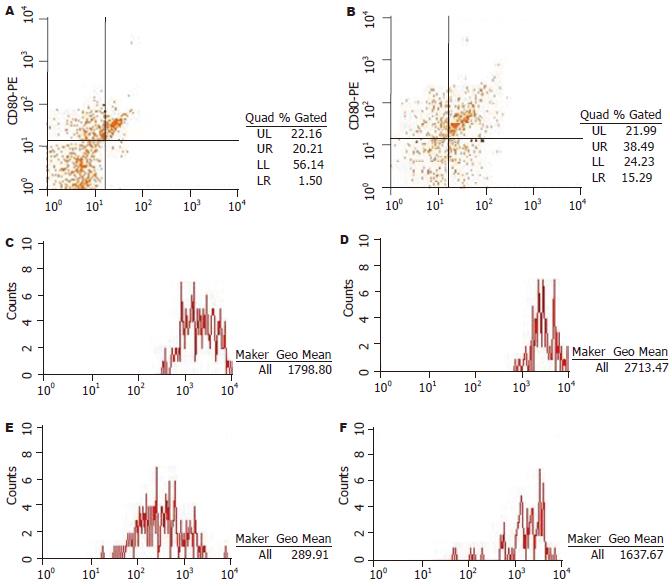
结果: 经CpG-ODN 2216活化刺激后, PBMC中B淋巴细胞抗原提呈相关分子CD80、CD86、MHC-Ⅰ及MHC-Ⅱ分子的表达显著高于对照组(CD80: 48.84%±21.29% vs 28.57%±18.7%; CD86: 50.12%±19.70% vs 13.15%±8.81%; MHC-Ⅰ: 2108.88±289.04 vs 1679.22±388.22; MHC-Ⅱ: 1602.77±362.61 vs 941.88±237.35; 均P<0.05); 并且培养液中IFN-γ及IL-12的水平也显著高于对照组(IFN-γ: 61.38±38.81 ng/L vs 47.35±38.76 ng/L; IL-12: 7.80±4.34 ng/L vs 5.56±3.56 ng/L; 均P<0.05).
结论: CpG-ODN 2216能够提高HBV感染者B淋巴细胞表面抗原提呈相关分子和共刺激分子的表达, 同时提高PBMC分泌Th1型细胞因子的能力.
引文著录: 刘勇, 吴超, 陈军浩, 陈广梅, 薛世贵, 严晓敏. CpG对HBV感染者B细胞及Th1型细胞因子的活化作用. 世界华人消化杂志 2008; 16(14): 1573-1576
Revised: March 29, 2008
Accepted: May 10, 2008
Published online: May 18, 2008
AIM: To determine the effects of immunos-timulatory action of CpG-ODN 2216 on the activation of B lymphocytes and Th1-type cytokines derived from peripheral blood mononuclear cells (PBMCs) of patients infected with hepatitis B virus (HBV).
METHODS: PBMCs from donors infected with HBV were cultured in the presence of CpG-ODN 2216 for 48 h; B lymphocytes were analyzed for CD19/CD86, CD19/CD80, major histocompatibility complex (MHC) class II and class I using flow cytometry. The supernatant levels of interleukin-12 (IL-12) and interferon-γ (IFN-γ) were detected by enzyme-linked immunosorbent assay (ELISA).
RESULTS: CpG-ODN 2216 promoted a strong up-regulation of CD86, CD80, MHC-I and MHC-II on B lymphocytes in HBV-infected patients (CD80: 48.84% ± 21.29% vs 28.57% ± 18.70%; CD86: 50.12% ± 19.70% vs 13.15% ± 8.81%; MHC-I: 2108.88 ± 289.04 vs 1679.22 ± 388.22; MHC-II: 1602.77 ± 362.61 vs 941.88 ± 237.35; all P < 0.05). IL-12 and IFN-γ levels in the stimulated supernatant were increased significantly (IFN-γ: 61.38 ± 38.81 ng/L vs 47.35 ± 38.76 ng/L; IL-12: 7.80 ± 4.34 ng/L vs 5.56 ± 3.56 ng/L; both P < 0.05).
CONCLUSION: CpG-ODN 2216 up-regulates the expression of B lymphocyte antigen presenting and costimulatory molecules on the surface of B lymphocytes derived from HBV-infected patients, and promotes the capability of PBMCs in secreting Th1-type cytokines.
- Citation: Liu Y, Wu C, Chen JH, Chen GM, Xue SG, Yan XM. Immunostimulatory effects of CpG-ODN 2216 on the activation of peripheral blood B lymphocytes and Th1-type cytokines from patients with hepatitis B virus infection. Shijie Huaren Xiaohua Zazhi 2008; 16(14): 1573-1576
- URL: https://www.wjgnet.com/1009-3079/full/v16/i14/1573.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i14.1573
CpG基序(motif)或者称为免疫刺激序列(immu-nostimulatory sequences, ISS)是指非甲基化胞嘧啶-鸟嘌呤两侧具有特定碱基的双脱氧核苷酸序列, 他可以活化免疫细胞, 激发机体产生Th1型为主要的免疫应答. CpG序列除能刺激B细胞,减少B细胞凋亡外, 还能使B细胞表面MHC-Ⅱ类抗原和共刺激因子表达量增加[1]. 但CPG对于乙型肝炎病毒(hepatitis B virus, HBV)感染者的B细胞的活化作用目前尚未有报道, 本实验选择CpG-ODN 2216对HBV感染者外周血单个核细胞(peripheral blood mononuclear cells, PBMC)进行刺激活化, 以观察CPG对HBV感染者的免疫活化作用.
CpG-ODN 2216委托上海生物工程技术服务有限公司合成, 全硫代修饰. CpG-ODN 2216序列为5'-GGG GGA CGA TCG TCG GGG GG-3'. RPMI 1640购自Gibco; 胎牛血清购自Hyclone. PE anti-human MHC-Ⅱ、FITC anti-human MHC-Ⅰ, PE anti-human CD80, FITC anti-human CD86及CD19-APC均为BD Pharmingen公司产品. Facs Calibur流式细胞仪为美国BD公司产品. 人白介素-12(interleukin 12, IL-12)和干扰素-γ(interferon-γ, IFN-γ)的酶联免疫吸附实验(ELISA)检测试剂为晶美公司产品. 按2001年公布的《病毒性肝炎防治方案》[2], 选择HBV感染者9例, 表面抗原(HBsAg) 阳性6 mo以上的患者, 均不伴肝功能异常.
抽取HBV感染者外周血5 mL, 以肝素抗凝. 淋巴细胞分离液分离PBMC. 调整细胞浓度为2×109/L, 加入到24孔培养板中, 1 mL/孔. 每例设一对照孔(PBS代替CpG, 与加入CpG的细胞组在共同条件下培养), 另一孔加入2 µg CpG-ODN 2216, 37℃, 50 mL/L CO2条件下培养48 h. 取出细胞以PBS洗涤1次, 三色荧光法标记细胞表面抗原提呈相关分子(MHC-Ⅰ-PE/MHC-Ⅱ-FITC/CD19-PreCP、CD80-PE/CD86-FITC/CD19-PreCP), 用流式细胞仪 "设门"于CD19阳性淋巴细胞, 分析B淋巴细胞表面MHC-Ⅰ、MHC-Ⅱ、CD80、CD86的表达量. CD80、CD86的表达量以阳性细胞百分比表示, MHC-Ⅰ、MHC-Ⅱ的表达量以几何平均荧光强度表示. 细胞培养48 h后收集培养上清夜, ELISA方法检测培养液中IFN-γ及IL-12含量, 所有操作均严格按照试剂盒操作说明书进行.
统计学处理 使用SPSS11.5统计软件. 组间比较用配对t检验. P<0.05为有显著性差异.
CpG-ODN 2216刺激PBMC 48 h后, B细胞表面抗原提呈相关分子CD80、CD86、MHC-Ⅰ及MHC-Ⅱ的表达显著增加(P<0.05, 图1, 表1).
经CpG-ODN 2216刺激后, PBMC培养上清夜中分泌的Th1型细胞因子IFN-γ和IL-12水平明显提高, 与对照组相比有显著差异(IFN-γ: 61.38±38.81 ng/L vs 47.35±38.76 ng/L; IL-12: 7.8±4.34 ng/L vs 5.56±3.56 ng/L, 均P<0.05).
CpG-ODN刺激免疫细胞应答主要通过细胞表面的CpG基序受体实现的, 现已明确Toll样受体9(Toll-like receptor 9, TLR9)是CpG基序受体的必要成份[3]. Li et al[4]研究表明, TLR9主要表达在DC2和B细胞上, 而DC1、单核细胞、T淋巴细胞、NK细胞只微弱表达或不表达TLR9. 因此, CpG-ODN诱导Th0细胞向Th1细胞转化可能是通过抗原提呈细胞(antigen presentation cells, APC)以及释放Th1型细胞因子间接作用的结果[5]. 研究表明CpG-ODN可显著提高B淋巴细胞共刺激分子CD80、CD86及MHCⅠ、Ⅱ类分子的表达[6], 增强其提呈抗原的能力, 同时CpG-ODN也能促进IFN-α、IL-12等Th1型细胞因子的分泌[7], 诱导机体的免疫水平向Th1方向极化.
成人慢性乙肝体内免疫耐受的机制目前尚不清楚. 不过与最终能够完全清除病毒而康复的急性乙肝患者强大的T细胞反应相比, 慢性乙肝的一个特点就是对抗病毒的CD4+和CD8+T细胞反应显著减少[8], 针对HBV特异性的CTL不能有效清除病毒, 这些可能导致病毒的持续存在. HBV转基因鼠就是主要表现为体内的免疫系统对HBV的耐受, 而通过改变转基因鼠体内的T细胞反应可以打破其对HBV的免疫耐受[9]. 以往研究通过HBV抗原冲击抗原提呈细胞树突状细胞(dendritic cell, DC)在乙肝治疗方面取得了一定的疗效[10-12]. 但是, 由于树突状细胞在制备上存在许多问题, 在临床上应用难度大、成本高、效率低. 人们已熟知B细胞在体液免疫应答中的重要作用, 而B细胞作为一种APC, 越来越受到广泛的重视, 研究表明, B细胞经CD40L等刺激后可完全代替树突状细胞发挥APC的作用[13-14]. 而本实验通过CpG-ODN 2216刺激HBV感染者抗原提呈细胞B细胞, 使B细胞的抗原提呈能力得到了增强, 结果显示HBV感染者体内B淋巴细胞受CpG-ODN 2216刺激后, 其抗原提呈相关表面分子MHCⅠ、MHCⅡ、CD80、CD86等的表达均显著增加. 而这些相关分子的高表达增强了APC的共刺激能力, 加强APC对T淋巴细胞的活化能力, 使T淋巴细胞更容易识别抗原进行免疫应答, 从而可能达到清除HBV的目的.
IFN-γ及IL-12均属于Th1型细胞因子. IL-12是一种由APC产生的异源二聚体细胞因子, 能促使Th0细胞向Th1细胞分化并增强细胞毒性T淋巴细胞及NK细胞的杀伤活性[15], 其分泌水平的升高可反映APC功能及细胞免疫水平的提高[16], 同时IL-12能够诱导T细胞和NK细胞分泌IFN-γ, 启动Th1型细胞免疫反应. 而IFN-γ又可以放大IL-12依赖的Th1分化, 抑制Th0细胞向Th2分化[17-18]. 这些性质提示IL-12及IFN-γ在抗病毒免疫反应中起重要作用. 研究表明当B细胞向APC活化时可以促使IFN-γ及IL-12的分泌[11]. 本实验中HBV感染者的PBMC经CPG-ODN 2216刺激48 h后培养液中的IL-12和IFN-γ水平就显著增加, 由于PBMC中树突状细胞含量极低, 因而IL-12和IFN-γ水平的升高极有可能是由于B细胞的抗原提呈能力的增强而引起的. 而IL-12和IFN-γ水平的升高为Th0细胞向Th1细胞分化提供了良好的微环境, 对于改善HBV感染者Th1/Th2细胞平衡状况具有免疫促进作用, 从而可能在治疗HBV慢性感染方面具有一定的作用.
HBV慢性感染者存在着针对HBV的免疫耐受, 表现为特异性免疫细胞免疫低下及Th1及Th2的比例失衡. 回顾性的研究资料表明, CpG-ODN能活化免疫细胞及促进Th1型细胞因子的表达.
冯志杰, 主任医师, 河北医科大学第二医院消化内科; 陈国凤, 主任医师, 中国人民解放军第302医院感染七科
CpG-ODN可以活化免疫细胞, 激发机体产生Th1型为主的免疫应答. CpG-ODN在抗肿瘤、变态反应和传染病等领域的研究是当前的热点.
CpG-ODN2216能够活化HBV感染者B细胞及促进Th1型细胞因子的表达, 对于今后以CpG-ODN 2216为基础的抗HBV感染免疫治疗提供新的思路.
本研究目的明确, 方法先进, 结果可靠, 讨论条理清晰, 参考文献引用恰当, 具有较好的科学性.
编辑: 李军亮 电编:郭海丽
| 1. | Yi AK, Peckham DW, Ashman RF, Krieg AM. CpG DNA rescues B cells from apoptosis by activating NFkappaB and preventing mitochondrial membrane potential disruption via a chloroquine-sensitive pathway. Int Immunol. 1999;11:2015-2024. [PubMed] [DOI] |
| 3. | Jurk M, Vollmer J. Therapeutic applications of synthetic CpG oligodeoxynucleotides as TLR9 agonists for immune modulation. BioDrugs. 2007;21:387-401. [PubMed] |
| 4. | Li J, Song W, Czerwinski DK, Varghese B, Uematsu S, Akira S, Krieg AM, Levy R. Lymphoma immunotherapy with CpG oligodeoxynucleotides requires TLR9 either in the host or in the tumor itself. J Immunol. 2007;179:2493-2500. [PubMed] |
| 5. | Warren TL, Bhatia SK, Acosta AM, Dahle CE, Ratliff TL, Krieg AM, Weiner GJ. APC stimulated by CpG oligodeoxynucleotide enhance activation of MHC class I-restricted T cells. J Immunol. 2000;165:6244-6251. [PubMed] |
| 6. | Decker T, Schneller F, Sparwasser T, Tretter T, Lipford GB, Wagner H, Peschel C. Immunosti-mulatory CpG-oligonucleotides cause proliferation, cytokine production, and an immunogenic phenotype in chronic lymphocytic leukemia B cells. Blood. 2000;95:999-1006. [PubMed] |
| 7. | Becker Y. CpG ODNs treatments of HIV-1 infected patients may cause the decline of transmission in high risk populations - a review, hypothesis and implications. Virus Genes. 2005;30:251-266. [PubMed] [DOI] |
| 8. | Kakimi K, Isogawa M, Chung J, Sette A, Chisari FV. Immunogenicity and tolerogenicity of hepatitis B virus structural and nonstructural proteins: implications for immunotherapy of persistent viral infections. J Virol. 2002;76:8609-8620. [PubMed] [DOI] |
| 9. | Roh S, Kim K. Overcoming tolerance in hepatitis B virus transgenic mice: a possible involvement of regulatory T cells. Microbiol Immunol. 2003;47:453-460. [PubMed] |
| 10. | Li RB, Chen HS, Xie Y, Fei R, Cong X, Jiang D, Wang SX, Wei L, Wang Y. Dendritic cells from chronic hepatitis B patients can induce HBV antigen-specific T cell responses. World J Gastroenterol. 2004;10:1578-1582. [PubMed] |
| 11. | 司 方明, 娄 海山, 郑 鹏远, 熊 灵军, 范 毅凯, 李 俊红, 白 经修. 树突状细胞治疗HBeAg阴性慢性乙型肝炎患者的临床观察. 世界华人消化杂志. 2007;15:3746-3748. [DOI] |
| 12. | Zhang Y, Song S, Liu C, Wang Y, Xian X, He Y, Wang J, Liu F, Sun S. Generation of chimeric HBc proteins with epitopes in E.coli: formation of virus-like particles and a potent inducer of antigen-specific cytotoxic immune response and anti-tumor effect in vivo. Cell Immunol. 2007;247:18-27. [PubMed] [DOI] |
| 13. | Rodriguez-Pinto D. B cells as antigen presenting cells. Cell Immunol. 2005;238:67-75. [PubMed] [DOI] |
| 14. | Lapointe R, Bellemare-Pelletier A, Housseau F, Thibodeau J, Hwu P. CD40-stimulated B lymphocytes pulsed with tumor antigens are effective antigen-presenting cells that can generate specific T cells. Cancer Res. 2003;63:2836-2843. [PubMed] |
| 15. | Chang HD, Radbruch A. The pro- and anti-inflammatory potential of interleukin-12. Ann N Y Acad Sci. 2007;1109:40-46. [PubMed] [DOI] |
| 16. | Constantinescu CS, Tani M, Ransohoff RM, Wysocka M, Hilliard B, Fujioka T, Murphy S, Tighe PJ, Sarma JD, Trinchieri G. Astrocytes as antigen-presenting cells: expression of IL-12/IL-23. J Neurochem. 2005;95:331-340. [PubMed] [DOI] |
| 17. | Girart MV, Fuertes MB, Domaica CI, Rossi LE, Zwirner NW. Engagement of TLR3, TLR7, and NKG2D regulate IFN-gamma secretion but not NKG2D-mediated cytotoxicity by human NK cells stimulated with suboptimal doses of IL-12. J Immunol. 2007;179:3472-3479. [PubMed] |
| 18. | Iwabuchi N, Takahashi N, Xiao JZ, Miyaji K, Iwatsuki K. In vitro Th1 cytokine-independent Th2 suppressive effects of bifidobacteria. Microbiol Immunol. 2007;51:649-660. [PubMed] |