修回日期: 2008-04-02
接受日期: 2008-05-10
在线出版日期: 2008-05-18
目的: 研究shRNA干扰STAT3基因表达对胃癌细胞MKN-45体内外生物学特性的作用.
方法: 应用本实验室已构建并鉴定的STAT3基因的特异性小RNA干扰质粒(psiRNA-H1/STAT3), 使用脂质体转染MKN-45细胞, 实验分为对照组、psiRNA-H1转染组和psiRNA-H1/STAT3转染组3组. 通过RT-PCR和Western blot检测STAT3特异性小RNA干扰基因对胃癌细胞STAT3基因mRNA和蛋白表达的影响; MTT比色法检测细胞的生长抑制率; 流式细胞仪分析MKN-45细胞周期分布. 用各组MKN-45细胞建立移植瘤裸鼠模型, 筛选转染psiRNA-H1和psiRNA-H1/STAT3的MKN-45稳定细胞株观察裸鼠移植瘤的生长情况.
结果: 成功转染重组体的MKN-45细胞中STAT3 mRNA和蛋白表达明显下降(0.612±0.074 vs 1.937±0.043, P<0.05; 0.668±0.054 vs 2.005±0.064, P<0.01). G0/G=期细胞比例增高, 另一方面S期细胞比例降低, 细胞的增殖系数明显降低(25.42±3.48 vs 33.54±2.91, P<0.05). 移植瘤裸鼠模型显示, psiRNA-H1/STAT3组瘤体在体积上明显减小(4.47 cm3±0.18 cm3vs 13.65 cm3±5.64 cm3, P<0.05).
结论: 针对STAT3基因的特异性小RNA干扰质粒在体外能有效抑制人胃癌细胞系STAT3 mRNA和蛋白表达, 细胞增殖能力减弱, 在体内明显抑制肿瘤生长, 为STAT3基因靶向治疗提供一定的实验依据.
引文著录: 童强, 舒晓刚, 卢晓明, 黎维勇, 陶凯雄, 陈道达, 王国斌. shRNA干扰STAT3基因表达对胃癌细胞MKN-45体内外生物学特性的影响. 世界华人消化杂志 2008; 16(14): 1568-1572
Revised: April 2, 2008
Accepted: May 10, 2008
Published online: May 18, 2008
AIM: To determine the effect of knockdown of STAT3 expression by shRNA on the characteristics of human gastric carcinoma cell line MKN-45 in vitro and in vivo.
METHODS: Specific shRNA plasmids to STAT3 were constructed and identified, then transfected into MKN-45. Cells were divided into three groups: control group, psiRNA-H1 group as the negative group and psiRNA-H1/STAT3 group. Semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR) and Western blotting were used to detect the expression of STAT3 mRNA and protein respectively. MTT and flow cytometry were used to assess cell growth suppression and cell cycle distribution respectively. Models of xenograft in nude mice were established using the three-group cells, and the growth of stable ones was then observed.
RESULTS: Compared with the negative control cells, semi-quantitative RT-PCR and Western blotting showed that the expression of STAT3 mRNA (0.612 ± 0.074 vs 1.937 ± 0.043, P < 0.05) and protein (0.668 ± 0.054 vs 2.005 ± 0.064, P < 0.01) was down-regulated in the psiRNA-H1/STAT3 group. The subcloned recombinant plasmid expressing shRNA effectively inhibited MKN-45 cell growth and proliferation (25.42 ± 3.48 vs 33.54 ± 2.91, P < 0.05) while empty plasmid had no such specific effect. The volumes of xenografts in the psiRNA-H1/STAT3 transfection group were larger than those in the other groups (4.47 cm3 ± 0.18 cm3 vs 13.65 cm3 ± 5.64 cm3, P < 0.05).
CONCLUSION: Recombinant plasmid psiRNA-H1/STAT3 shRNA can specifically inhibit not only the expression of STAT3 mRNA and protein in vitro, but also the growth of cell line MKN-45 in vitro and in vivo.
- Citation: Tong Q, Shu XG, Lu XM, Li WY, Tao KX, Chen DD, Wang GB. Effect of knockdown of STAT3 gene expression by shRNA on the characteristics of gastric cancer cell line MKN-45 in vitro and in vivo. Shijie Huaren Xiaohua Zazhi 2008; 16(14): 1568-1572
- URL: https://www.wjgnet.com/1009-3079/full/v16/i14/1568.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i14.1568
信号传导及转录活化因子(signal transducers anactivators of transcription, STAT)是细胞因子和生长因子受体信号的下游效应物. 目前在哺乳动物中已鉴定出STAT家族的7个成员: STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6[1]. STAT3蛋白是近年来研究异常活跃的转录因子, 他是在研究IFN信号转导机制过程中被发现的, 近年来研究发现, STAT3具有强烈的抑制细胞凋亡、促进细胞增殖的作用, 参与了多种恶性肿瘤的发生、发展和演进[2-3]. 国内外关于STAT3在消化系统疾病中的研究才刚起步, 我们以往研究发现, STAT3在胃癌中呈高表达, 为本研究提供理论基础. 本研究以质粒psiRNA-hH1neo为基础, 将针对STAT3表达shRNA的重组质粒转染入胃癌MKN-45细胞, 在体内和体外进行研究, 以期在细胞内表达shRNA而沉默STAT3基因并特异地抑制MKN-45细胞生长增殖, 为胃癌的基因靶向治疗提供新的靶点和思路.
限制性内切酶BbsⅠ、AseⅠ为MBI公司产品; RPMI 1640培养基和新生牛血清, 美国Gibco公司; 脂质体Lipofectamine 2000、TRIzol, 美国Invitrogen公司; 逆转录试剂盒及Taq DNA聚合酶, 美国Fermentas公司; 胶回收试剂盒, 日本TaKaRa公司; X-gal和IPTG, Gibco-BRL公司; 兔抗人STAT3 mAb, 美国Santa Cruz公司; Western所用试剂, 晶美生物工程有限公司; 胃癌细胞系MKN-45购自武汉大学中国典型培养物保藏中心; BALB/c♀裸鼠由华中科技大学同济医学院动物实验中心提供; 载体质粒psiRNA-hH1neo华中科技大学同济医学院免疫学系提供. 从NCBI GenBank查找Stat3的基因序列(序列号: X75932), 利用siRNA设计软件在起始密码子下游寻找符合特征的靶序列, 并人工设计合成针对Stat3靶基因设计siRNA寡核苷酸序列, 正义链 5'-TCCCTGTTCTCTATCAGCACAATTCAAGAGATTGTGCTGATAGAGAACATT-3'; 反义链: 5'-CAAAAATGTTCTCTATCAGCACAATCTCTTGAATTGTGCTGATAGAGAACA-3'.
1.2.1 质粒转染: 胰酶消化细胞并计数, 将细胞接种于6孔细胞培养板, 用250 μL无血清培养基稀释10 μL Lipofectamine 2000转染试剂, 在5 min内同稀释的质粒DNA混合, 将复合物加入到每孔中, 在37℃, 50 mL/L CO2中保温48 h. 实验分为空白对照组(A组)、空白质粒psiRNA-H1转染组(B组)和psiRNA-H1/STAT3转染组(C组), 每组均设3个复孔.
1.2.2 RT-PCR检测STAT3 mRNA: 按Invitrogen公司TRIzol试剂使用氯仿和异丙醇抽提总RNA. 使用Fermentas公司逆转录试剂盒采用olig DT和逆转录酶合成cDNA链. PCR引物由应用软件Prima5.0设计, 由上海生工公司合成上游引物: 5'-GTCAGATGCCAAATGC -3'; 下游引物: 5'-CCTGGAGGCTTAGTGC -3',长度度为409 bp. β-actin上游引物 5'-TGTACGTTGCTATCCAGGCT-3'下游引物5'-CTCCTTAATGTCACGCACGA-3', 长度为248 bp. PCR反应体系(总体积25 μL): H2O 6 μL, 10 mmol/L dNTP 1 μL, 25 mmol/L MgCl2 2 μL, 10×Buffer 2.5 μL, 上, 下游引物各0.5 μL, cDNA 2 μL, Taq酶0.5 μL. PCR条件: 预变性94℃, 5 min; 94℃, 45 s; 53℃, 45 s; 72℃, 1 min; 36个循环; 延伸72℃, 10 min . 反应结束后取5 μL产物用15 g/L琼脂糖凝胶(内含嗅化乙啶)电泳, 紫外灯下观察并用凝胶成像系统成像.
1.2.3 Western blot检测STAT3蛋白表达: 细胞经胰酶消化后, 用预冷至4℃的裂解缓冲液加入到经PBS漂洗第3天收集的培养细胞中, 冰上作用20 min, 12 000 g离心2 min后, 上清液保存于-20℃. 采用Bradford法测定蛋白质浓度, 以50 μg/孔上样, 3.47 mmol/L SDS PAGE凝胶电泳分离, 通过电转移法将蛋白质从SDS PAGE凝胶转移至硝酸纤维素膜. 后者在含5%脱脂奶粉的TTBS中37℃封闭90 min, 加入一抗4℃孵育过夜, TTBS充分漂洗(10 min×3次), 加入二抗37℃作用40 min, TTBS充分漂洗(10 min×3次), 化学荧光法(ECL)显色, 观察结果.
1.2.4 MTT观察细胞增殖情况: 将对数生长期的3组细胞用2.5 g/L胰酶消化后, 用含100 mL/L小牛血清的RPMI l640培养基配成5×106个/L的细胞悬液, 接种在96孔培养板中, 每孔接种200 μL, 每组设3个复孔, 在于37℃、50 mL/L CO2、饱和湿度条件下培养24 h, 每孔加入MTT溶液(5 g/L) 20 μL, 37℃培养4 h, 弃去培养基, 每孔加入100 μL DMSO, 振荡15 min, 以酶标仪检测490 nm波长下A值, 增殖能力以平均A值分析. 以A组细胞为对照, 计算各组细胞生长的抑制率, 细胞生长的抑制率(IR) = (1-试验孔A值/对照孔A值)×100%.
1.2.5 流式细胞仪检测细胞凋亡与周期分布: 对数生长期的细胞用胰酶消化成单细胞悬液, 冰PBS洗涤2次, 1000 r/min离心5 min. 弃上清, 缓慢加入-20℃预冷的95%乙醇, 4℃过夜. 取细胞悬液, PBS洗涤, 2000 r/min离心5 min后, 弃上清. P I染液1.0 mL染30 min, 488 nm激发波长测定样品, 620 nm带通滤片检测PI荧光. 细胞周期分析软件MultiCycle分析得到DNA指数(DNA index, DI)细胞周期数值, 并以下列公式计算细胞增殖指数 (proliferation index, PI): PI = (S%+G2%)/ (G1%+S%+G2%)×100.
1.2.6 裸鼠移植瘤体内观察细胞生长: 取对数生长期消化细胞并计数, 悬浮于PBS中配成1010/L. 18只♀裸鼠随机分成3组, 每组6只, 分别接种A、B、C 3组细胞, 于右胁皮下分别注射200 μL PBS细胞悬液. 观察注射部位肿瘤结节开始形成的时间, 在第4周末处死裸鼠, 分离皮下形成的肿瘤测量, 用游标卡尺测量肿瘤长径(a), 短径(b), 并计算其体积(V = a×b2/2), 计算体积.
统计学处理 将所有原始数据整理后, 应用SPSS12.0统计软件进行数据分析. 所有计量资料均以mean±SD表示, 原始资料应用t检验和方差分析.
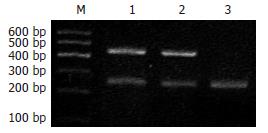
扩增片段大小与所设计的大小一致, STAT3和β-actin设计扩增片段分别为409 bp和248 bp. psiRNA-H1/STAT3转染的MKN-45中STAT3 mRNA的表达较对照组和空载体转染的细胞中mRNA表达量显著下降. STAT3扩增产物的强度与内参照β-actin的比值在对照组、psiRNA-H1转染组和psiRNA-H1/STAT3转染组分别为(1.937±0.043)、(1.905±0.061)和(0.612±0.074), psiRNA-H1转染组和对照组相比差异没有显著性, 重组质粒转染与对照组和psiRNA-H1转染组相比差异具有显著性(P<0.05, 图1).
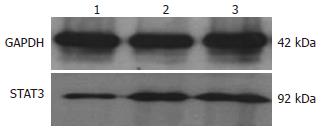
各组细胞经Western blot检测分析表明, 内参照GAPDH为均一显影的条带, 但STAT3显影条带密度不同. 其中, 对照组和psiRNA-H1转染组细胞STAT3表达量较高, 而重组质粒转染组细胞STAT3表达量显著下降(图2). 吸光度值分析结果分别为(2.005±0.064)、(1.984±0.072)、(0.668±0.054), psiRNA-H1转染组和对照组相比差异没有显著性, 重组质粒转染与对照组和psiRNA-H1转染组相比差异具有显著性(P<0.05).
脂质体介导的表达STAT3短发夹状RNA重组质粒(psiRNA-H1/STAT3)对MKN-45细胞有明显生长抑制作用, 而psiRNA-H1转染组对细胞生长无明显抑制作用(组间比较P<0.05, 表1).
psiRNA-H1/STAT3转染组G0/G1期细胞比例增高, 同时S期和G2/M期细胞比例降低, 细胞的增殖指数明显降低. psiRNA-H1转染组的MKN-45细胞增殖指数无明显改变(表2).
| 分组 | 各细胞周期比值 | 增殖指数 | ||
| G0/G1 | S | G2/M | ||
| 对照组 | 65.21±2.41 | 18.40±2.31 | 14.52±2.64 | 33.54±2.91 |
| psiRNA-H1转染组 | 67.42±4.34 | 17.72±3.42 | 14.80±3.05 | 32.54±4.31 |
| psiRNA-H1/STAT3转染组 | 73.52±3.53a | 10.43±4.21a | 14.63±5.32 | 25.42±3.48a |
对照组和psiRNA-H1转染组7 d左右可触及肿瘤, psiRNA-H1/STAT3转染组10 d左右触及肿瘤. 每周观察3组裸鼠移植瘤的体积, 4 wk后, 处死裸鼠, 对照组、psiRNA-H1转染组和psiRNA-H1/STAT3转染组3组裸鼠移植瘤的体积分别为13.65±5.64 cm3、12.54±5.12 cm3和4.47±0.18 cm3, 对照组和psiRNA-H1转染组之间无差异, psiRNA-H1/STAT3转染组分别与对照组和psiRNA-H1转染组有显著性差异(P<0.05).
近年, 治疗肿瘤的一种新途径-分子靶向治疗正在迅速发展. 他利用肿瘤细胞过度表达的某些特异性分子结构作为靶点, 针对性的选择抗体、抑制剂等阻断剂, 有效地干预该靶点分子及其调控的信号传导通路, 从而达到抑制肿瘤发生、发展和转移的效果[4]. 因此寻找新的靶点已经成为肿瘤靶向治疗研究热点. STAT3是在研究IFN信号转导机制的过程中发现一种转录因子, 可以在外界信号的刺激下激活并直接转入细胞核内引发相应靶基因的转录, 是一种信号转导子和转录激活子[1]. 近年来研究发现, STAT3是EGF、IL26/JAK、Src等多个酪氨酸激酶信号通道汇聚的焦点[5-6], 其具有强烈的抑制细胞凋亡、促进细胞增殖的作用, 参与了人类恶性肿瘤的发生、发展和演进, 在多种肿瘤中都有过度激活[7-13]. 在正常鼠成纤维细胞及人口腔角化细胞、乳腺细胞中阻断STAT3信号通道并不影响细胞生长[14]. 因此, 阻断STAT3途径也许不会过多损伤正常细胞的功能. 我们先前的研究发现, STAT3在胃癌中呈高表达, 这为本研究提供了理论基础.
Yu et al报道, 通过短发夹RNA(short hairpin RNA, shRNA)来使目的基因失活是RNA干扰的有效途径[15], siRNA表达载体用3种RNA聚合酶Ⅲ启动子(pol Ⅲ)操纵一段小的发夹RNA在哺乳动物细胞中的表达是有效的降低基因表达一个更为经济的方法. 本研究中我们按照Fan et al报道[16]和Invivogen公司在线设计软件设计针对STAT3基因的特异性小RNA干扰基因序列, 利用本实验室保存的Invivogen公司RNA干扰载体(psiRNA-hHneo), 通过退火、酶切、连接、筛选和测序等步骤构建STAT3基因特异性小RNA干扰质粒(psiRNA-STAT3). 应用针对STAT3基因的特异性小RNA干扰质粒(psiRNA-H1/STAT3)转染MKN-45细胞, 实验分为对照组、psiRNA-H1转染组和psiRNA-H1/STAT3转染组3组. 通过RT-PCR和Western blot检测STAT3特异性小RNA干扰基因对胃癌细胞STAT3基因mRNA和蛋白表达的影响; 检测MTT观察细胞增值情况, 检测流式细胞仪观察胃癌MKN-45细胞凋亡情况. 同时观察了STAT3特异性小RNA干扰质粒对胃癌MKN-45细胞裸鼠移植瘤生长的影响.
我们成功构建了针对STAT3基因的特异性小RNA干扰质粒(psiRNA-H1/STAT3). psiRNA-H1/STAT3转染组STAT3的表达在mRNA水平和蛋白水平均显著降低; 胃癌细胞生长明显减慢, G0-G1期细胞比例显著增加, G2-M期细胞比例减少, 细胞的增殖指数明显降低. 同时在体内, 裸鼠皮下移植瘤试验发现生长速度和体积明显下降. 这说明在体内外, 针对STAT3基因的特异性小RNA干扰质粒能明显沉默STAT3基因, STAT3表达下调后, 胃癌细胞在体内和体外的生长都受到明显抑制. 我们的研究为STAT3基因靶向治疗提供一定的实验依据, STAT3有望成为胃癌治疗中一个新的治疗靶位, 靶向STAT3基因治疗显示出潜在的疗效和良好的发展前景.
早期胃癌可通过手术或手术联合放疗治疗, 而对于晚期胃癌, 传统的治疗方法对患者并不十分有效. 近年来, 治疗肿瘤的一种新途径-分子靶向治疗正迅速发展, 其利用肿瘤细胞过度表达的某些特异性分子结构作为靶点, 针对性的选择抗体、抑制剂等阻断剂, 有效地干预该靶点分子及其调控的信号传导通路, 从而达到抑制肿瘤发生、发展和转移的效果.
樊晓明, 主任医师, 复旦大学附属金山医院消化科
最近的文献报道, 通过短发夹RNA(shRNA)来使目的基因失活是RNA干扰的有效途径.
本文利用STAT3基因的特异性小RNA干扰质粒转染胃癌细胞系, 观察了成功转染后细胞增殖系数、细胞周期分布和转染后细胞在裸鼠的生长.
针对STAT3基因的特异性小RNA干扰质粒在体外能有效抑制人胃癌细胞系STAT3 mRNA和蛋白表达, 细胞增殖能力减弱, 在体内明显抑制肿瘤生长, 为STAT3基因靶向治疗提供一定的实验依据.
本文立题新颖, 论据充分可靠, 为STAT3基因靶向治疗提供了一定的实验依据.
编辑: 李军亮 电编:郭海丽
| 1. | Bowman T, Garcia R, Turkson J, Jove R. STATs in oncogenesis. Oncogene. 2000;19:2474-2488. [PubMed] [DOI] |
| 2. | Buettner R, Mora LB, Jove R. Activated STAT signaling in human tumors provides novel molecular targets for therapeutic intervention. Clin Cancer Res. 2002;8:945-954. [PubMed] |
| 3. | Clevenger CV. Roles and regulation of stat family transcription factors in human breast cancer. Am J Pathol. 2004;165:1449-1460. [PubMed] |
| 4. | Turkson J, Jove R. STAT proteins: novel molecular targets for cancer drug discovery. Oncogene. 2000;19:6613-6626. [PubMed] [DOI] |
| 5. | Niu G, Wright KL, Huang M, Song L, Haura E, Turkson J, Zhang S, Wang T, Sinibaldi D, Coppola D. Constitutive Stat3 activity up-regulates VEGF expression and tumor angiogenesis. Oncogene. 2002;21:2000-2008. [PubMed] [DOI] |
| 6. | Garcia R, Bowman TL, Niu G, Yu H, Minton S, Muro-Cacho CA, Cox CE, Falcone R, Fairclough R, Parsons S. Constitutive activation of Stat3 by the Src and JAK tyrosine kinases participates in growth regulation of human breast carcinoma cells. Oncogene. 2001;20:2499-2513. [PubMed] [DOI] |
| 7. | Niu G, Bowman T, Huang M, Shivers S, Reintgen D, Daud A, Chang A, Kraker A, Jove R, Yu H. Roles of activated Src and Stat3 signaling in melanoma tumor cell growth. Oncogene. 2002;21:7001-7010. [PubMed] [DOI] |
| 8. | Xiong H, Zhang ZG, Tian XQ, Sun DF, Liang QC, Zhang YJ, Lu R, Chen YX, Fang JY. Inhibition of JAK1, 2/STAT3 signaling induces apoptosis, cell cycle arrest, and reduces tumor cell invasion in colorectal cancer cells. Neoplasia. 2008;10:287-297. [PubMed] |
| 9. | Klampfer L. The role of signal transducers and activators of transcription in colon cancer. Front Biosci. 2008;13:2888-2899. [PubMed] [DOI] |
| 10. | Chen Z, Han ZC. STAT3: a critical transcription activator in angiogenesis. Med Res Rev. 2008;28:185-200. [PubMed] [DOI] |
| 11. | Barboza JA, Wang S, Schaefer TS. Generation and characterization of a constitutively active Stat3 protein. Mol Biol Rep. 2004;31:13-21. [PubMed] [DOI] |
| 12. | Shi CS, Kehrl JH. Pyk2 amplifies epidermal growth factor and c-Src-induced Stat3 activation. J Biol Chem. 2004;279:17224-17231. [PubMed] [DOI] |
| 13. | Snyder M, Huang XY, Zhang JJ. Identification of novel direct Stat3 target genes for control of growth and differentiation. J Biol Chem. 2008;283:3791-3798. [PubMed] [DOI] |
| 14. | Niu G, Shain KH, Huang M, Ravi R, Bedi A, Dalton WS, Jove R, Yu H. Overexpression of a dominant-negative signal transducer and activator of transcription 3 variant in tumor cells leads to production of soluble factors that induce apoptosis and cell cycle arrest. Cancer Res. 2001;61:3276-3280. [PubMed] |
| 15. | Yu JY, DeRuiter SL, Turner DL. RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc Natl Acad Sci U S A. 2002;99:6047-6052. [PubMed] [DOI] |
| 16. | Fan Y, Zhang YL, Wu Y, Zhang W, Wang YH, Cheng ZM, Li H. Inhibition of signal transducer and activator of transcription 3 expression by RNA interference suppresses invasion through inducing anoikis in human colon cancer cells. World J Gastroenterol. 2008;14:428-434. [PubMed] [DOI] |