修回日期: 2008-03-27
接受日期: 2008-05-10
在线出版日期: 2008-05-18
目的: 进一步了解端粒酶的生物学功能及其在永生化或肿瘤细胞中作用的分子机制, 筛选新的端粒相关蛋白分子.
方法: 基于酵母双杂交技术原理, 采用DNA重组技术构建诱饵融合蛋白表达载体, 筛选cDNA文库, β-半乳糖苷酶滤膜影印分析确证阳性克隆, 对阳性克隆质粒测序并在GenBank进行cDNA序列同源性比较.
结果: AH109、Y187酵母菌基因表型稳定, 无His渗漏表达. 成功构建端粒酶催化亚单位诱饵融合蛋白表达载体pGBKT7-hTERT, 其表达的融合蛋白对AH109酵母细胞生长无毒性且不具有激活自身报告基因(LacZ)的作用. 从cDNA文库中筛选到Ade+、Leu+、Trp+和His+阳性克隆28个, β-半乳糖苷酶菌落影印滤膜分析筛选到Ade+、His+和LacZ+阳性克隆12个, 其中有5个文库质粒具有自身激活报告基因的作用, 予以弃除. 7个阳性克隆质粒测序发现有2个为重复序列, cDNA序列同源性比较最终获得6个已收录人cDNA序列, 他们分别为T-STAR、PAWR、I-1、SMARCB1、LOXL3和HKR3.
结论: 获取新的端粒相关蛋白可了解端粒酶全酶的结构及其在肿瘤、细胞永生化的生物学功能及分子机制, 为肿瘤、衰老的发生及防治奠定重要的理论基础.
引文著录: 周平, 房殿春, 陈兵, 毛高平, 刘为纹, 曹传平, 步晓华, 张启杰. 一组端粒相关蛋白分子的克隆. 世界华人消化杂志 2008; 16(14): 1507-1512
Revised: March 27, 2008
Accepted: May 10, 2008
Published online: May 18, 2008
AIM: To elucidate the biological function and molecular mechanism of telomerase in immortal and/or tumor cells.
METHODS: Based on the principle of the yeast two-hybrid technology, the recombinant of human telomerase catalytic subunit bait fusion gene was constructed by DNA recombination technique, which was employed to screen cDNA libraries. The positive clones were confirmed by β-galactosidase colony-lift filter assay and furthermore the obtained plasmids cDNA sequences were compared with the isogenous sequences in GenBank.
RESULTS: The gene phenotypes of AH109 and Y187 yeast strains were stable and there was no leak expression of His. The recombinant of human telomerase catalytic subunit bait fusion gene, which was named as pGBKT7-hTERT, was constructed, and its bait fusion protein had no toxic effects on AH109 yeast cells and no activation effect on the autonomous reporter gene LacZ. Twenty-eight Ade+, Leu+, Trp+, and His+ clones were screened from the cDNA libraries and 12 Ade+, His+ and LacZ+ clones were obtained by the print analysis of β-galactosidase colony-lift filter assay. Of the 12 positive clones, 5 library plasmids possessed the effect of autonomously activating the reporter gene, so they were removed. There were 7 true positive clones among the library plasmids, 2 of which were found repeated after sequencing. The six obtained plasmids cDNA sequences were compared with the isogenous sequences in GenBank by Blast software via Internet. Finally, 6 recorded cDNA sequences were obtained, including T-STAR, PAWR, I-1, SMARCB1, LOXL3 and HKR3.
CONCLUSION: The 6 obtained telomere-associated proteins may help us understand the structure of telomerase holoenzyme and the biological function and molecular mechanism of telomerase in tumor and/or immortal cells, providing a theoretical basis for the tumor genesis, aging and prevention.
- Citation: Zhou P, Fang DC, Chen B, Mao GP, Liu WW, Cao CP, Bu XH, Zhang QJ. Cloning of a group of telomere-associated proteins. Shijie Huaren Xiaohua Zazhi 2008; 16(14): 1507-1512
- URL: https://www.wjgnet.com/1009-3079/full/v16/i14/1507.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i14.1507
胃端粒是真核生物细胞染色体末端一种由许多简单重复序列及其相关蛋白组成的结构, 具有防止染色体末端丢失、核酸外切酶降解和染色体之间端端融合等重要功能, 以维持染色体结构的稳定[1-4]. 端粒酶是延长端粒、维持端粒稳定、促使细胞不断增殖、永生化的主要机制[5-11]. 尽管人们已发现多种端粒相关蛋白共同参与了对端粒、端粒酶的调控[12-19], 但至今人们对端粒酶全酶结构、组装及解聚以及端粒相关蛋白间的联系、怎样协同参与端粒、端粒酶的调控目前仍然不清楚. 因此, 获取新的端粒相关蛋白可以进一步了解端粒酶的生物学功能及其在永生化或肿瘤细胞中作用的分子机制, 为肿瘤、衰老的发生及防治奠定重要的理论基础. 为此我们采用酵母双杂交技术进行端粒相关蛋白分子的筛选工作.
AH109、Y187酵母报告宿主菌株, 酵母双杂交系统-3质粒: pGBKT7、pGBKT7-53、pGBKT7-Lam、pGADT7、pGADT7-T及pCL-1, 预转化Y187人睾丸cDNA文库, YPD、SD合成省却培养基、特异成分缺省混合氨基酸: -Leu、-Trp、-His、-Leu/-Trp、-Leu/-His/-Trp、-Ade/-Leu/-His/-Trp(Clontech公司); 大肠杆菌E.coli. DH5α由中国人民解放军第三军医大学分子遗传教研室保存; hTERT cDNA质粒pGRN145由美国Geron公司惠赠; T4 DNA连接酶、质粒提取试剂盒(Roche公司); 限制性核酸内切酶EcoRⅠ、NotⅠ、Hind Ⅲ(New England公司), 3-AT(Sigma公司), l/HindⅢ Marker(华美公司). 90、150 mm培养平皿.
1.2.1 酵母菌株表型鉴定: 将AH109、Y187酵母单菌落划线于准备好的单个SD/-Leu、SD/-Trp及含0、2.5、5、7.5、10、12.5、15 mmol/L 3-AT浓度的SD/-His平板, 30℃倒置培养3-4 d.
1.2.2 质粒的转化与扩增(氯化钙法): 将pGBKT7, pGBKT7-53, pGBKT7-Lam, pGADT7, pGADT7-T, Pcl-1等质粒转化入E.coli DH5α中. pGBKT7、pGBKT7-53、pGBKT7-Lam质粒转化菌株铺LB平板(Kana), pGADT7、Pcl-1、pGADT7-T质粒转化菌株铺LB平板(Amp). hTERT cDNA质粒pGRN145转化菌涂于LB平板(氯霉素), 质粒提取试剂盒纯化质粒.
1.2.3 端粒酶催化亚单位诱饵融合蛋白载体重组体的构建:EcoRⅠ、NotⅠ双酶切质粒pGRN145、pGBKT7, 电洗脱法回收目的片段. 载体: 插入片段摩尔比为1:3. 将pGBKT7-hTERT连接产物转化入E.coli DH5α, 涂于LB琼脂(Kana)平板. 质粒提取试剂盒纯化质粒. EcoRⅠ、NotⅠ双酶切及Hind Ⅲ单酶切鉴定pGBKT7-hTERT重组体. 将pGBKT7-hTERT及pGBKT7、pGBKT7-53、pGBKT7-Lam等质粒转化入酵母细胞株AH109, pGADT7、pGADT7-T、Pcl1等质粒转化入酵母细胞Y187(乙酸锂法). 同时将空菌AH109接种于YPD琼脂平板上, 对比平板上酵母菌生长情况. 采用β-半乳糖苷酶菌落影印滤膜分析检测pGBKT7-hTERT是否具有自身激活报告基因(LacZ)的作用. 酵母交配实验进一步验证端粒酶催化亚单位诱饵融合蛋白表达载体pGBKT7-hTERT是否具有自身激活报告基因(LacZ)的作用, 按表1进行交配. 将pGBKT7-hTERT转化菌株AH109与人睾丸cDNA文库Y187转化菌株混合过夜培养(酵母交配法), 以每200 μL涂于150 mm SD/-Leu/-Trp/-His平板, 30℃倒置培养6-7 d, 将直径>1 mm的克隆接种于SD/-Ade/-Leu/-Trp/-His平板, 30℃倒置培养8-10 d. β-半乳糖苷酶菌落影印滤膜分析筛选Ade+、His+、LacZ+阳性克隆.
| 实验 | 质粒1 | 质粒2 | SD选择培养基 |
| 编号 | |||
| 1 | pGBKT7 | pGADT7 | =-Leu/-Trp |
| 2 | pGBKT7 | pGADT7-T | =-Leu/-Trp |
| 3 | pGBKT7-hTERT | pGADT7 | =-Leu/-Trp |
| 4 | pGBKT7-hTERT | pGADT7-T | =-Leu/-Trp |
| 5 | pGBKT7-Lam | pGADT7 | =-Leu/-Trp |
| 6 | pGBKT7-Lam | pGADT7-T | =-Leu/-Trp |
| 7 | pGBKT7-53 | pGADT7 | =-Leu/-Trp |
| 8 | pGBKT7-53 | pGADT7-T | =-Leu/-Trp |
| 9 | Pcl-1 | =-Leu |
1.2.4 阳性酵母细胞克隆的进一步确证: 将Ade+、His+、LacZ+阳性克隆涂于SD/-His/-Leu/-Trp平板培养6-7 d, 反复3次. 再转至SD/-Ade/-His/-Leu/-Trp平板培养8-10 d. 每次均挑LacZ+阳性克隆进入下一轮培养. 提取Ade+、His+、LacZ+阳性酵母细胞克隆质粒后转化入E.coli DH5α, 转化菌涂于LB平板(Amp+), 提取纯化质粒. 乙酸锂法将pGBKT7-hTERT、pGBKT7、pGBKT7-Lam质粒转化入酵母细胞Y187, 涂于筛选平板SD/-Trp. 将阳性文库质粒、pGADT7转化入酵母细胞AH109, 涂于筛选平板SD/-Leu. 酵母交配实验验证文库质粒与hTERT作用的特异性. 真阳性克隆质粒cDNA测序并将序列输入计算机, 应用标准核酸BLAST软件与GenBank库中所有核酸序列进行同源性比较.
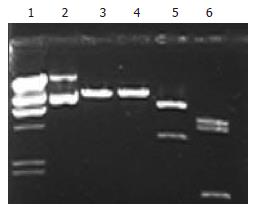
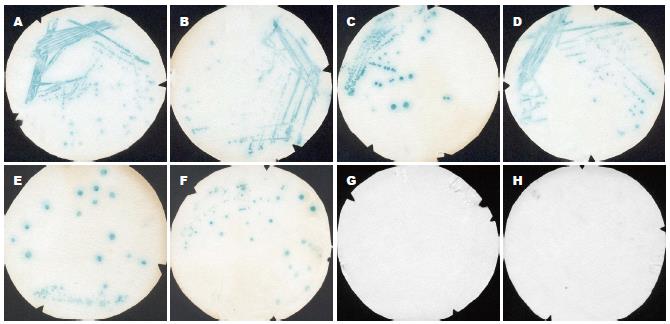
AH109、Y187酵母菌落在YPD平板上生长良好, 直径可达2 mm, 但不能在SD/-Trp、SD/-Leu平板上生长. 同时, 无论有无3-AT的存在, AH109、Y187酵母菌株也不能在SD/-His平板中生长. pGBKT7, pGBKT7-53, pGBKT7-Lam, pGADT7, pGADT7-T , Pcl-1等质粒转化入E.coli DH5α均经HindⅢ、EcoRⅠ酶切鉴定证实. 质粒pGRN145含有hTERT cDNA全长编码基因3.4 kb, 经EcoRⅠ酶切鉴定证实. pGRN145、载体pGBKT7质粒经EcoRⅠ、NotⅠ双酶切, 电洗脱法回收目的片段3.4 kb、载体片段7.3 kb. 通过T4 DNA连接酶将hTERT cDNA定向克隆入pGBKT7. 提取质粒后经EcoRⅠ、NotⅠ双酶切及Hind Ⅲ单酶切证实hTERT cDNA与载体pGBKT7连接(图1). pGBKT7-hTERT重组体及pGBKT7、pGBKT7-53、pGBKT7-Lam, pGADT7、pGADT7-T、Pcl1等质粒经乙酸锂法成功转化入酵母细胞, 并经提取酵母质粒转化入E.coli DH5α, 提取质粒再经酶切鉴定证实. pGBKT7-hTERT转化菌株经过2-4 d培养, 直径1-2 mm. 说明pGBKT7-hTERT重组体表达的融合蛋白对AH109酵母细胞生长无毒性. β-半乳糖苷酶菌落影印滤膜分析检测显示, pGBKT7-hTERT、 pGBKT7、pGBKT7-Lam转化菌连续观察8 h, 未见有呈色现象. 而Pcl1转化菌在反应40 min时出现蓝色, 并随时间延长颜色逐渐加深(图2). 说明pGBKT7- hTERT无激活自身报告基因(LacZ)的表达. 酵母交配实验进一步验证了pGBKT7- hTERT不具有激活自身报告基因(LacZ)表达的作用. cDNA文库筛选到Ade+、Leu+、Trp+、His+阳性克隆28个, β-半乳糖苷酶菌落影印滤膜分析显示, 1 h始现蓝色的阳性克隆有7个, 3 h始现蓝色的阳性克隆有5个, 其余克隆在连续观察8 h后仍无明显色泽改变, 共筛选到Ade+、His+、LacZ+阳性克隆12个(图3). 质粒互换酵母细胞后交配实验, β-半乳糖苷酶菌落影印滤膜分析显示pGBKT7-hTERT转入Y187细胞也无激活报告基因的活性(图4); 有5个文库质粒具有自身激活活性, 予以弃除. cDNA序列同源性比较: 7个阳性克隆质粒测序中有2个为重复序列, 同源序列比较获得6个已收录人cDNA序列, 他们分别是: T-STAR、PAWR、 I-1、SMARCB1、LOXL3和HKR3.
目前有关端粒酶发挥作用时的三级/四级结构及端粒酶与端粒相互作用的动力学变化并不清楚, 有关端粒酶全酶在细胞核如何装配, 在DNA复制期装配与拆装的动态变化等问题均有待于进一步深入研究, 初步估测哺乳生物端粒酶全酶分子质量大于1000 kDa[19], 在生理或病理情况下可能还有其他蛋白参与端粒酶结构和功能的调控[12,18]. 研究表明hTERT仅在端粒酶阳性的肿瘤组织和永生化细胞系中表达, 在端粒酶阴性的正常组织中不表达, 与端粒酶活性水平保持一致[21-27], 对端粒酶活性发挥十分重要的调控作用. hTERT与hTR可以构成端粒酶的基本核心, 以端粒酶RNA为模板复制、延长端粒. 因此hTERT是筛选cDNA文库以获取端粒相关蛋白编码基因的良好靶蛋白. 而且酵母双杂交技术的成熟运用, 也为我们能够获得端粒相关蛋白分子提供了重要研究手段. 酵母双杂交技术又称"相互作用陷阱"(interaction trap)是近10余年来建立的研究蛋白质间相互作用的分子生物学方法, 在对酵母转录因子GAL4的认识基础上, 由Stanley Fields和Ok-kyu Song于1989年提出并初步建立的, 这种研究蛋白质间相互作用的实验方法已得到广泛的应用. 他不仅可鉴定已知蛋白质间是否具有相互作用, 而且还有助于发现许多与已知蛋白质发生作用的未知蛋白质编码基因. GAL4转录调控蛋白通常为结构上可以分开、功能上相互独立的两个结构域组成: DNA结合区(DNA-binding domain, DNA-BD)和转录活化结构域(active domain, AD). DNA-BD和AD单独分别作用不能激活转录反应, 当两者发生相互作用时, 则呈现完整的GAL4转录因子活性, 使启动子下游基因得到转录. 构建两种不同的克隆载体用于制备这两种GAL4结构域与有相互作用可能性的两种蛋白的融合基因, 重组的杂合蛋白在酵母中一起表达, 并被引导到酵母胞核. 如果两种杂合蛋白的非GAL4部分相互作用, 则使DNA-BD和DNA-AD栓在一起, 双杂合蛋白的相互作用使GAL4的转录活化功能再现, 激活报告基因(lacZ和His3)的表达, 通过检测酵母菌株的表型而验证蛋白质间相互作用的存在.
His是筛选阳性酵母克隆的报告基因之一, 其条件表达构成一非常有效的生长选择手段, 加速从大量酵母转化株中筛选表达两种相互作用蛋白质转化株的过程. 但是部分酵母菌存在His渗漏表达现象, 即在SD/-His平板上可以生长. 3-AT是酵母His 3蛋白(His 3p)的竞争性抑制剂, 可抑制某些报告株中低水平的His渗漏表达. 我们将AH109、Y187酵母菌分别涂于0、2.5、5、7.5、10、12.5、15 mmol/L等不同3-AT浓度的SD/-His琼脂平板上, 结果发现, 无论有无3-AT的存在, AH109、Y187酵母菌株均不能在SD/-His平板上生长, 表明AH109、Y187酵母菌无His渗漏表达现象, 无须在筛选平板中加入3-AT, His可以作为一非常有效的筛选报告基因. 而且AH109、Y187酵母菌也不能在SD/-Leu、SD/-Trp平板上生长, 只能在全培养基YPD平板上生长. 显示AH109、Y187酵母菌株的基因表型适宜于后续筛选cDNA文库的需要.
为此, 我们首先成功构建了hTERT诱饵融合蛋白表达载体pGBKT7-hTERT, 为获取与hTERT相互作用的端粒相关蛋白分子奠定了良好的实验基础. 由于某些蛋白质在酵母菌株内表达时可能对酵母产生一定的毒性作用, 如使酵母体内的信号传导通路阻断, 干扰酵母中正常基因的表达调控, 抑制酵母细胞的分裂, 使酵母细胞不能在选择性培养基上生长, 即使培养时间延长酵母菌落直径也不超过1 mm, 由此使得对某些种类的蛋白质不能在该系统中进行分析. hTERT诱饵融合蛋白表达载体转化菌株经过2-4 d的培养, 直径达1-2 mm, 并随培养时间延长菌落逐渐增大. 表明hTERT诱饵融合蛋白对宿主菌无毒性作用. 另外, 本身就有转录激活活性的蛋白质会直接激活报告基因的表达, 也不能作为诱饵蛋白. 我们利用灵敏的β-半乳糖苷酶菌落滤膜影印分析证实hTERT诱饵融合蛋白无自身激活活性, pGBKT7-hTERT符合筛选cDNA文库的要求.
pGBKT7-hTERT转化菌株AH109与cDNA文库转化菌株Y187杂合成为二倍体细胞后, 通过二级报告基因His表达而在SD/-His/-Leu/-Trp缺陷培养基上生长, 将His+Leu+Trp+阳性克隆菌株转至高选择条件SD/-Ade/-His/-Leu/-Trp平板上, 通过二级报告基因Ade表达去除部分假阳性. 最后通过β-半乳糖苷酶菌落影印滤膜分析对Ade+His+Leu+Trp+阳性克隆检测二级报告基因LacZ表达进一步弃除部分假阳性. 经测序及同源性分析最终确定了6个与pGBKT7-hTERT发生作用的阳性克隆. 他们分别是: S-STAR、PAWR、I-1、SMARCB1、LOXL3和HKR3. 至今人们尚未认识到这些基因与端粒酶有什么联系.
这一组可能是端粒相关蛋白的编码基因的功能是什么呢? 初步研究显示: HKR3[28]、SMARCB1[29-30]、PAWR[31]与肿瘤的发生有关. T-STAR参与了细胞永生化转变的过程, 可能与细胞跨越增殖危机有密切联系[32]. LOXL3可能与肝纤维化形成有一定的联系. 咪唑1受体与血压增高有关[33], 但高血压与端粒酶之间的作用机制并不清楚. 深入研究这6个可能是端粒相关蛋白生物学功能及其与hTERT的调控机制无疑将会进一步了解端粒酶全酶结构及其在肿瘤、细胞永生化、肝纤维化、心血管等疾病中的生物学功能及分子机制, 可为肿瘤、衰老的发生及防治奠定重要的理论基础.
端粒酶与多种肿瘤关系十分密切, 如胃癌、肝癌、食管癌、结肠癌、肺癌和胰腺癌等, 尽管已清楚端粒相关蛋白如hTERT参与对端粒酶活性的调控, 但目前对端粒酶全酶结构仍不清楚. 深入研究端粒酶全酶结构, 进一步了解肿瘤发生的病理机制, 可能成为肿瘤检测指标、治疗的新靶位.
张志坚, 教授, 福州总医院消化内科; 周晓东, 研究员, 中山大学附属二院医学研究中心
本研究成功的从cDNA文库中筛选到新的端粒相关蛋白, 这些端粒相关蛋白可能参与对端粒酶活性的调控, 但其对端粒酶活性调控作用的分子机制亟待研究.
本研究采用酵母双杂交技术成功筛选到新的端粒相关蛋白.
本研究提出了新的端粒相关蛋白, 对今后端粒酶与肿瘤、肝纤维化、高血压等疾病的关系及作用机制有重要的启迪.
1 端粒: 是真核生物细胞染色体末端一种由许多简单重复序列及其相关蛋白质组成的结构.
2 端粒酶: 端粒酶是一种核糖核蛋白酶, 由RNA和端粒相关蛋白组成的复合体, 具有逆转录酶活性.
本研究创新性强, 设计科学, 结果真实, 结论客观, 思路清晰, 讨论突出, 具有很好的学术价值.
编辑: 李军亮 电编:郭海丽
| 1. | Bailey SM, Murnane JP. Telomeres, chromosome instability and cancer. Nucleic Acids Res. 2006;34:2408-2417. [PubMed] [DOI] |
| 2. | Hsu CP, Ko JL, Shai SE, Lee LW. Modulation of telomere shelterin by TRF1 [corrected] and TRF2 interacts with telomerase to maintain the telomere length in non-small cell lung cancer. Lung Cancer. 2007;58:310-316. [PubMed] [DOI] |
| 3. | Siderakis M, Tarsounas M. Telomere regulation and function during meiosis. Chromosome Res. 2007;15:667-679. [PubMed] [DOI] |
| 4. | Moon IK, Jarstfer MB. The human telomere and its relationship to human disease, therapy, and tissue engineering. Front Biosci. 2007;12:4595-4620. [PubMed] [DOI] |
| 5. | Gandellini P, Folini M, Bandiera R, De Cesare M, Binda M, Veronese S, Daidone MG, Zunino F, Zaffaroni N. Down-regulation of human telomerase reverse transcriptase through specific activation of RNAi pathway quickly results in cancer cell growth impairment. Biochem Pharmacol. 2007;73:1703-1714. [PubMed] [DOI] |
| 6. | Finkel T, Serrano M, Blasco MA. The common biology of cancer and ageing. Nature. 2007;448:767-774. [PubMed] [DOI] |
| 7. | Chen SM, Tao ZZ, Hua QQ, Xiao BK, Xu Y, Wang Y, Deng YQ. Inhibition of telomerase activity in cancer cells using short hairpin RNA expression vectors. Cancer Invest. 2007;25:691-698. [PubMed] [DOI] |
| 8. | Karunagaran D, Joseph J, Kumar TR. Cell growth regulation. Adv Exp Med Biol. 2007;595:245-268. [PubMed] |
| 9. | Phatak P, Burger AM. Telomerase and its potential for therapeutic intervention. Br J Pharmacol. 2007;152:1003-1011. [PubMed] [DOI] |
| 10. | Tabori U, Dome JS. Telomere biology of pediatric cancer. Cancer Invest. 2007;25:197-208. [PubMed] [DOI] |
| 11. | Zendehrokh N, Franzen L, Dejmek A. Weak telomerase activity in malignant cells in metastatic serous effusions: correlation to short survival time. Acta Cytol. 2007;51:412-416. [PubMed] |
| 12. | Munoz P, Blanco R, Blasco MA. Role of the TRF2 telomeric protein in cancer and ageing. Cell Cycle. 2006;5:718-721. [PubMed] |
| 13. | Hashimoto Y, Murakami Y, Uemura K, Hayashidani Y, Sudo T, Ohge H, Fukuda E, Sueda T, Hiyama E. Detection of human telomerase reverse transcriptase (hTERT) expression in tissue and pancreatic juice from pancreatic cancer. Surgery. 2008;143:113-125. [PubMed] [DOI] |
| 14. | Khaw AK, Silasudjana M, Banerjee B, Suzuki M, Baskar R, Hande MP. Inhibition of telomerase activity and human telomerase reverse transcriptase gene expression by histone deacetylase inhibitor in human brain cancer cells. Mutat Res. 2007;625:134-144. [PubMed] [DOI] |
| 15. | Deng WG, Jayachandran G, Wu G, Xu K, Roth JA, Ji L. Tumor-specific activation of human telomerase reverses transcriptase promoter activity by activating enhancer-binding protein-2beta in human lung cancer cells. J Biol Chem. 2007;282:26460-26470. [PubMed] [DOI] |
| 16. | Choi JH, Park SH, Park J, Park BG, Cha SJ, Kong KH, Lee KH, Park AJ. Site-specific methylation of CpG nucleotides in the hTERT promoter region can control the expression of hTERT during malignant progression of colorectal carcinoma. Biochem Biophys Res Commun. 2007;361:615-620. [PubMed] [DOI] |
| 17. | Gao XD, Chen YR. Inhibition of telomerase with human telomerase reverse transcriptase antisense enhances tumor necrosis factor-alpha-induced apoptosis in bladder cancer cells. Chin Med J (Engl). 2007;120:755-760. [PubMed] |
| 18. | Bae NS, Baumann P. A RAP1/TRF2 complex inhibits nonhomologous end-joining at human telomeric DNA ends. Mol Cell. 2007;26:323-334. [PubMed] [DOI] |
| 19. | Cerone MA, Londono-Vallejo JA, Bacchetti S. Telomere maintenance by telomerase and by recombination can coexist in human cells. Hum Mol Genet. 2001;10:1945-1952. [PubMed] [DOI] |
| 20. | Vidaurreta M, Maestro ML, Rafael S, Veganzones S, Sanz-Casla MT, Cerdan J, Arroyo M. Telomerase activity in colorectal cancer, prognostic factor and implications in the microsatellite instability pathway. World J Gastroenterol. 2007;13:3868-3872. [PubMed] |
| 21. | Campbell LJ, Fidler C, Eagleton H, Peniket A, Kusec R, Gal S, Littlewood TJ, Wainscoat JS, Boultwood J. hTERT, the catalytic component of telomerase, is downregulated in the haematopoietic stem cells of patients with chronic myeloid leukaemia. Leukemia. 2006;20:671-679. [PubMed] [DOI] |
| 22. | Da MX, Wu XT, Guo TK, Zhao ZG, Luo T, Qian K, Zhang MM, Wang J. Clinical significance of telomerase activity in peritoneal lavage fluid from patients with gastric cancer and its relationship with cellular proliferation. World J Gastroenterol. 2007;13:3122-3127. [PubMed] |
| 23. | Wang Q, Kou YW. Study of the expressions of p53 and bcl-2 genes, the telomerase activity and apoptosis in GIST patients. World J Gastroenterol. 2007;13:2626-2628. [PubMed] |
| 24. | Widmann TA, Herrmann M, Taha N, Konig J, Pfreundschuh M. Short telomeres in aggressive non-Hodgkin's lymphoma as a risk factor in lymphomagenesis. Exp Hematol. 2007;35:939-946. [PubMed] [DOI] |
| 25. | Fakhoury J, Nimmo GA, Autexier C. Harnessing telomerase in cancer therapeutics. Anticancer Agents Med Chem. 2007;7:475-483. [PubMed] [DOI] |
| 26. | Sharma A, Rajappa M, Saxena A, Sharma M. Telomerase activity as a tumor marker in Indian women with cervical intraepithelial neoplasia and cervical cancer. Mol Diagn Ther. 2007;11:193-201. [PubMed] |
| 27. | Rosa MI, Medeiros LR, Bozzetti MC, Fachel J, Wendland E, Zanini RR, Moraes AB, Rosa DD. Accuracy of telomerase in cervical lesions: a systematic review. Int J Gynecol Cancer. 2007;17:1205-1214. [PubMed] [DOI] |
| 28. | Maris JM, Jensen J, Sulman EP, Beltinger CP, Allen C, Biegel JA, Brodeur GM, White PS. Human Kruppel-related 3 (HKR3): a candidate for the 1p36 neuroblastoma tumour suppressor gene? Eur J Cancer. 1997;33:1991-1996. [PubMed] [DOI] |
| 29. | Bruder CE, Dumanski JP, Kedra D. The mouse ortholog of the human SMARCB1 gene encodes two splice forms. Biochem Biophys Res Commun. 1999;257:886-890. [PubMed] [DOI] |
| 30. | Weber M, Stockhammer F, Schmitz U, von Deimling A. Mutational analysis of INI1 in sporadic human brain tumors. Acta Neuropathol. 2001;101:479-482. [PubMed] |
| 31. | Johnstone RW, Tommerup N, Hansen C, Vissing H, Shi Y. Mapping of the human PAWR (par-4) gene to chromosome 12q21. Genomics. 1998;53:241-243. [PubMed] [DOI] |
| 32. | Sugimoto Y, Morita R, Amano K, Shah PU, Pascual-Castroviejo I, Khan S, Delgado-Escueta AV, Yamakawa K. T-STAR gene: fine mapping in the candidate region for childhood absence epilepsy on 8q24 and mutational analysis in patients. Epilepsy Res. 2001;46:139-144. [PubMed] [DOI] |
| 33. | Dontenwill M, Vonthron C, Greney H, Magnier C, Heemskerk F, Bousquet P. Identification of human I1 receptors and their relationship to alpha 2-adrenoceptors. Ann N Y Acad Sci. 1999;881:123-134. [PubMed] [DOI] |