修回日期: 2008-03-18
接受日期: 2008-05-02
在线出版日期: 2008-05-08
目的: 观察胰腺癌组织Survivin的表达与细胞凋亡、增殖的关系.
方法: 采用TUNEL法和免疫组化法检测64例胰腺癌及癌旁组织的细胞凋亡指数(AI)与增殖指数(PI)及Survivin表达, 分析AI、PI与Survivin表达和临床病理因素的相关性.
结果: Survivin蛋白在癌旁组织无表达, 在胰腺癌组织阳性率为87.9%, 两者比较差异显著(P<0.001). AI与年龄、性别及肿瘤部位无关, 随胰腺癌组织分化程度的增加而增加, 癌旁组织显著高于胰腺癌组织(30.47% vs 1.64%, P<0.001); PI与年龄、性别、肿瘤部位及淋巴结转移无关, 而与癌组织的分化程度相关, 随着胰腺癌分化程度的降低而增加. 从分化程度观察, 胰腺癌组织AI与Survivin表达水平呈负相关(r = -0.85), PI与Survivin表达水平呈正相关(r = 0.87); 从有无转移来看, 胰腺癌AI与Survivin表达水平呈负相关(r = -0.81).
结论: Survivin凋亡抑制基因在胰腺癌发生和发展中起重要作用.
引文著录: 倪金良, 陈晓星, 张国新, 郝波, 施瑞华, 王学浩. 胰腺癌组织Survivin的表达与细胞凋亡、增殖的关系. 世界华人消化杂志 2008; 16(13): 1425-1429
Revised: March 18, 2008
Accepted: May 2, 2008
Published online: May 8, 2008
AIM: To investigate the relationship between survivin expression and the indexes of apoptosis and proliferation in pancreatic carcinoma tissues.
METHODS: Sixty-four pairs of pancreatic carcinoma and cancer-adjacent tissues were included in this study. TUNEL method was used to measure the cell apoptosis index, and immunohistochemistry was used to detect ki-67 expression (standing for the cell proliferation index) and Survivin expression. The relations of apoptosis index and proliferation index with Survivin expression and pathological features were analyzed.
RESULTS: The apoptosis index had no correlation with the age and gender of patients and tumor location, increased with the elevation of carcinoma differentiated degrees, and was markedly higher in cancer-adjacent tissues than that in cancer tissues (30.47% vs 1.64%, P < 0.001). The proliferation index had no correlation with the age and sex of patients, tumor location and lymphatic metastases, increased with the reduction of carcinoma differentiated degrees. From the view of differentiation, Survivin expression was negatively correlated with the apoptosis index (r = -0.85), but positively correlated with the proliferation index (r = 0.87) in pancreatic carcinoma tissues. From the view of metastases, the apoptosis index was negatively correlated with Survivin expression (r = -0.81).
CONCLUSION: Survivin gene plays an important role in the pathogenesis and development of pancreatic carcinoma.
- Citation: Ni JL, Chen XX, Zhang GX, Hao B, Shi RH, Wang XH. Relationship between Survivin expression and indexes of cell apoptosis and proliferation in pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(13): 1425-1429
- URL: https://www.wjgnet.com/1009-3079/full/v16/i13/1425.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i13.1425
Survivin是1997年耶鲁大学Altieri[1]实验室利用效应细胞蛋白酶受体(effector cell protease recepror 1, EPR-1)cDNA筛选人类基因组文库获得的凋亡抑制蛋白(inhibitory of apoptosis protein, IAP). Survivin是迄今已鉴定的8个IAPs家族成员中分子质量(16.5 kDa)最小和最具有基础与临床意义而倍受关注的分子. Survivin除了能以特征性的结构直接或间接抑制Caspase依赖或Caspase非依赖的凋亡途径之外, 更重要的是他表达的特异性与功能的多样性. Survivin在几乎所有的人类肿瘤中高表达, 在正常终末分化的成年组织或细胞中不表达[1-2]. 现在一般都认为Survivin在胰腺癌组织中呈高表达, 并与胰腺癌的分化程度、分期、淋巴结转移等生物学行为和临床特征有关, 对胰腺癌的诊断和预后判断有价值[2-5].
因为Survivin是目前所知最强的凋亡抑制基因之一, 因此Survivin表达水平与某些恶性肿瘤的凋亡水平呈负相关, 但是在胰腺癌细胞中Survivin与细胞凋亡水平之间的关系研究较少[6-8]. 本研究通过标记胰腺癌组织Ki-67基因及应用TUNEL法测定的凋亡指数比较了胰腺癌组织中增殖指数(PI)与凋亡指数(AI)的水平、二者与Survivin的关系, 并探讨胰腺癌细胞凋亡水平与肿瘤临床特征之间的关系.
64例胰腺导管细胞癌手术切除的石蜡标本, 均为南京医科大学第一附属医院近10年手术切除标本, 均包括癌组织和癌旁组织, 由本院病理科处理并诊断. 抗人Survivin多抗购自Santa-Cruze公司; 抗人Ki-67多抗购自长岛公司; HRP标记通用型二抗、DAB显色液为长岛公司产品; 枸橼酸盐缓冲液、PBS缓冲液为迈新公司产品; 防脱片剂购自迈新公司; 乙醇、苏木素、二甲苯、中性树胶均为本科实验室常备. TACS-BLUE TUNEL原位凋亡检测试剂盒购自美国R&D公司, 包含: 蛋白酶K, TdT标记缓冲液, TdT终止缓冲液, dNTP混合液, TdT酶, 链菌素-过氧化物酶, TACS蓝色标记液, Mg2+溶液, 核快红溶液. 其他实验仪器为本实验室常备.
64例胰腺导管细胞癌组织及癌旁组织, 按年龄、性别、肿瘤部位、分化程度和有无淋巴结转移等临床及生物学特征进行分析. 免疫组化采用SP一步法, Survivin一抗的工作浓度为1:200. 以PBS代替一抗作为空白对照. 免疫组化的阳性表达程度通过计数高倍视野下1000个特定细胞的染色结果判定, 染色阳性细胞为胞质或胞核内出现棕褐色深染区或颗粒样深染区. 以图像扫描仪分析阳性染色区域百分比作为Survivin的表达程度, 空白对照的染色灰度作为阴性对照. 采用免疫组化标记胰腺癌组织的Ki-67基因, Ki-67在胰腺导管细胞癌的工作浓度为1:25, 染色后计数1000个癌细胞, 细胞核出现棕褐色深染为染色阳性, 根据阳性染色结果的百分比计算PI. TUNEL法测定胰腺癌组织的AI, 按TACS-BLUE试剂盒说明进行, 染色后观察1000个癌细胞, 细胞核蓝色深染为阳性细胞染色, 根据阳性染色结果的百分比计算AI. 以PBS代替TdT酶的步骤作为空白对照.
统计学处理 SAS统计软件处理数据, AI与PI按率的比较作方差分析, Survivin、AI与PI的相关性按Spearman等级相关分析.
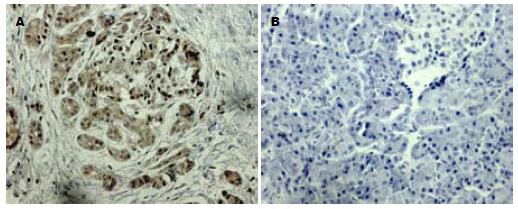
Survivin蛋白在癌旁组织无表达, 而胰腺癌组织可见大量的棕褐色深染区, 阳性率为87.9%, 与癌旁组织比较(图1, P<0.001).
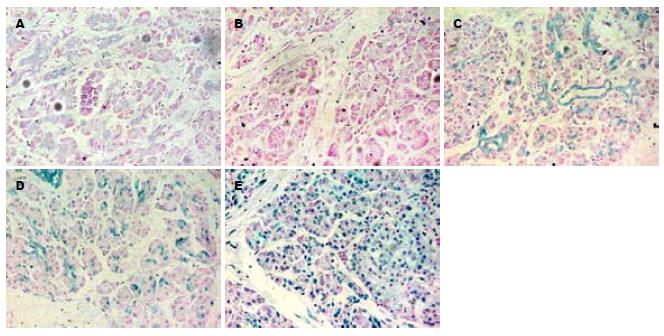
TUNEL染色可见空白对照组未见阳性的蓝色深染区, 注意红色染色为阴性. 胰腺癌组织可见数量不等的少量凋亡细胞: 低分化胰腺癌见散在细胞核染成深蓝色阳性, 中分化组可见较多细胞核染成深蓝色, 高分化组见胰腺癌细胞蓝色深染区增加; 而胰腺癌旁组织可见大量的凋亡细胞染色. 由此分析得到的AI表明, 胰腺癌旁组织的AI明显高于胰腺癌组织(30.47% vs 1.64%, P<0.001, 图2, 表1). 64例胰腺癌按不同年龄、性别、部位分组, 各组之间的AI无显著差异(P>0.05); AI与胰腺癌的分化程度和转移有关, 随着分化程度的的增加, 凋亡细胞数增加, 胰腺癌细胞AI增加(P<0.01, 图2, 表1); 有淋巴结转移组胰腺癌的AI亦低于无淋巴结转移组(P<0.01, 表1).
| 分组 | n | AI(%) | PI(%) | 癌旁组织AI(%) | |
| 年龄(岁) | ≥55 | 35 | 1.52 | 92.3 | 28.7 |
| <55 | 29 | 1.61 | 95.7 | 27.2 | |
| 性别 | 男 | 30 | 1.48 | 91.8 | 32.9 |
| 女 | 34 | 1.55 | 96.6 | 31.8 | |
| 分化程度 | 高 | 25 | 2.66 | 70.8 | 28.9 |
| 中 | 17 | 1.28 | 89.7 | 31.5 | |
| 低 | 22 | 0.75 | 98.5 | 27.6 | |
| 部位 | 胰头 | 41 | 1.61 | 94.3 | 29.5 |
| 体尾部 | 23 | 1.54 | 92.5 | 32.1 | |
| 淋巴结转移 | 有 | 33 | 0.69 | 97.9 | 32.7 |
| 无 | 31 | 1.72 | 94.3 | 30.6 |
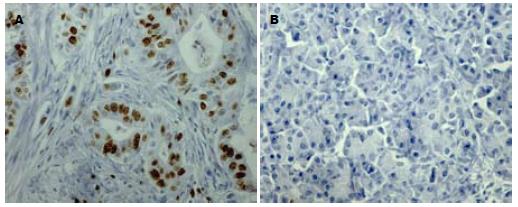
Ki-67阳性染色为细胞核部位呈棕褐色深染, 阴性者为苏木素染成蓝色. Ki-67在癌旁组织中无表达, 在胰腺导管细胞癌中的表达率为94.4%, 明显高于癌旁组织(P<0.001, 图3). 染色结果表明PI与年龄、性别、肿瘤部位及淋巴结转移无关, 而与肿瘤分化程度有关, 随着胰腺癌分化程度的降低则PI增加(P<0.01, 表1).
从分化程度观察, 胰腺癌组织AI与Survivin表达水平呈负相关(r = -0.85); PI与Survivin表达水平呈正相关(r = 0.87); 从有无转移来看, 胰腺癌AI与Survivin表达水平呈负相关(r = -0.81, 表2).
| 指标 | n | Survivin表达率 | AI | PI | |
| 分化程度 | 高 | 25 | 63.6 | 2.66 | 70.8 |
| 中 | 17 | 71.2 | 1.28 | 89.7 | |
| 低 | 22 | 94.3 | 0.75 | 98.5 | |
| 淋巴结转移 | 有 | 33 | 93.1 | 0.69 | 97.9 |
| 无 | 31 | 78.6 | 1.72 | 94.3 |
不同年龄、性别、部位、分化程度和有无淋巴结转移组的胰腺癌, 其癌旁组织的AI无显著性差异; 而胰腺癌的癌旁组织的AI显著高于癌组织(P<0.001).
细胞凋亡是一种基因调控下的细胞生理性死亡过程, 该过程受凋亡促进因子和凋亡抑制因子的共同调节. 凋亡的主要路径有二条, 即外源性和内源性路径[1,9]. 前者通过与TNF相关蛋白, 如Fas、Fas-L等细胞的死亡受体结合, 通过FADD激活起始Caspase-8, 经效应Caspase即Caspase-3和/或Caspase-7执行凋亡作用; 后者通过化疗药物、电离辐射(IR)等基因毒促使细胞线粒体释放细胞色素C, 经Apaf-1激活起始Caspase-9及经Bid激活起始Caspase-8, 再激活效应Caspase即Caspase-3和/或Caspase-7执行凋亡作用. 可见Caspase-3(-7)是内外源性凋亡途径的共同信号途径[9].
IAPs是近10年来发现的抑制细胞程序性死亡的一组蛋白因子, 对肿瘤的发生和耐受治疗起重要的作用[9]. IAPs广泛存在于各种恶性肿瘤中, 属于凋亡抑制因子家族, 所抑制凋亡启动因子的种类比目前已知的包括bcl-2家族在内的所有凋亡抑制基因更多. Survivin是目前所知相对分子质量最小的IAP成员, 仅由142个氨基酸和N-末端一个单独的杆状病毒凋亡抑制因子重复序列(baculoviral inhibitor of apoptosis repeat, BIR)结构域构成. Survivin具有强大的抑制凋亡的功能, 能够直接抑制内外凋亡途径的共同信号分子Caspase-3和Caspase-7的活性, 使Caspase-3不能有效地水解微管结构蛋白, 因而维持了纺锤体的完整性, 使细胞有丝分裂得以进行, 同时Survivin与周期蛋白激酶cdk4、p34cdc2相互作用阻断凋亡信号转导通路这二条途径来抑制细胞凋亡. Survivin抑制Fas、Bax、Caspases及多种化疗药物诱导的凋亡. 已证实Survivin表达阳性与凋亡抑制和肿瘤的复发呈正相关, 而Survivin的高表达也与多种肿瘤对放疗和化疗的敏感性和预后呈负相关.
肿瘤组织内Survivin的表达具有普遍性, 胃肠道恶性肿瘤中也存在着Survivin的高表达. Lu et al[10]用免疫组化的方法分析了174例胃癌, 其中60例(34.5%)呈不同程度的阳性表达, 癌旁正常组织均无表达. 其表达与p53和Bcl-2的表达正相关, 与胃癌凋亡指数负相关. Kawasaki et al[11]报道了Survivin在结直肠癌的表达情况, 其中91例(53.2%)阳性, 癌旁正常组织均无表达. 该作者还发现Survivin在低度异常增生腺瘤、高度异常增生腺瘤和腺癌组织中的表达依次增高, 凋亡指数依次降低, Ki-67标记的增殖指数和血管密度依次增高, 从而认为Survivin在人类结直肠肿瘤由低恶性到高恶性的发展过程中起着重要的作用. Satoh et al[12]用免疫组化、RT-PCR等方法对4株胰腺癌细胞株、56例不同的胰腺病变组织标本进行了Survivin与胰腺癌关系的研究. 结果表明胰腺癌阳性率为76.9%, 而非癌组织均为阴性, 在IPTM组织中为56.3%. 近来, 有学者发现胰腺导管上皮上皮内瘤变也有Survivin少量表达, 并且随着瘤变级别增高, Survivin的表达水平也逐渐增高, 则提示Survivin在胰腺癌的发病早期可能也有作用, 有待进一步的研究[13].
在胰腺癌中高表达的Survivin与凋亡指数(AI)呈负相关. 提示胰腺癌早期发病和进展过程中Survivin的表达即上调, 而凋亡受抑制. Sarela et al[14]研究发现52例胰腺癌中Survivin的阳性率为88%, p53阳性率为54%, bcl-2为12%. Survivin的表达与细胞的增殖与凋亡指数均相关. 多种研究结果表明, Survivin阳性时, 凋亡指数显著下降, 而凋亡指数低者其预后明显差于凋亡指数高者. Survivin表达阳性与否及对凋亡的抑制程度是评判胃肠道恶性肿瘤发展及预后的重要指标.
本研究采用TUNEL法和免疫组化观察和比较了胰腺癌和癌旁组织的AI和PI, 并与Survivin的相关性进行了比较. 我们的结果表明AI与胰腺癌的分化程度有关, 随着分化程度的降低, 胰腺癌细胞AI下降(P<0.01); 有淋巴结转移组胰腺癌的AI亦低于无淋巴结转移组(P<0.01). PI也与分化程度有关, 随着胰腺癌分化程度的降低则PI增加; 而胰腺癌Survivin表达与AI和PI的相关性结果提示, 从胰腺癌分化程度观察, 胰腺癌组织AI与Survivin表达水平呈负相关(r = -0.85); PI与Survivin表达水平呈正相关(r = 0.87); 从有无淋巴结转移观察, 胰腺癌AI与Survivin表达水平呈负相关(r = 0.81); 各分组的胰腺癌, 其癌旁组织的AI均显著高于癌组织(P<0.001). 以上结果进一步表明了胰腺癌Survivin与凋亡之间的密切关系, 与文献报道基本一致[12,14]. 提示Survivin这一凋亡抑制基因在胰腺癌发生和发展中的重要作用, 也为我们研究胰腺癌的基因治疗时选择Survivin作为靶基因提供了理论依据. 已有学者研究利用反义寡核苷酸、mRNA剪切和DNA疫苗等技术, 抑制Survivin的转录与表达, 从而降低培养癌细胞的恶性表型, 甚至抑制肿瘤的生长等[15-18], 探索Survivin的临床应用价值.
本研究TUNEL染色采用TACS-BLUE试剂盒, 阳性显色为蓝色, 而Ki-67阳性染色为棕褐色, 两者对比鲜明, 非常易于分析. 因胰腺癌旁组织几乎无Ki-67表达, 所以无法检测癌旁组织的PI. 今后可以考虑使用其他反映增殖水平的分子标志如增殖细胞核抗原(PCNA)或溴化脱氧尿嘧啶核苷(BrdU)染色, 在正常组织中也有表达, 不过他们可能不具备如Ki-67与Survivin的密切关系. 不同年龄、性别、分化程度和有无淋巴结转移组的胰腺癌旁组织的AI无显著性差异, 表明胰腺癌旁组织的AI与肿瘤的临床与生物学特征无关.
Survivin是1997年耶鲁大学Altieri实验室利用效应细胞蛋白酶受体(EPR-1)cDNA筛选人类基因组文库获得的凋亡抑制蛋白(IAP). Survivin是迄今已鉴定的8个IAPs家族成员中分子质量(16.5 kDa)最小和最具有基础与临床意义而倍受关注的分子. 现在一般都认为Survivin在胰腺癌组织中呈高表达, 并与胰腺癌的分化程度、分期、淋巴结转移等生物学行为和临床特征有关, 对胰腺癌的诊断和预后判断有价值.
吴泰璜, 教授, 山东省立医院肝胆外科; 吴河水, 教授, 华中科技大学同济医学院附属协和医院胰腺外科
Survivin是目前所知最强的凋亡抑制基因之一, 其表达水平与某些恶性肿瘤的凋亡水平程负相关, 但在胰腺癌细胞中的研究较少.
Kawasaki et al报道了Survivin在结直肠癌的表达情况, 其中91例(53.2%)阳性, 癌旁正常组织均无表达.
本研究为胰腺癌的基因治疗选择靶基因提供了初步的理论依据.
本文论述条理, 内容全面, 结论可靠, 国内期刊物无类似文章, 是一篇较好的论著.
编辑: 李军亮 电编:郭海丽
| 1. | Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3:917-921. [PubMed] [DOI] |
| 2. | Kami K, Doi R, Koizumi M, Toyoda E, Mori T, Ito D, Fujimoto K, Wada M, Miyatake S, Imamura M. Survivin expression is a prognostic marker in pancreatic cancer patients. Surgery. 2004;136:443-448. [PubMed] [DOI] |
| 3. | 陈 晓星, 倪 金良, 张 国新, 郝 波, 施 瑞华, 王 学浩. 胰腺癌组织Survivin与Ki-67的表达及其意义. 世界华人消化杂志. 2005;13:2650-2653. [DOI] |
| 5. | Jhala N, Jhala D, Vickers SM, Eltoum I, Batra SK, Manne U, Eloubeidi M, Jones JJ, Grizzle WE. Biomarkers in Diagnosis of pancreatic carcinoma in fine-needle aspirates. Am J Clin Pathol. 2006;126:572-579. [PubMed] [DOI] |
| 6. | Yang L, Cao Z, Yan H, Wood WC. Coexistence of high levels of apoptotic signaling and inhibitor of apoptosis proteins in human tumor cells: implication for cancer specific therapy. Cancer Res. 2003;63:6815-6824. [PubMed] |
| 7. | Westphal S, Kalthoff H. Apoptosis: targets in pancreatic cancer. Mol Cancer. 2003;2:6. [PubMed] [DOI] |
| 8. | Nimmanapalli R, Bhalla K. Targets in apoptosis signaling: promise of selective anticancer therapy. Methods Mol Biol. 2003;223:465-483. [PubMed] |
| 9. | Altieri DC. Survivin and apoptosis control. Adv Cancer Res. 2003;88:31-52. [PubMed] [DOI] |
| 10. | Lu CD, Altieri DC, Tanigawa N. Expression of a novel antiapoptosis gene, survivin, correlated with tumor cell apoptosis and p53 accumulation in gastric carcinomas. Cancer Res. 1998;58:1808-1812. [PubMed] |
| 11. | Kawasaki H, Altieri DC, Lu CD, Toyoda M, Tenjo T, Tanigawa N. Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer. Cancer Res. 1998;58:5071-5074. [PubMed] |
| 12. | Satoh K, Kaneko K, Hirota M, Masamune A, Satoh A, Shimosegawa T. Expression of survivin is correlated with cancer cell apoptosis and is involved in the development of human pancreatic duct cell tumors. Cancer. 2001;92:271-278. [PubMed] [DOI] |
| 13. | Bhanot U, Heydrich R, Moller P, Hasel C. Survivin expression in pancreatic intraepithelial neoplasia (PanIN): steady increase along the developmental stages of pancreatic ductal adenocarcinoma. Am J Surg Pathol. 2006;30:754-759. [PubMed] [DOI] |
| 14. | Sarela AI, Verbeke CS, Ramsdale J, Davies CL, Markham AF, Guillou PJ. Expression of survivin, a novel inhibitor of apoptosis and cell cycle regulatory protein, in pancreatic adenocarcinoma. Br J Cancer. 2002;86:886-892. [PubMed] [DOI] |
| 15. | Liang Z, Wei S, Guan J, Luo Y, Gao J, Zhu H, Wu S, Liu T. DNAzyme-mediated cleavage of survivin mRNA and inhibition of the growth of PANC-1 cells. J Gastroenterol Hepatol. 2005;20:1595-1602. [PubMed] [DOI] |
| 16. | Zhu K, Qin H, Cha SC, Neelapu SS, Overwijk W, Lizee GA, Abbruzzese JL, Hwu P, Radvanyi L, Kwak LW. Survivin DNA vaccine generated specific antitumor effects in pancreatic carcinoma and lymphoma mouse models. Vaccine. 2007;25:7955-7961. [PubMed] |
| 17. | 王 亚利, 宋 天保, 王 西京, 王 中卫, 宋 潍, 郝 小静. Survivin mRNA反义寡核苷酸诱导胰腺癌细胞凋亡. 世界华人消化杂志. 2004;12:1872-1874. [DOI] |
| 18. | Wobser M, Keikavoussi P, Kunzmann V, Weininger M, Andersen MH, Becker JC. Complete remission of liver metastasis of pancreatic cancer under vaccination with a HLA-A2 restricted peptide derived from the universal tumor antigen survivin. Cancer Immunol Immunother. 2006;55:1294-1298. [PubMed] [DOI] |