修回日期: 2008-02-29
接受日期: 2008-05-02
在线出版日期: 2008-05-08
目的: 通过研究散发性胃癌中错配修复基因hMLH1 mRNA的表达及其启动子区5'CpG岛甲基化状态, 探讨hMLH1基因异常甲基化在胃癌发生过程中的作用.
方法: 应用甲基化特异性PCR(methylation specific PCR, MSP)检测60例胃癌组织及其癌旁黏膜组织中hMLH1基因启动子区的甲基化状态, 逆转录PCR(RT-PCR)检测两种组织中hMLH1 mRNA表达情况.
结果: 胃癌组织hMLH1 mRNA表达水平明显低于癌旁组织(t = 4.082, P<0.01), hMLH1基因启动子区高甲基化18例(30%), 其癌旁黏膜组织中未发现有甲基化. hMLH1基因启动子区甲基化与胃癌的临床病理参数之间无明显的相关性. hMLH1 mRNA表达阴性的21例病例中, 17例(81%)发生甲基化, 而hMLH1 mRNA表达阳性的39例中仅有1例(2.5%)发生甲基化, hMLH1 mRNA表达降低与甲基化之间存在明显的相关性(χ2 = 8.0182, P = 0.0046).
结论: 胃癌组织中hMLH1基因启动子区甲基化与其mRNA表达缺失密切相关, 是导致hMLH1基因错配修复功能缺陷的重要原因之一.
引文著录: 吴安城, 刘希双, 杨堃. 错配修复基因hMLH1甲基化与胃癌的关系. 世界华人消化杂志 2008; 16(13): 1407-1411
Revised: February 29, 2008
Accepted: May 2, 2008
Published online: May 8, 2008
AIM: To detect the hypermethylation status of the 5'CpG island locating in the promoter region of hMLH1 (mismatch repair genes, MMR) gene, and to investigate the role of hMLH1 methylation in gastric carcinogenesis.
METHODS: Methylation specific polymerase chain reaction (MS-PCR) was used to examine the methylation status of hMLH1 promoter in 60 gastric carcinomas and 60 caner-adjacent normal tissues, and reverse transcription PCR (RT-PCR) was used to detect the mRNA expression of hMLH1 in the above tissues.
RESULTS: The expression of hMLH1 mRNA was significantly lower in cancer tissues than that in cancer adjacent tissues (t = 4.082, P < 0.01). The incidence of hMLH1 promoter methylation occurred in 30% (18/60) cases. No methylation of hMLH1 promoter was found in cancer-adjacent normal tissues. The methylation of hMLH1 promoter did not correlate with the clinicopathological characteristics of gastric carcinoma. Seventeen of 21 (81%) hMLH1 mRNA-negative cases exhibited prominent methylation, but 1 of 39 (2.5%) hMLH1 mRNA-positive cases showed methylation. There existed a significant correlation between hMLH1 methylation and mRNA decrease (χ2 = 8.0182, P = 0.0046).
CONCLUSION: Promoter methylation of hMLH1 is closely related to the expression loss of hMLH1 mRNA, which is involved in gastric carcinogenesis.
- Citation: Wu AC, Liu XS, Yang K. Relationship between mismatch repair gene hMLH1 promoter methylation and gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(13): 1407-1411
- URL: https://www.wjgnet.com/1009-3079/full/v16/i13/1407.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i13.1407
消化系肿瘤是我国常见的恶性肿瘤, 以胃癌最为常见. 作为多基因相关性肿瘤, 目前认为多种基因在不同阶段参与了胃癌的发生, 但发病机制仍不明确. 已有研究发现, 错配修复基因hMLH1的甲基化与胃癌有密切的关系[1], 但目前的研究多集中在已建立的胃癌细胞系或遗传家系上, 而对散发性肿瘤的相关研究相对较少. 为了弄清楚散发性胃癌中基因甲基化状态的改变及其与hMLH1 mRNA表达的关系, 本研究应用甲基化特异性PCR(methylation specific PCR, MSP)方法和逆转录PCR(reverse transcripition PCR, RT-PCR)方法, 检测60例胃癌组织及其癌旁黏膜组织中hMLH1基因启动子区的甲基化状态及mRNA表达情况, 探讨hMLH1基因异常甲基化在胃癌发生、发展过程中的作用.
自2005年青岛大学医学院附属医院普外科胃癌手术切除标本60例, 其中, 男42例, 女18例, 男女比2.3:1, 年龄35-80(平均62)岁. 经病理诊断低分化腺癌56例, 中分化腺癌2例, 印戒细胞癌2例. 患者术前均未接受放化疗和免疫治疗. 标本离体后, 在无菌条件下30 min内分别切取肿瘤实质部位及肿瘤远端(距癌组织3-5 cm)相对正常的癌旁胃组织各一份, 迅速放入液氮速冻并转至-80℃超低温冰箱冻存. DNA抽提试剂盒购自上海华舜生物工程有限公司. PCR试剂盒及RT-PCR试剂盒购自大连宝生生物工程有限公司. 10 mmol/L的氢醌(Sigma公司产品)和3 mol/L pH5.0的亚硫酸氢钠自制. Wizard DNA纯化柱购自Promega公司(Madison, WI, USA). 引物由上海生工生物工程技术服务有限公司合成(表1).
| hMLH1引物 | 引物序列(5'-3') | 产物长度(bp) | 温度(℃) | |
| 甲基化(M) | 正义 | ACGTAGACGTTTTATTAGGGTCGC | 115 | 55 |
| 甲基化(M) | 反义 | CCTCATCGTAACTACCCGCG | 115 | 55 |
| 非甲基化(U) | 正义 | TTTTGATGTAGATGTTTTATTAGGGTTGT | 124 | 55 |
| 非甲基化(U) | 反义 | ACCACCTCATCATAACTACCCACA | 124 | 55 |
| RT-PCR | 正义 | GACAGAGGAAGATGGTCCCAAAG | 396 | 58 |
| RT-PCR | 反义 | AGAATGTGTGAGCGCAAGGC | 396 | 58 |
| GAPDH | 正义 | TCATGGGTGTGAACCATGAGAA | 146 | 58 |
| GAPDH | 反义 | GGCATGGACTGTGGTCATGAG | 146 | 58 |
1.2.1 MSP检测hMLH1基因甲基化: 组织基因组DNA的提取按照DNA抽提试剂盒的说明操作. 甲基化修饰步骤为将2 μg DNA溶于50 μL双蒸水中, 加入2 mol/L NaOH 5.5 μL, 37℃水浴10 min, 再加入33 μL的10 mmol/L氢醌(对苯二酚)和520 μL的3 mol/L亚硫酸氢钠, 50℃水浴过夜16 h. 去除DNA杂质, 经Wizard DNA纯化柱过滤, 80 g/L异丙醇2 mL冲洗, 离心后向纯化柱内加入50 μL预热双蒸水(85℃), 放置1 min, 离心后保留洗脱液. 醋酸钠和纯乙醇沉淀DNA, 适量70%的冰乙醇洗脱1次, 空气干燥后加20 μL双蒸水溶解, 置-80℃冰箱保存备用. 然后运用巢式PCR扩增目的基因, 同一标本以甲基化引物和非甲基化引物分别扩增, 各基因的引物序列及PCR产物片段的大小见表1. PCR反应体系为50 μL, 其中: 10×PCR缓冲液5 μL, 2.5 mmol/L dNTP 4 μL, 甲基化上下游引物和去甲基化上下游引物分别为1 μL, 甲基化模板DNA5 μL, Taq酶0.25 μL, 加水至总体积50 μL. 反应条件: 95℃预变性1 min, 95℃ 30 s, 55℃ 30 s, 72℃ 1 min共35个循环, 最后72℃延伸5 min. 以水作为阴性对照. 取PCR产物5 μL, 与1 μL上样缓冲液混合, 进行20 g/L琼脂糖凝胶电泳检测, 紫外光凝胶成像系统观察结果. 若基因启动子区发生甲基化, 则用甲基化特异性引物可扩增出相应大小的条带; 若未发生甲基化, 则用非甲基化特异性引物可扩增出相应大小的条带.
1.2.2 RT-PCR检测hMLH1 mRNA表达: 按TRIzol试剂盒说明提取总RNA, 用紫外分光度仪测定A260/A280在1.9-2.0之间, 计算RNA含量. 经逆转录后再以cDNA为模板扩增. hMLH1 PCR反应条件: 94℃ 3 min, 以94℃ 30 s, 58℃ 30 s, 72℃ 60 s循环36次, 72℃延伸10 min; GAPDH PCR反应条件: 94℃ 3 min, 以94℃ 40 s, 58℃ 30 s, 72℃60 s循环32次, 72℃延伸10 min. 20 g/L琼脂糖凝胶电泳, 凝胶成像系统拍照并检测吸光度值, 将hMLH1与GAPDH吸光度比值作为其mRNA水平的相对值(相对值<1者定为hMLH1基因mRNA阴性表达; 其他为阳性表达), 重复实验2次, 取均值.
统计学处理 用SPSS12.0进行统计学分析. hMLH1 mRNA表达水平的差异用t检验, 甲基化频率的差异及甲基化频率与肿瘤临床病理特征之间的关系用χ2检验.
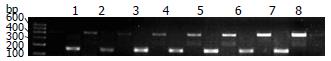
60例胃癌标本39例(65%)hMLH1 mRNA正常表达, 21例(35%)表达明显降低, 60例癌旁组织hMLH1 mRNA均正常表达. 胃癌组织hMLH1 mRNA表达水平明显低于癌旁组织(t = 4.082, P<0.01). 胃癌及癌旁组织hMLH1基因mRNA表达见图1.
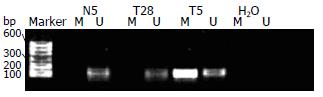
60例癌旁组织未见hMLH1基因启动子区甲基化现象, 所有癌旁组织hMLH1-U(hMLH1基因非甲基化)扩增均为阳性, hMLH1-M(hMLH1基因甲基化)扩增都为阴性; 60例胃癌中发现高甲基化18例, 占30%, 而且均为甲基化和非甲基化并存, 即hMLH1-U和hMLH1-M扩增都为阳性. 胃癌组织和癌旁组织甲基化修饰DNA MSP产物的琼脂糖凝胶电泳结果见图2.
hMLH1基因mRNA表达阴性的21例病例中, 17例(81%)发生了甲基化, 而hMLH1基因mRNA表达阳性的39例仅有1例发生甲基化(2.5%), hMLH1基因mRNA表达降低与甲基化之间存在明显的相关性(χ2 = 8.0182, P = 0.0046). 如图1所示, 其中前4例即第3、5、25、60号肿瘤组织标本均发现hMLH1基因启动子区存在甲基化, 其mRNA表达比第5号癌旁正常组织(n5)明显降低.
hMLH1基因启动子区甲基化与胃癌临床病理参数(肿瘤大小、癌肿部位、TNM分期和淋巴结转移)以及与年龄和性别间无明显相关性(表2).
| 病理参数 | 分组 | n | hMLM1甲基化n(%) | χ2 | P |
| 年龄(岁) | >60 | 30 | 10(33) | 0.3175 | 0.5731 |
| <60 | 30 | 8(27) | |||
| 肿瘤大小(cm) | >5 | 29 | 12(41) | 3.4610 | 0.0628 |
| <5 | 31 | 6(19) | |||
| 性别 | 男 | 42 | 11(26) | 0.9675 | 0.3253 |
| 女 | 18 | 7(39) | |||
| 癌肿部位 | 胃窦 | 26 | 6(23) | 1.0472 | 0.3062 |
| 胃体及贲门 | 34 | 12(35) | |||
| 淋巴结转移 | 有 | 9 | 4(44) | 1.0520 | 0.3051 |
| 无 | 51 | 14(27) | |||
| TNM分期 | ⅠⅡ期 | 22 | 5(23) | 0.8749 | 0.3496 |
| ⅢⅣ期 | 38 | 13(34) |
错配修复基因MMR是一组高度保守的看家基因, 已发现的人类错配修复基因有9种, hMLH1基因是研究较广泛的一种, 在多种组织中均有表达. 70%的hMLH1基因突变可形成终止密码, 导致翻译过早终止而产生不完全的hMLH1蛋白, 致使错配修复基因的表达在人类各种肿瘤细胞中的不同, 最终导致肿瘤的发生[2]. DNA甲基化作为一种生化修饰过程, 主要指在DNA甲基化转移酶作用下, 胞嘧啶第五位碳原子上被加上一个甲基基团. 通常情况下, DNA甲基化发生在CpG重复序列中. DNA甲基化常导致基因转录抑制, 其机制可能与以下两个因素有关: (1)胞嘧啶甲基化可能阻止转录因子与他们识别部位中的CpG序列结合; (2)这种转录抑制可能与两种蛋白质复合体(MeCP1和MeCP2)有关. 这两种蛋白质复合体能够特异性地与发生甲基化的CpG序列结合, 从而阻止转录因子与后者结合.
近年来, 在一些肿瘤及细胞系研究中发现, hMLH1启动子区甲基化与蛋白表达缺失直接相关, hMLH1基因启动子继发转录缺失是许多人类散发性肿瘤发生的一个重要事件, 与该基因启动子区甲基化密切相关[3-4]. Herman et al[5]用MSP法对37个结肠癌细胞株研究发现, 8株出现hMLH1基因甲基化, 占21.6%; 在34例原发性结肠癌中, 甲基化占32.4%; 39例对照组织(正常黏膜、淋巴结和痰细胞)无甲基化, 提示在结肠癌中hMLH1常见5'CpG岛的过度甲基化与癌症的发生有着密切的关系. Fleisher et al[6]检测了65例胃癌, 发现29例存在hMLH1异常甲基化, 发生hMLH1基因甲基化的胃癌仅表达少量的hMLH1蛋白, 而未发生甲基化的胃癌表达丰富的hMLH1蛋白. 故认为在胃癌中通常有hMLH1蛋白表达缺失, 且主要与hMLH1启动子区CpG岛甲基化有关. 本研究对60例胃癌组织检测发现有18例存在hMLH1启动子区甲基化, 甲基化发生率为30%, 而60例癌旁组织中未发现有甲基化, 两者存在显著性差异(P<0.01). 国内也开展了对肿瘤组织中hMLH1启动子区甲基化状态的一系列研究. 陈国安 et al[7]对肺癌组织中hMLH1启动子区甲基化状态及其与蛋白表达的关系进行分析, 在50例肺癌组织中甲基化发生率为32%, 14例hMLH1蛋白表达阴性者中, 有11例(78.6%)甲基化, 认为甲基化与hMLH1蛋白不表达有明显的相关性, 可能是导致hMLH1蛋白不表达的重要机制. 这充分表明甲基化在癌症的发生中扮演极为重要的角色. 在正常状态下基因启动子区一般是非甲基化的, 当其发生甲基化时, 常导致基因转录沉默, 使重要基因如DNA错配修复基因等功能丧失, 从而导致损伤的DNA不能被及时修复, 这与多种肿瘤的形成相关. 有研究发现甲基化与饮食[8]、年龄[9]、吸烟[10]和环境等[11]因素有关, 荷兰的一项队列研究表明, 叶酸摄入过低可导致甲基化状态紊乱, 这种变化可被过量饮酒所加剧. 陈国安 et al[7]统计了hMLH1启动子区甲基化与性别、吸烟状态、临床病理间的关系, 未发现有明显的相关性. 本研究也统计了甲基化与肿瘤大小、癌肿部位、淋巴转移和TNM分期等临床病理间的关系, 也未发现有明显的统计学意义. 这提示hMLH1启动子区甲基化可能是胃癌发生过程中的早期分子事件, 可望成为胃癌早期诊断的指标之一[12-14]. Nakajima et al[9]研究发现hMLH1甲基化频率随着年龄的增长而显著增高, 认为hMLH1甲基化在老年胃癌患者发病机制中起重要作用. 本文亦研究了甲基化频率与年龄的关系, 但未发现有明显的相关性, 可能与样本例数过少有关.
我们研究发现: 60例胃癌组织中hMLH1基因mRNA阴性表达21例, 60例癌旁组织中未发现有mRNA表达缺失. 在21例表达缺失的胃癌中有17例检测出甲基化(占81%), 而hMLH1基因mRNA表达无缺失的39例中仅有1例发生甲基化(占2.5%), 两者差异有显著性, 这与国内外研究结果相符[15-16]. 这提示hMLH1基因启动子区CpG高甲基化可使hMLH1基因沉默, 导致其mRNA表达缺失, 因此不能表达错配修复蛋白, 使其错配修复基因功能丧失, 最终导致胃癌的发生和发展. CpG岛高甲基化可能通过抑制CBF转录因子结合到相应的CCAATbox使hMLH1基因沉默. Veigl et al[17]人用去甲基化制剂5'氮杂胞嘧啶(5-azacytidine)处理因甲基化导致hMLH1失活的肿瘤细胞系, 成功地恢复了hMLH1的表达, 其表达水平取决于药物的剂量. 相反, 对hMLH1启动子未甲基化及由体细胞突变或生殖细胞缺陷引起的hMLH1表达缺失却无复活作用. 由此可见hMLH1启动子甲基化是基因表达关闭的主要原因, 进一步证实了异常甲基化与基因表达抑制和肿瘤的发生有着密切的关系.
在本试验中还发现1例CpG存在甲基化而mRNA表达却正常, 考虑可能原因是在同一胃癌组织中的部分癌细胞存在甲基化, 而另外一部分未被甲基化, 未甲基化部分表达正常的mRNA. 研究中还发现, 不论hMLH1基因的表达低下抑或缺失, 一个样本中非甲基化条带常与甲基化条带同时出现, 这与既往研究的结果一致[18-19]. 由于没有通过微切割取组织细胞, 因此癌肿组织中可能存在正常组织或者是肠化组织, 加之MSP方法极度敏感, 导致1例样本同时扩增出甲基化和非甲基化条带. Bai et al[20]认为这种现象是由于CpG岛甲基化在等位基因内的异质性, 或者是等位基因之间甲基化的差异所致, 可能提示hMLH1基因部分甲基化已足以使该基因转录沉默.
总之, 我们初步证实了hMLH1 mRNA在胃癌组织中表达减少或缺失, 并与启动子高度甲基化显著相关. 由于DNA甲基化状态可被逆转, 同样hMLH1启动子去甲基化可以恢复肿瘤细胞hMLH1 mRNA的再表达, 进而恢复MMR活性[21], 从而达到治疗的目的. 因此针对基因甲基化的靶向治疗已引起人们的重视.
hMLH1是一种重要的错配修复基因, 其功能缺陷与多种肿瘤的发生密切相关. 错配修复基因启动子区的甲基化是肿瘤抑癌基因失活的主要途径, 也可能是错配修复基因功能丧失的主要原因. 本研究通过研究散发性胃癌中错配修复基因hMLH1 mRNA的表达及其启动子区5'CpG岛甲基化状态, 探讨hMLH1基因异常甲基化在胃癌发生过程中的作用.
王小众, 教授, 福建医科大学附属协和医院消化内科
错配修复基因启动子区甲基化成为近来研究抑癌基因失活的热点. 检测hMLH1异常甲基化有可能成为判断胃癌发生的一项新指标.
国内外已有研究表明胃癌中存在hMLH1基因甲基化, 且发生hMLH1基因甲基化的胃癌仅表达少量的hMLH1蛋白, 而未发生甲基化的胃癌表达丰富的hMLH1蛋白.
通过对hMLH1基因蛋白表达及甲基化的检测判断胃癌的发生与否, 有助于胃癌的早期诊断.
本文应用MSP及RT-PCR法检测60例胃癌及癌旁黏膜中hMLH1甲基化状态, 对探讨hMLH1基因甲基化在胃癌发生, 发展中的作用有一定科学价值.
编辑: 李军亮 电编:何基才
| 3. | Kane MF, Loda M, Gaida GM, Lipman J, Mishra R, Goldman H, Jessup JM, Kolodner R. Methylation of the hMLH1 promoter correlates with lack of expression of hMLH1 in sporadic colon tumors and mismatch repair-defective human tumor cell lines. Cancer Res. 1997;57:808-811. [PubMed] |
| 4. | Yao Y, Tao H, Kim JJ, Burkhead B, Carloni E, Gasbarrini A, Sepulveda AR. Alterations of DNA mismatch repair proteins and microsatellite instability levels in gastric cancer cell lines. Lab Invest. 2004;84:915-922. [PubMed] [DOI] |
| 5. | Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] [DOI] |
| 6. | Fleisher AS, Esteller M, Wang S, Tamura G, Suzuki H, Yin J, Zou TT, Abraham JM, Kong D, Smolinski KN. Hypermethylation of the hMLH1 gene promoter in human gastric cancers with microsatellite instability. Cancer Res. 1999;59:1090-1095. [PubMed] |
| 7. | 陈 国安, 刘 天菊, 何 积银, 张 伟, 刘 毅, 金 顺钱, 李 申德, 孙 燕. 肺癌组织中错配修复基因hMLH1启动子甲基化状态分析. 中华肿瘤杂志. 2000;22:493-495. |
| 8. | Nan HM, Song YJ, Yun HY, Park JS, Kim H. Effects of dietary intake and genetic factors on hypermethylation of the hMLH1 gene promoter in gastric cancer. World J Gastroenterol. 2005;11:3834-3841. [PubMed] |
| 9. | Nakajima T, Akiyama Y, Shiraishi J, Arai T, Yanagisawa Y, Ara M, Fukuda Y, Sawabe M, Saitoh K, Kamiyama R. Age-related hypermethylation of the hMLH1 promoter in gastric cancers. Int J Cancer. 2001;94:208-211. [PubMed] [DOI] |
| 10. | Pulling LC, Divine KK, Klinge DM, Gilliland FD, Kang T, Schwartz AG, Bocklage TJ, Belinsky SA. Promoter hypermethylation of the O6-methylguanine-DNA methyltransferase gene: more common in lung adenocarcinomas from never-smokers than smokers and associated with tumor progression. Cancer Res. 2003;63:4842-4848. [PubMed] |
| 11. | Kang GH, Lee HJ, Hwang KS, Lee S, Kim JH, Kim JS. Aberrant CpG island hypermethylation of chronic gastritis, in relation to aging, gender, intestinal metaplasia, and chronic inflammation. Am J Pathol. 2003;163:1551-1556. [PubMed] |
| 12. | Kang GH, Shim YH, Jung HY, Kim WH, Ro JY, Rhyu MG. CpG island methylation in premalignant stages of gastric carcinoma. Cancer Res. 2001;61:2847-2851. [PubMed] |
| 13. | Sato F, Meltzer SJ. CpG island hypermethylation in progression of esophageal and gastric cancer. Cancer. 2006;106:483-493. [PubMed] [DOI] |
| 14. | Homma N, Tamura G, Honda T, Jin Z, Ohmura K, Kawata S, Motoyama T. Hypermethylation of Chfr and hMLH1 in gastric noninvasive and early invasive neoplasias. Virchows Arch. 2005;446:120-126. [PubMed] [DOI] |
| 15. | Leung SY, Yuen ST, Chung LP, Chu KM, Chan AS, Ho JC. hMLH1 promoter methylation and lack of hMLH1 expression in sporadic gastric carcinomas with high-frequency microsatellite instability. Cancer Res. 1999;59:159-164. [PubMed] |
| 16. | Deng G, Chen A, Hong J, Chae HS, Kim YS. Methylation of CpG in a small region of the hMLH1 promoter invariably correlates with the absence of gene expression. Cancer Res. 1999;59:2029-2033. [PubMed] |
| 17. | Veigl ML, Kasturi L, Olechnowicz J, Ma AH, Lutterbaugh JD, Periyasamy S, Li GM, Drummond J, Modrich PL, Sedwick WD. Biallelic inactivation of hMLH1 by epigenetic gene silencing, a novel mechanism causing human MSI cancers. Proc Natl Acad Sci U S A. 1998;95:8698-8702. [PubMed] [DOI] |
| 18. | Kang GH, Lee S, Kim JS, Jung HY. Profile of aberrant CpG island methylation along the multistep pathway of gastric carcinogenesis. Lab Invest. 2003;83:635-641. [PubMed] |
| 19. | Oue N, Sentani K, Yokozaki H, Kitadai Y, Ito R, Yasui W. Promoter methylation status of the DNA repair genes hMLH1 and MGMT in gastric carcinoma and metaplastic mucosa. Pathobiology. 2001;69:143-149. [PubMed] [DOI] |