修回日期: 2008-03-27
接受日期: 2008-05-02
在线出版日期: 2008-05-08
目的: 观察抗内毒素Fab'对严重烧伤早期肠源性内毒素血症小鼠肠道损伤的保护作用, 探讨防治烧伤脓毒症的新措施.
方法: 采用严重烧伤早期肠源性内毒素血症小鼠模型, 分为对照组(A组)、烧伤组(B组)和治疗组(C组), 分别于6、12、24和48 h 4个时相点测定血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-10(interleukin-10, IL-10)的含量; 肠黏膜组织病理检测损伤情况.
结果: 与A组相比, 烧伤后血清TNF-α、IL-1β和IL-10含量明显增高, 24 h达到高峰(TNF-α: 242.06±3.93 ng/L vs 14.98±1.13 ng/L; IL-1β: 37.86±5.88 ng/L vs 14.39±2.43 ng/L; IL-10: 324.78±65.82 ng/L vs 97.63±20.48 ng/L, 均P<0.01); C组TNF-α、IL-1β、IL-10含量, 在6、12、24和48 h 4个时相点时(99.69±10.67 ng/L, 19.19±1.17 ng/L, 160.44±24.99 ng/L; 172.07±22.47 ng/L, 22.29±3.32 ng/L, 185.44±22.30 ng/L; 125.98±6.93 ng/L, 28.39±2.59 ng/L, 237.11±30.28 ng/L; 107.88±5.24 ng/L, 26.23±2.51 ng/L, 207.86±20.35 ng/L)较烧伤组显著降低(均P<0.01). 病理检查结果提示C组较B组肠黏膜损伤有不同程度减轻.
结论: 抗内毒素Fab'能抑制内毒素所诱导的TNF-α、IL-1β产生, 同时调节血清中的IL-10水平, 减轻内毒素对机体的损害, 从而起到对严重烧伤后肠源性脓毒症的防治作用.
引文著录: 庄颖, 张雅萍, 马思远. 抗内毒素Fab'对严重烧伤早期小鼠肠道损伤的保护作用. 世界华人消化杂志 2008; 16(13): 1402-1406
Revised: March 27, 2008
Accepted: May 2, 2008
Published online: May 8, 2008
AIM: To investigate the protective effect of Fab' against endotoxin on intestinal mucosa during the early stage in severely burned gut-derived endotoxemia mice, and to explore a new method for preventing and curing burn sepsis.
METHODS: The severely burned gut-derived endotoxemia mice model was used, and the mice were divided into 3 groups: control group (group A), burn group (group B) and Fab' treatment group (group C). At the 6th, 12th, 24th and 48th h after burn injury, the levels of serum tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and interleukin-10 (IL-10) were determined by enzyme-linked immunosorbent assay. Intestinal tissues were collected for pathological examination.
RESULTS: In comparison with those in group A, the levels of serum TNF-α, IL-1β and IL-10 in group B increased significantly and reached the peak 24 h after burn injury (TNF-α: 242.06 ± 3.93 ng/L vs 14.98 ± 1.13 ng/L; IL-1β: 37.86 ± 5.88 ng/L vs 14.39 ± 2.43 ng/L; IL-10: 324.78 ± 65.82 ng/L vs 97.63 ± 20.48 ng/L; all P < 0.01). The levels of TNF-α, IL-1β and IL-10 at 6, 12, 24 and 48 h in group C (6 h: 99.69 ± 10.67, 19.19 ± 1.17, 160.44 ± 24.99 ng/L; 12 h: 172.07 ± 22.47, 22.29 ± 3.32, 185.44 ± 22.30 ng/L; 24 h: 125.98 ± 6.93, 28.39 ± 2.59, 237.11 ± 30.28 ng/L; 48 h: 107.88 ± 5.24, 26.23 ± 2.51, 207.86 ± 20.35 ng/L) were significantly different from those in group B (all P < 0.05). Pathological examination showed a lower degree of intestinal mucosal injury in group C than in compared with group B.
CONCLUSION: The Fab' against endotoxin can significantly decrease the level of serum TNF-α, IL-1β and IL-10 during the early stage in severely burned gut-derived endotoxemia mice, and consequently alleviate the endotoxin-induced injury.
- Citation: Zhuang Y, Zhang YP, Ma SY. Protective effect of Fab' in immunoglobulin Y against lipopolysaccharide on intestinal mucosa during the early stage in severely burned gut-derived endotoxemia mice. Shijie Huaren Xiaohua Zazhi 2008; 16(13): 1402-1406
- URL: https://www.wjgnet.com/1009-3079/full/v16/i13/1402.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i13.1402
脓毒症是严重烧伤患者最常见并发症, 也是多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的主要诱因之一. 许多研究表明肠道在全身性炎症反应综合征(systemic inflammatory response syndrome, SIRS)、脓毒症、MODS的连续发生、发展中起重要作用, 被认为是危重病应激的"中心器官"和MODS的"启动器"[1]. 目前肠源性脓毒症的防治已成为危重病研究的热点. 内毒素/脂多糖(lipopolysacharides, LPS)是引起严重创伤和烧伤并发SIRS、脓毒症以及MODS的重要因素之一[2]. 本研究采用小鼠的严重烧伤早期肠源性内毒素血症模型, 观察抗内毒素Fab'对血清肿瘤坏死因子-α(tumor necrosis factor-α, INF-α)、白介素-1β(interleukin-1β, IL-1β)和白介素-10(interleukin-10, IL-10)水平的调控作用.
纯系昆明种小鼠97只, 25 wk龄雌雄不限, 体质量28-32 g, 由中国人民解放军第三军医大学实验动物中心提供, 常规喂养, 室温15-25℃, 自然采光. LPS(E.coliO55: B5菌株)购自Sigma公司. 抗内毒素Fab'由本所制备. TNF-α、IL-1β、IL-10 ELISA试剂盒为美国R&D公司原装产品,由深圳晶美生物有限公司上海分公司提供. 酶标仪ELX808系美国Biotek公司产品, 严格按照说明书进行操作定量测定.
1.2.1 造模和分组: 禁食水8 h, 背部脱毛后称体质量, ig 10 g/L NaHCO3 0.2 mL, 按照文献得到的LD50值[3]ig LPS 0.5 mL; 备皮区涂3%凝固汽油1 mL, 燃烧14 s致30% Ⅲ度烧伤, 烧伤面积计算方法: 小鼠体表总面积计算公式: S = 0.0913×W2/3, 其中S代表小鼠体表面积(cm2), W代表小鼠体质量(g), 则30% Ⅲ度烧伤小鼠模型烧伤面积为: S×30%. 伤后立即ip等渗盐水2 mL/只抗休克, 创面涂碘伏抗感染, 伤后常规饲养. 动物随机分为3组, 假伤组(A组), 10只, 除不烧伤外, 其他处理同模型制作; 烧伤模型组(B组), 45只, 烧伤后ig等渗盐水0.5 mL, 以后每6 h重复1次; 治疗组(C组), 42只, 烧伤后ig抗内毒素Fab'等渗盐溶液0.5 mL, 以后每6 h重复1次. 模型组及治疗组分为伤后6、12、24、48 h组, 每组随机分配10-12只小鼠.
1.2.2 指标检测和病理检查: 处死各时相点存活的小鼠,无菌条件下取血, 3000 r/min, 离心10 min后取血清置-80℃保存待测. 采用鲎试剂偶氮显色基质法测定内毒素. 双抗体夹心酶联免疫吸附法(ELISA)测定TNF-α、IL-1β和IL-10的含量. 取距回盲部1 cm处的回肠1 cm, 剖开清洗干净后, 经40 g/L甲醛固定, 常规石蜡包埋、切片、HE染色后, 光镜下观察黏膜损害情况.
统计学处理 各分组所得计量数据采用mean±SD表示, 用SPSS13.0软件处理数据, 两组间均数比较用t检验. 检验水准α = 0.05, P<0.05有统计学意义.
在伤后6、48 h, 烧伤组与治疗组的死亡率差异无统计学意义(P>0.05); 其中伤后12、24 h, 治疗组死亡率依次为18.18%、20.00%, 低于烧伤组对应时间死亡率, 差异具有统计学意义(P<0.05); 治疗组总死亡率为16.67%, 低于烧伤组的48.89%, 差异具有显著性(P<0.01, 表1).
严重烧伤早期小鼠血清LPS、TNF-α、IL-1β及IL-10迅速升高, 各时相点含量均显著高于A组(P<0.01). C组也体现出相似趋势, 但其含量较B组均显著降低(P<0.01, 表2).
| 分组 | 伤后时间(h) | LPS(EU/mL) | TNF-α(ng/L) | IL-1β(ng/L) | IL-10(ng/L) |
| A组 | 0 | 0.04±0.03 | 14.98±1.13 | 14.39±2.43 | 97.63±20.48 |
| B组 | 6 | 0.84±0.17b | 179.58±2.97b | 27.57±5.16b | 227.23±16.86b |
| 12 | 0.95±0.13b | 242.06±3.93b | 29.26±3.60b | 264.27±38.28b | |
| 24 | 0.91±0.13b | 289.52±5.43b | 37.86±5.88b | 324.78±65.82b | |
| 48 | 0.86±0.21b | 247.87±3.75b | 33.18±3.37b | 285.13±13.06b | |
| C组 | 6 | 0.14±0.06bd | 99.69±10.67bd | 19.19±1.17bd | 160.44±24.99bd |
| 12 | 0.27±0.10bd | 172.07±22.47bd | 22.29±3.32bd | 185.44±22.30bd | |
| 24 | 0.23±0.07bd | 125.98±6.93bd | 28.39±2.59bd | 237.11±30.28bd | |
| 48 | 0.19±0.03bd | 107.88±5.24bd | 26.23±2.51bd | 207.86±20.35bd |
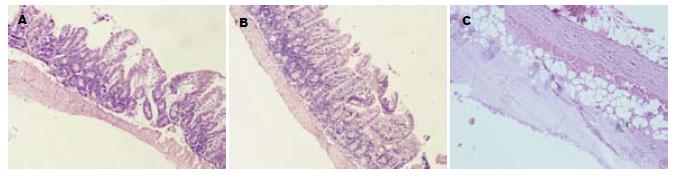
肠源性内毒素血症小鼠早期肠黏膜即出现中央乳糜管扩张, 上皮下间隙形成, 肠绒毛顶端上皮剥脱, 固有层裸露, 间质广泛性充血、水肿、大量中性粒细胞浸润等损伤性改变. 治疗组动物黏膜病变明显缓解(图1).
烧伤脓毒症往往来势凶猛, 进展迅速, 死亡率高, 一直是国内外烧伤医学界研究的热点、重点和亟待解决的重大疑难问题[4]. 肠道是人体最大的细菌及毒素库, 肠道黏膜是抵御入侵的重要屏障且极易受损, 因此保护肠道功能是防御MODS和降低脓毒症患者病死率的关键之一[5-7]. 严重烧伤后肠黏膜机械屏障破坏, 肠道内固有菌群失调, 肠道免疫功能受抑, 导致肠腔内毒素易位入血; 内毒素又可通过缺氧、炎症介质释放、自由基增多使肠黏膜屏障进一步受损, 大量细菌和毒素易位, 引起体内抑炎性和促炎性炎症介质平衡失调, 导致恶性循环加重损伤, 最终造成MODS, 甚至死亡[8-9]. 目前尚无满意的拮抗内毒素的药物应用于临床. 自从鸡卵黄免疫球蛋白Y技术问世以来, 卵黄抗体就以其成本低、产量高、易制备、均一性及稳定性好、特异性强等独特的优点引起人们的广泛关注和研究. 目前已成功提取出抗小分子蛋白质、病毒、细菌的IgY, 并发现其具有良好的抗病毒抗细菌的生物学效应, 用于口服防治肠道病原体已取得良好效果[10-12]. 我们以内毒素为抗原免疫产蛋母鸡, 提纯IgY并酶切去除易引起过敏反应的Fc段, 得到抗内毒素Fab'. 我们前期体外实验表明抗内毒素Fab'具有广谱的抗G-菌内毒素作用. 本实验遂以严重烧伤后肠源性内毒素血症小鼠为模型, 探讨Fab'对烧伤小鼠肠源性脓毒症的防治作用.
细胞因子在体内形成统一网络系统, 他们相互协调、相互拮抗, 调节机体的生理活动. 在正常的免疫应答中, 各种相关的细胞因子通常协调和谐, 在某种情况下某些细胞因子产生或其受体表达异常, 均会导致病理改变. 炎症介质失衡在脓毒症的病理生理过程中起决定性作用[13-17]. 研究表明LPS能降低上皮细胞的抵抗力、促进细胞凋亡的产生并疏松紧密连接而增加上皮细胞通透性, 促进细菌易位, 损伤肠黏膜屏障, 引起肠炎症改变, 包括固有层水肿和绒毛结构的丢失, 炎性细胞浸润[18-19]. 在一定条件下还可激发细胞因子和其他炎性介质如TNF-α、IL-1β和IL-6的连锁反应, 引起全身各器官的损害[20].
TNF-α主要来源于内毒素刺激的单核-巨噬细胞, 通过诱导其他细胞因子如IL-1β、IL-6和IL-8等的产生和释放, 在造成机体损伤的同时, 可通过再激活炎症效应细胞释放更多的炎性因子, 使炎症信号进步放大和加强, 产生"级联放大"作用[21-23]. IL-1是急性期免疫反应的主要调节因子, 可与TNF-α等其他细胞因子协同作用引起发热, 诱导肝细胞合成急性期蛋白, 引起代谢紊乱; 促进炎性蛋白合成炎性介质释放, 加重炎症反应; 活化内皮细胞, 引起血液凝固、增加黏附分子表达, 参与休克的病理过程; 使血管通透性增加, 造成低血压等[24-25]. 体内多种细胞可分泌IL-10, 包括单核/巨噬细胞、CD4+ T细胞、CD8+ T细胞和B细胞等, 在体内IL-10合成晚于促炎症细胞因子[26-27]. IL-10又称"细胞因子合成抑制因子", 可抑制单核/巨噬细胞等产生TNF-α、IL-1、IL-6和IL-8等促炎症细胞因子, 引起细胞免疫抑制[28]. IL -10对炎症免疫应答有抑制作用, 起负性调控作用, 抑制或减少这些炎症细胞因子的产生和释放, 在一定程度上对机体起了保护作用, 有助于全身炎症反应的控制和病情的好转[29]. 但过量的IL-10对机体的组织器官又会造成损害. Lehmann et al[30]发现血清中IL-10的水平与促炎性细胞因子的浓度呈正相关.
本研究采用严重烧伤后肠源性内毒血症动物模型, 结果显示: (1)烧伤后血清LPS含量显著升高, 远高于正常小鼠, 病理检查结果也表明肠黏膜的损伤情况, 本模型具有稳定性和重复性好的特点, 可以满足实验需要. (2)通过对动物死亡率的观察, 经ig抗内毒素Fab'治疗, 小鼠死亡率明显降低, 可能与抗内毒素Fab'拮抗LPS并减轻其诱导的SIRS及脏器功能损害. (3)模型组小鼠血清LPS、TNF-α、IL-1β和IL-10烧伤后水平明显升高, 提示LPS诱导了损伤的炎性反应, 促炎介质TNF-α、IL-1β和抗炎介质IL-10均参与了脓毒症时的病理变化过程. 促炎与抗炎的相互作用, 导致了损伤的发生和发展. (4)烧伤后LPS含量大幅升高, 在伤后12 h达到高峰, 然后缓慢下降, 治疗组的变化趋势与烧伤组基本一致, 但升高幅度明显降低, 与烧伤组比较, 差异具有显著性(P<0.01); TNF-α和IL-1β的含量变化与LPS相似, 在伤后24 h达到高峰, 说明了内毒素与炎性介质之间相互关联的密切关系. (5)抑炎性细胞因子IL-10的含量变化与TNF-α和IL-1β有相似的趋势, 提示严重烧伤早期抑炎性细胞因子的水平与促炎性细胞因子的浓度呈正相关, 抗内毒素Fab'具有调节小鼠血清中TNF-α、IL-1β和IL-10水平的作用, 通过抑制高水平的炎症细胞因子对机体的损害, 实现肠道保护作用. (6)本实验给予外源性抗内毒素Fab'发现对小鼠血清中炎性介质的释放有明显的抑制作用, 病理结果提示肠黏膜组织损伤也有显著减轻, 我们可以推测通过抗内毒素Fab'与LPS的特异性结合, 阻止LPS与受损的肠黏膜细胞结合并易位, 影响了LPS的生物学活性, 从而减轻其在脓毒症中的源头作用.
我们的研究表明抗内毒素Fab'可抑制LPS 诱导的促炎性细胞因子和抗炎性细胞因子的释放, 降低内毒素作用下小鼠肠组织的炎症反应, 对肠黏膜损伤具有一定的保护作用, 为抗内毒素Fab'的进一步开发研究提供了重要的实验依据, 为严重烧伤后肠道损伤的保护和脓毒症的治疗探索了一条新措施.
肠道在全身性炎症反应综合征、脓毒症和MODS的连续发生发展中起重要作用, 保护肠道功能是防御MODS和降低危重病患者病死率的关键之一. 严重烧伤早期, 内毒素与肠道损伤密切相关. 但目前尚无有效的拮抗内毒素的药物应用于临床, 因此寻求一种能有效拮抗内毒素并抑制其对机体损伤作用的治疗措施具有广泛意义.
王忠裕, 教授, 大连医科大学附属第一医院普通外科二科; 王凤山, 副教授, 中国医科大学附属第一医院普外一科
烧伤脓毒症往往来势凶猛, 进展迅速, 死亡率高, 一直是国内外烧伤医学界研究的热点、重点和亟待解决的重大疑难问题.
有研究表明胃蛋白酶酶切IgY后产生的Fab'片段仍然具有结合相应抗原和发挥拮抗效应等生物学活性的能力.
抗内毒素Fab'对哺乳动物严重烧伤早期肠道损伤及肠源性内毒素损害具有显著的保护和治疗作用, 从而为将来通过进一步的研究和开发, 使其成为一种有效的预防和治疗哺乳动物严重烧伤后肠源性内毒素损害和肠粘膜损伤的药物提供了新的理论依据.
本研究内容针对性强, 检测指标能够反映小鼠烧伤后的肠道损伤程度及治疗效果, 对今后烧伤治疗有一定的启示.
编辑: 李军亮 电编:郭海丽
| 1. | Liboni KC, Li N, Scumpia PO, Neu J. Glutamine modulates LPS-induced IL-8 production through IkappaB/NF-kappaB in human fetal and adult intestinal epithelium. J Nutr. 2005;135:245-251. [PubMed] |
| 2. | O'Reilly M, Newcomb DE, Remick D. Endotoxin, sepsis, and the primrose path. Shock. 1999;12:411-420. [PubMed] [DOI] |
| 4. | Shlyk IV, Pivovarova LP, Krylov KM, Filippova OV, Il'ina VA, Krylov PK. Clinical and immunological criteria of burn sepsis. Anesteziol Reanimatol. 2005;42-45. [PubMed] |
| 5. | Gosain A, Gamelli RL. Role of the gastrointestinal tract in burn sepsis. J Burn Care Rehabil. 2005;26:85-91. [PubMed] [DOI] |
| 6. | Magnotti LJ, Deitch EA. Burns, bacterial translocation, gut barrier function, and failure. J Burn Care Rehabil. 2005;26:383-391. [PubMed] [DOI] |
| 7. | Epstein MD, Banducci DR, Manders EK. The role of the gastrointestinal tract in the development of burn sepsis. Plast Reconstr Surg. 1992;90:524-531. [PubMed] |
| 8. | McMillen MA, Huribal M, Sumpio B. Common pathway of endothelial-leukocyte interaction in shock, ischemia, and reperfusion. Am J Surg. 1993;166:557-562. [PubMed] [DOI] |
| 9. | Schmidt H, Martindale R. The gastrointestinal tract in critical illness. Curr Opin Clin Nutr Metab Care. 2001;4:547-551. [PubMed] [DOI] |
| 10. | Yokoyama K, Sugano N, Shimada T, Shofiqur RA, Ibrahim el-SM, Isoda R, Umeda K, Sa NV, Kodama Y, Ito K. Effects of egg yolk antibody against Porphyromonas gingivalis gingipains in periodontitis patients. J Oral Sci. 2007;49:201-206. [PubMed] |
| 11. | Amaral JA, De Franco MT, Zapata-Quintanilla L, Carbonare SB. In vitro reactivity and growth inhibition of EPEC serotype O111 and STEC serotypes O111 and O157 by homologous and heterologous chicken egg yolk antibody. Vet Res Commun. 2008;32:281-290. [PubMed] [DOI] |
| 12. | Chalghoumi R, Thewis A, Portetelle D, Beckers Y. Production of hen egg yolk immunoglobulins simultaneously directed against Salmonella enteritidis and Salmonella typhimurium in the same egg yolk. Poult Sci. 2008;87:32-40. [PubMed] [DOI] |
| 13. | Ozbalkan Z, Aslar AK, Yildiz Y, Aksaray S. Investigation of the course of proinflammatory and anti-inflammatory cytokines after burn sepsis. Int J Clin Pract. 2004;58:125-129. [PubMed] [DOI] |
| 14. | Osuchowski MF, Welch K, Siddiqui J, Remick DG. Circulating cytokine/inhibitor profiles reshape the understanding of the SIRS/CARS continuum in sepsis and predict mortality. J Immunol. 2006;177:1967-1974. [PubMed] |
| 15. | Osuchowski MF, Welch K, Yang H, Siddiqui J, Remick DG. Chronic sepsis mortality characterized by an individualized inflammatory response. J Immunol. 2007;179:623-630. [PubMed] |
| 16. | Xiao H, Siddiqui J, Remick DG. Mechanisms of mortality in early and late sepsis. Infect Immun. 2006;74:5227-5235. [PubMed] [DOI] |
| 17. | Hotchkiss RS, Karl IE. Cytokine blockade in sepsis-Are two better than one? Crit Care Med. 2001;29:671-672. [PubMed] [DOI] |
| 18. | Qureshi FG, Leaphart C, Cetin S, Li J, Grishin A, Watkins S, Ford HR, Hackam DJ. Increased expression and function of integrins in enterocytes by endotoxin impairs epithelial restitution. Gastroenterology. 2005;128:1012-1022. [PubMed] [DOI] |
| 19. | Alscher KT, Phang PT, McDonald TE, Walley KR. Enteral feeding decreases gut apoptosis, permeability, and lung inflammation during murine endotoxemia. Am J Physiol Gastrointest Liver Physiol. 2001;281:G569-G576. [PubMed] |
| 20. | Wischmeyer PE, Kahana M, Wolfson R, Ren H, Musch MM, Chang EB. Glutamine reduces cytokine release, organ damage, and mortality in a rat model of endotoxemia. Shock. 2001;16:398-402. [PubMed] |
| 21. | Suzuki K, Nakaji S, Yamada M, Totsuka M, Sato K, Sugawara K. Systemic inflammatory response to exhaustive exercise. Cytokine kinetics. Exerc Immunol Rev. 2002;8:6-48. [PubMed] |
| 22. | Yeh FL, Lin WL, Shen HD, Fang RH. Changes in serum tumour necrosis factor-alpha in burned patients. Burns. 1997;23:6-10. [PubMed] [DOI] |
| 23. | Blackwell TS, Christman JW. Sepsis and cytokines: current status. Br J Anaesth. 1996;77:110-117. [PubMed] |
| 24. | Hildebrand F, Pape HC, Krettek C. The importance of cytokines in the posttraumatic inflammatory reaction. Unfallchirurg. 2005;108:793-794, 796-803. [PubMed] |
| 25. | Cembrzynska-Nowak M. Effect of post-trauma endotoxemia on production of IL-1 beta in burn patients. Postepy Hig Med Dosw. 1996;50:537-540. [PubMed] |
| 26. | Yeh FL, Lin WL, Shen HD. Changes in circulating levels of an anti-inflammatory cytokine interleukin 10 in burned patients. Burns. 2000;26:454-459. [PubMed] [DOI] |
| 27. | Yeh FL, Shen HD, Fang RH. Deficient transforming growth factor beta and interleukin-10 responses contribute to the septic death of burned patients. Burns. 2002;28:631-637. [PubMed] [DOI] |
| 28. | Armstrong L, Millar AB. Relative production of tumour necrosis factor alpha and interleukin 10 in adult respiratory distress syndrome. Thorax. 1997;52:442-446. [PubMed] |
| 29. | Kawai S, Sakayori S, Kobayashi H. The role of IL-10 in patients with SIRS (systemic inflammatory response syndrome)--in relation to TNF activity. Kansenshogaku Zasshi. 1995;69:765-771. [PubMed] |
| 30. | Lehmann AK, Halstensen A, Sornes S, Rokke O, Waage A. High levels of interleukin 10 in serum are associated with fatality in meningococcal disease. Infect Immun. 1995;63:2109-2112. [PubMed] |