修回日期: 2008-03-14
接受日期: 2008-05-02
在线出版日期: 2008-05-08
目的: 探讨牛磺酸(taurine, Tau)在大鼠胰岛培养过程中对胰岛的保护作用及其机制.
方法: 实验Wistar大鼠分为2组, RPMI 1640组和牛磺酸组(Tau组). 流式细胞仪检测Caspase-9和磷酸化Akt阳性细胞比例, 观察牛磺酸对Caspase-9及Akt的影响. RT-PCR检测单纯1640组和Tau组胰岛细胞的TNF-α、IL-1β、NF-κB和HO-1基因的表达.
结果: 胰岛单纯用RPMI 1640培养1 wk后激活的Caspase-9与加入牛磺酸后相比有统计学意义(41.03%±4.46% vs 23.85%±3.09%, P<0.05). 胰岛分离纯化后有明显的TNF-α mRNA、IL-1β mRNA、NF-κB mRNA、HO-1 mRNA表达, 随着培养时间的延长TNF-α mRNA、IL-1β mRNA、NF-κB mRNA表达逐渐减弱, HO-1 mRNA表达逐渐增强. 加入牛磺酸后胰岛TNF-α mRNA、IL-1β mRNA、NF-κB mRNA表达明显减弱, 在6 h, 72 h及1 wk时 (TNF-α: 0.34±0.02, 0.24±0.01, 0.19±0.02; IL-1β: 0.24±0.09, 0.09±0.01, 0.05±0.01; NF-κB: 1.76±0.30, 0.93±0.15, 0.37±0.02)和单纯培养组(TNF-α: 0.57±0.1, 0.39±0.02, 0.29±0.02; IL-1β: 0.34±0.02, 0.24±0.01, 0.19±0.02; NF-κB: 2.52±0.24, 1.21±0.14, 0.76±0.07)比较差异具有显著性(均P<0.05). HO-1 mRNA的表达较单纯培养组明显增强且随着时间的延长表达更明显(3.74±0.10, 4.33±0.29, 5.28±0.29 vs 2.46±0.30, 3.13±0.07, 3.59±0.22; 均P<0.05).
结论: 牛磺酸能抑制TNF-α、IL-1β和NF-κB转录并活化Akt, 抑制细胞凋亡.
引文著录: 张克忠, 刘永锋, 张佳林. 牛磺酸对大鼠胰岛活性和功能的保护作用. 世界华人消化杂志 2008; 16(13): 1388-1395
Revised: March 14, 2008
Accepted: May 2, 2008
Published online: May 8, 2008
AIM: To investigate the protective effect of taurine on the islets during culturing and its mechanism in rats.
METHODS: Wistar rats were divided into 2 groups: RPMI-1640 group and taurine group. The percentage of active Caspase-9-positive cells or phospho-Akt 473-positive cells was determined by flow cytometry. The mRNA levels of tumor necrosis factor (TNF-α), interleukin-1β (IL-1β), nuclear factor-κB (NF-κB), and heme oxygenase-1 (HO-1) were evaluated by reverse transcription-polymerase chain reaction (RT-PCR) in the isolated rat islets of both groups.
RESULTS: After 1-wk culture, the percentage of Caspase-9-positive cells was significantly higher in the taurine group than that in the RPMI-1640 group (41.03% ± 4.46% vs 23.85% ± 3.09%, P < 0.05). The mRNAs of TNF-α, IL-1β, NF-κB and HO-1 were significantly expressed after the islets were isolated and purified. However, the mRNAs of TNF-α, IL-1β, NF-κB expression were decreased gradually while HO-1 expression was increased with the culturing time. After 6-h, 72-h and 1-wk culture, the mRNA levels of TNF-α, IL-1β, and NF-κB were significantly lower in the taurine group (TNF-α: 0.34 ± 0.02, 0.24 ± 0.01, 0.19 ± 0.02; IL-1β: 0.24 ± 0.09, 0.09 ± 0.01, 0.05 ± 0.01; NF-κB: 1.76 ± 0.30, 0.93 ± 0.15, 0.37 ± 0.02) than those in the RPMI-1640 group (TNF-α: 0.57 ± 0.1, 0.39 ± 0.02, 0.29 ± 0.02; IL-1β: 0.34 ± 0.02, 0.24 ± 0.01, 0.19 ± 0.02; NF-κB: 2.52 ± 0.24, 1.21 ± 0.14, 0.76 ± 0.07) (all P < 0.05), but the HO-1 mRNA level was markedly higher in the taurine group (3.74 ± 0.10, 4.33 ± 0.29, 5.28 ± 0.29 vs 2.46±0.30, 3.13 ± 0.07, 3.59 ± 0.22; all P < 0.05).
CONCLUSION: Taurine can protect the islet cells from apoptosis by inhibiting the transcription of TNF-α, IL-1β and NF-κB gene or by increasing phospho-Akt activity.
- Citation: Zhang KZ, Liu YF, Zhang JL. Protective effects of taurine on the islet viability and function in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(13): 1388-1395
- URL: https://www.wjgnet.com/1009-3079/full/v16/i13/1388.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i13.1388
糖尿病是由于自身免疫反应所导致的胰岛β-细胞破坏所引起的一种自身免疫反应性疾病. 胰岛移植是治疗糖尿病的最有效手段之一, 但是胰岛移植的长期疗效较差, 胰岛移植后的凋亡率是正常胰腺内胰岛的10倍[1], 移植胰岛很快失功. 多种因素影响胰岛移植的效果: 胰岛的分离、纯化、培养、及胰岛的保存均影响胰岛活性和功能. 因此, 在胰岛的分离和培养过程中加入不同的保护因素以提高胰岛的活性和功能是我们的研究目标. 牛磺酸(taurine Tau)是一种含硫氨基酸, 即2-氨基乙磺酸H2N-CH2-CH2-SO3H(C2H7NO3S = 111.1343). 几乎全部以游离形式存在, 细胞内外浓度比为100-50 000/1, 属于β-氨基酸, 是一种细胞保护剂, 具有重要生物学作用: 清除氧自由基, 抗脂质过氧化损伤, 抑制细胞凋亡, 调节细胞钙稳态, 对线粒体结构和功能起稳定作用, 维持细胞内外渗透压平衡, 抑制细胞因子的产生[2-3]. 本实验通过RT-PCR检测胰岛分离纯化过程中及短期培养后促炎性细胞因子、核转录因子的表达以及对胰岛活性和功能的影响. 观察牛磺酸对促炎性细胞因子、核转录因子基因转录以及对体外培养胰岛的活性和功能的影响; 探讨其对胰岛的保护作用及机制.
Wistar大鼠60只, 雌雄不限, 体质量180-220 g(购自中国医科大学动物部). 胶原酶V型(C-9263)、双硫腙(Dithizone, DTZ)、丫啶橙(Acridine Orange, AO)和溴乙啶(Ethidium Bromide, EB)均购自Sigma公司; 藻红蛋白(PE)标记的抗大鼠胰岛Caspase-9抗体(Red-LEHD-FMK)购自BioVision公司, 异硫氰酸荧光素(FITC)标记的抗大鼠胰岛Akt磷酸化抗体Phospho-Akt(Ser473)及A-11070 Alexa Fluor goat anti-rabbit lgG(荧光标记的二抗)购自CST公司; 牛磺酸购自北京奥博星生物技术公司; RNA提取试剂RNAout、逆转录PCR试剂盒购于天择基因工程公司; 引物购于上海英俊生物技术公司; DNA marker购于大连宝生物公司.
将实验大鼠分为2组(n = 6), 1640组: 培养基为RPMI 1640+双抗(青霉素100 U/mL、链霉素100 mg/L)+100 mL/L FCS; Tau组: 培养基为RPMI 1640+双抗(青霉素100 U/mL、链霉素100 mg/L)+100 mL/L FCS+20 mmol/L牛磺酸;
1.2.1 大鼠胰岛的分离和纯化: (1)原位灌注: 胆总管起始处插管, 冷胶原酶溶液(冷Hank's液配制, 1.0 g/L)10-12 mL以3-4 mL/min的速度逆行注入胰管内. (2)切取: 快速完整切取胰腺保持外膜完整, 并尽量少带脂肪和淋巴组织. (3)胰腺消化和胰岛纯化: 胰腺切取后37.5℃±1℃水浴消化11-15 min. 通过肉眼观察, 消化液呈乳糜状外观不透明时迅速倒入冷的Hank's液50 mL以终止消化并且低温离心1次(800 r/min, 4℃-8℃, 2 min). 再加入冷的Hank's液30 mL充分振荡混匀, 经80目不锈钢筛网过滤, 再次离心(800 r/min, 4℃-8℃, 2 min). 去除沉淀以上的液体后采用Ficoll不连续密度梯度离心纯化胰岛. 浓度分别为: 270、250、230、205和110 g/L.
1.2.2 胰岛计数、活性鉴定、培养及功能检测: 将获取的胰岛用双硫腙(DTZ)染色. 胰岛细胞数 = 3次样品中DTZ阳性细胞团数/3×20×样本总量(mL). 用丫啶橙/溴乙啶(AO/EB)荧光染色法显示细胞活率, 活率 = 活细胞总数/(活细胞总数+死细胞总数)×100%. 胰岛分离纯化后分二组培养, 24孔培养板, 100 IEQ/每孔, 培养条件为: 37℃、50 mL/L CO2、950 mL/L空气. 1 d后首次换液, 为半量换液, 此后隔日换液. 计数20IEQ胰岛, 用含低浓度葡萄糖(2.8 mmol/L)的Kreb's-Hank's液孵育2 h, 然后用含有高浓度葡萄糖(16.7 mmol/L葡萄糖)的Kreb's-Hank's液孵育1 h, 收集第2小时和第3小时的培养液, 采用放免法检测培养液中胰岛素含量, 计算胰岛素释放指数(SI): SI = 第3小时(高糖环境)的胰岛素含量/第2小时(低糖环境)的胰岛素含量.
1.2.3 胰岛细胞TNF-α mRNA、IL-1β mRNA、NF-κB mRNA和HO-1 mRNA的检测: 根据天泽基因公司的动物RNAout提取试剂说明提取总RNA. RT-PCR法检测TNF-α、IL-1β、NF-κB和HO-1基因的表达: (1)引 物 设 计: 根 据GenBank中TNF-α、IL-1β、NF-κ和HO-1的基因序列用引物设计软premier5.0设计引物, 上海Invitrogen英俊生物技术有限公司合成primer, 200度: TNF-α: F-5'GTC GTA GCA AAC CAC CAA G-3', R-5'GGT ATG AAG TGG CAA ATC G-3'扩增产物长度214 bp; IL-1β: F-5'GGG ATG ATG ACG ACC TGC-3', R-5'GTC CCG ACC ATT GCT GTT-3'增产物长度452 bp; NF-κB: F-5'TGG ATG GAC AGG CGT TGA-3', R-5'AGA CAG GAC CTC TGA GAA AGT-3'扩增产物长度224 bp; HO-1: F-5'ACA GAA GAG GCT AAG ACC G-3', R-5'CAG GCA TCT CCT TCC ATT-3'扩增产物长度441 bp; β-actin: F-5'CAC CCT GTG CTG CTC ACC GAG GCC-3', R-5'CCA CAC AGA TGA CTT GCG CTC AGG-3'扩增产物长度690 bp; (2)RT(逆转录反应): 反应体系包括RNA, Dntp, RNA酶抑制剂, 随机引物. 反转录条件: 65℃, 10 min; 30℃, 5 min; 65℃, 30 min; 98℃, 5 min; 5℃, 5 min. (3)扩增TNF-α、IL-1β、NF-κB、HO-1和β-actin建立反应体系, β-actin反应条件为: 94℃预变性3 min, 然后按94℃变性30 s、55℃退火1 min、72℃延伸1 min 30 s进行35个循环, 最后72℃延伸7 min. TNF-α反应条件为: 94℃预变性3 min, 然后按94℃变性40 s、54.5℃退火1 min、72℃延伸1 min进行35个循环, 最后72℃延伸7 min. IL-1β和HO-1反应条件为: 94℃预变性3 min, 然后按94℃变性40 s、54℃退火1 min、72℃延伸1 min进行35个循环. NF-κB反应条件为: 94℃预变性3 min, 然后按94℃变性40 s、54℃退火1 min、72℃延伸1 min进行35个循环, 最后72℃延伸7 min. (4)PCR产物鉴定: 吸取PCR产物10 μL与2 μL上样缓冲液混匀后, 加入凝胶梳孔内, 行20 g/L琼脂糖凝胶电泳. 取 DNA maker同时电泳, 作为标准分子量参照. 凝胶放入G: Box(美国)成像分析系统进行分析. (5)数据处理: 凝胶分析系统测定各条带积分吸光度值. 以同一管中样品与β-actin产物条带积分吸光度值之比作数据分析, 以此反映样品的表达程度.
1.2.4 流式细胞仪检测: (1)胰蛋白酶(0.25% EDTA 0.02%)1 mL于37℃-37.5℃消化, 7 min左右, 使胰岛细胞单离; (2)Red-LEHD-FMK染色: 将胰岛用不同培养液稀释成150 mL加到EP管中, 每管中加入1 mL Red-LEHD-FMK, 孵箱中孵育1 h; 离心移去上清液(1200 r/min, 6 min); (3)Phospho-Akt(Ser473)Antibody染色: 细胞离心清洗后重新悬浮到0.5 mL PBS缓冲液, 加入40 g/L的无醇甲醛37℃固定10 min; 冰浴1 min; 加入100%甲醇(0℃-4℃)并轻轻震荡以致使细胞通透性增加; 将细胞重新悬浮到100 mL PBS缓冲液室温下孵育10 min; 加入Phospho-Akt(Ser473)Antibody(1:25稀释)室温下孵育1 h; 将细胞重新悬浮到100 uL PBS缓冲液(含5% FCS), 加入二抗Alexa Fluor488F2fragment of goat anti-rabbit lgG(1:1000稀释), 室温下孵育30 min; 将细胞重新悬浮到0.3 mL PBS缓冲液进行流式细胞仪检测.
统计学处理 数据以mean±SD表示, 采用SPSS11.5统计软件进行方差分析和t检验, P<0.05为有统计学差异.
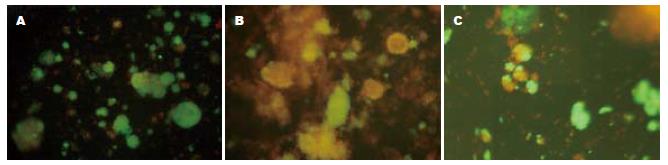
平均每只大鼠可获得约600-700 IEQ胰岛, 纯度在60%左右. 胰岛YO/EB荧光染色(图1A)结果显示刚分离后胰岛活率>95%. 培养1 wk后的胰岛YO/EB荧光染色, RPMI 1640培养基组的胰岛较加入牛磺酸组的胰岛凋亡明显增加(图1B-C). 胰岛素释放试验表明, 单纯用RPMI 1640培养基组的胰岛素释放指数(SI)为1.64±0.28(高糖刺激的胰岛素释放量/低糖刺激的胰岛素释放量), 在培养基中加入牛磺酸后胰岛素释放指数(SI)为2.45±0.24. 差异具有统计学意义(P<0.05).
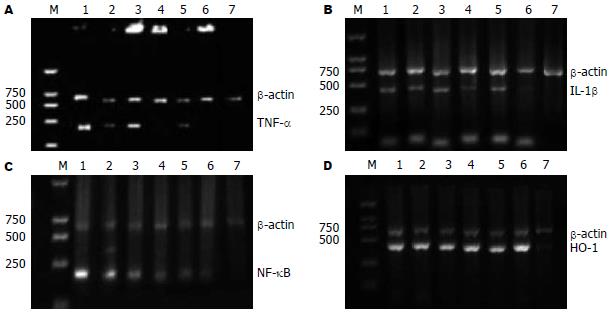
胰岛分离纯化后在体外经过短暂的孵育有明显的TNF-α mRNA、IL-1β mRNA表达, 但是随着培养时间的延长TNF-α逐渐减弱, 其各时间组的差异具有显著性(P<0.05); 加入牛磺酸后TNF-α mRNA、IL-1β mRNA相对表达量明显的降低, 随着培养时间的延长TNF-α mRNA、IL-1β mRNA逐渐减弱, 其各时间组的差异具有显著性(P<0.05); 在相同时限点比较两组的TNF-α mRNA、IL-1β mRNA相对表达量, 差异具有显著性(P<0.05, 表1, 图2A-B).
单纯RPMI 1640培养组的胰岛细胞在培养6 h、72 h、1 wk的NF-κB mRNA相对表达量分别为2.52±0.24、1.21±0.14、0.76±0.07, 随着培养时间的延长NF-κB逐渐减弱, 其各时间组的差异具有显著性(P<0.05); 在培养基中加入牛磺酸后各时间点的NF-κB mRNA相对表达量分别为1.76±0.30、0.93±0.15、0.37±0.02, 而且同样随着培养时间的延长NF-κB逐渐减弱, 其各时间组的差异具有显著性(P<0.05); 在相同时限点比较两组的NF-κB mRNA相对表达量, 差异具有显著性(P<0.05); 可见牛磺酸能抑制NF-κB mRNA的表达(表2, 图2C). HO-1是一种重要的细胞保护因子, 实验中我们检测单纯RPMI 1640培养组的胰岛细胞在培养6 h、72 h、1 wk的HO-1 mRNA相对表达量分别为2.46±0.30、3.13±0.07、3.59±0.22, 证明胰岛分离纯化后HO-1有明显表达并且随着培养时间的延长HO-1逐渐增强, 其各时间组的差异具有显著性P<0.05; 在培养基中加入牛磺酸后各时间点的HO-1 mRNA相对表达量分别为3.74±0.10、4.33±0.29、5.28±0.29, 而且同样随着培养时间的延长HO-1逐渐增强, 其各时间组的差异具有显著性(P<0.05); 在相同时限点比较两组的HO-1 mRNA相对表达量, 差异具有显著性(P<0.05); 可见牛磺酸能上调HO-1 mRNA的表达(表2, 图2D).
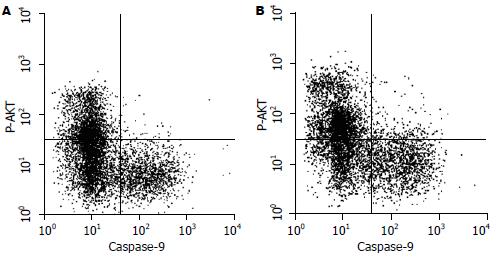
胰岛单纯用RPMI 1640培养1 wk后, 激活的Caspase-9为41.03%±4.46%, Caspase-9激活可以诱导细胞凋亡的级联放大反应导致细胞凋亡, 与此同时Akt磷酸化细胞占31.47%±4.08%, Akt磷酸化后能抑制procaspase-9激活或抑制细胞色素C释放抑制细胞凋亡; 加入牛磺酸后激活的Caspase-9为23.85%±3.09%, 较单纯培养组明显降低, 并且其差异具有统计学意义(P<0.05); 磷酸化Akt细胞占49.14%±6.73%, 较对照组明显的升高, 其差异具有统计学意义(P<0.05); 本实验结果证实了Akt磷酸化后能抑制procaspase-9激活, 保护细胞免受凋亡(图3).
胰岛移植是治疗糖尿病的最有效手段之一[4], 但是, 研究表明在同基因系的胰岛移植模型中接近60%的β-细胞经受凋亡, 其中一半发生在移植后3 d, 而且主要是非特异性炎症反应的结果[5-6]. 胰腺的保存、胰岛分离过程中诱导的应激、将胰岛暴露于促炎性细胞因子、免疫学及非免疫学炎症应答均促成了胰岛移植后早期阶段的胰岛移植物丧失[7]. 胰岛移植物制备过程中产生的促炎性细胞因子可以在体外导致胰岛凋亡从而影响胰岛的活性和功能, 并且在移植后早期细胞介导的和非细胞介导的排斥反应中扮演重要角色[8]. 导致移植胰岛细胞发生凋亡的一种重要的炎症介质是TNF-α[9], TNF-α是死亡受体TNFR1的相应配体, TNF-α同TNFR1相结合可以导致死亡受体(DR)多聚化或构象改变, 从而使Caspase-8被水解而活化诱导细胞凋亡(死亡受体途径). Caspase-8活化后还可以酶解Bid为tBid从而使后者转位至线粒体通过Bax/Bak促使细胞色素C释放入胞质, 并与凋亡蛋白酶激活因子1(Apaf-1)和Caspase-9、ATP在胞质内形成多蛋白复合物, 即凋亡体. 在凋亡体内Caspase-9的Caspase聚集域(CARD)与Apaf-1的CARD结合而活化, 继而激活效应Caspase, 最终导致细胞凋亡(线粒体途径). TNF-α也可以与肿瘤坏死因子受体相关因子-2(TRAF2)结合通过NF-κB诱导激酶(NIK)激活IκB激酶(IKK)磷酸化IκB使之降解从而活化NF-κB使其转位到核内导致一系列的基因转录事件. IL-1β是造成移植胰岛失功的另外一种重要的炎症介质. 主要由激活的巨噬细胞和中性粒细胞分泌, 胰岛β-细胞受到细胞因子的刺激后也能分泌促炎性细胞因子. IL-1β同胰岛细胞表面的受体IL-1βR相结合导致一系列的基因转录事件, 使IL-1β受体相关激酶(IRAK)[10]激活并由此激活TNF受体相关因子6(TRAF6)[11-12]. IRAK及TRAF6通过NIK激活IKK后磷酸化IκB使之从26S蛋白酶复合体上降解[13], 导致NF-κB从胞质易位到细胞核内. NF-κB捆绑到DNA调节多种基因的转录, 包括IL-1、IL-6、TNF-α, ICAM-1[14-15], VCAM-1, iNOS, PGE2和EP3 mRNA[16-17]. 可见在细胞因子网络调节系统中IL-1β、TNF-α同NF-κB互为因果, 即NF-kB活化能够提高TNF-α和IL-1β转录, 而这两种细胞因子反过来也能激活NF-κB从而形成一种恶性循环. 另外IL-1β同胰岛细胞表面的受体IL-1βR相结合激活NF-κB转位到细胞核内上调iNOS的基因转录从而诱导NO的合成增加. NO能通过抑制三羧酸循环中的顺乌头酸酶减少胰岛素的合成, 同时通过诱导DNA条状断裂导致细胞死亡或者导致细胞凋亡[18-19], 最终导致胰岛细胞凋亡使移植物失功. 我们在实验中发现, 胰岛分离纯化后经过短时间(6 h)的培养后存在明显的TNF-α mRNA、IL-1β mRNA表达, 在培养1 wk后Caspase-9阳性细胞率为41.03%±4.46%; 证实了胰岛分离纯化过程中的应激导致了TNF-α、IL-1β的释放并且启动细胞凋亡过程. 在培养基中加入牛磺酸后TNF-α mRNA、IL-1β mRNA表达明显减弱, Caspase-9阳性细胞率为23.85%±3.09%, 胰岛凋亡明显减少可见牛磺酸可抑制细胞调亡. Akt是已经证实的促使细胞生存的蛋白激酶, 多种因素均可导致其激活, TNF-α、IL-1β不仅可以促使NF-κB诱导凋亡还可以磷酸化Akt使之激活[20-21]. 活化的Akt能直接磷酸化procaspase-9的196位丝氨酸残基从而阻断其激活而抑制细胞凋亡[22]. 我们在实验中也证实胰岛分离纯化培养1 wk后Akt磷酸化胰岛细胞数为31.47%±4.08%, Caspase-9阳性细胞率为41.03%±4.46%, 加入牛磺酸后激活的Caspase-9为23.85%±3.09%, 较单纯培养组明显降低, 并且其差异具有统计学意义(P<0.05); 磷酸化Akt占49.14%±6.73%, 较对照组明显的升高, 其差异具有统计学意义(P<0.05); 本实验结果说明牛磺酸能促进Akt磷酸化、抑制procaspase-9激活, 通过阻断Caspase级联放大反应抑制胰岛细胞凋亡. 胰岛素释放试验表明, 在培养基中加入牛磺酸后胰岛素释放指数(SI)明显升高. 这说明胰岛在体外经长时间的培养后对高糖刺激的胰岛素分泌活性降低, 在培养过程中加入牛磺酸能保护葡萄糖刺激的胰岛细胞分泌功能. 为了观察牛磺酸对TNF-α mRNA、IL-1β mRNA和NF-κB mRNA转录的影响, 我们在Hank's液、RPMI 1640培养基中加入20 mmol/L的牛磺酸, 胰岛分离纯化经相同时间培养后检测胰岛TNF-α mRNA、IL-1β mRNA和NF-κB mRNA转录水平, 发现牛磺酸明显的下调促炎性细胞因子及核因子的基因转录. 其机制可能为牛磺酸进入细胞后阻止IκB-α降解, 从而阻止NF-κB从胞质向细胞核易位从而降低其活性, 减弱TNF-α、IL-1β mRNA和NF-κB的转录, 减少细胞因子的表达[23]. 牛磺酸在细胞因子网络事件中或者通过下调TNF-α mRNA、IL-1β mRNA的转录从而抑制NF-κB的核转位达到细胞保护功能, 或者通过下调NF-κB mRNA转录阻断促炎性细胞因子的合成和释放达到细胞保护功能, 也可能两者都存在, 这有待于进一步验证. 胰岛分离纯化过程的各种应激导致NF-κB、IL-1β和TNF-α的转录增加从而诱导胰岛易于发生凋亡并损伤胰岛的活性和功能. 牛磺酸作为一种保护性氨基酸能进入细胞通过阻断细胞因子网络的级联放大效应; 促使Akt磷酸化并在核内对NF-κB进行修饰促进抗凋亡基因的表达或者抑制Caspase级联放大反应抑制胰岛细胞凋亡保护胰岛的活性和功能.
胰岛在分离及培养过程中的各种应激还可以启动胰岛的内源性保护机制. 血红素加氧酶(HO)就是其中的一种应激反应蛋白[24-25]. 其中HO-1是可诱导性的属于热休克蛋白家族成员(HSP32), 是一种膜结合酶, 能催化亚铁血红素降解. 各种应激因素如亚铁血红素及各种应激如紫外线照射、氧化应激、内毒素、激素和重金属都能诱导HO-1的表达增加. HO-1能催化血红素降解为一氧化碳、铁和胆绿素, 一氧化碳通过诱导超氧化物歧化酶的释放抑制细胞凋亡; 自有铁能刺激铁蛋白的产生, 铁蛋白能螯合细胞内的自有铁从而阻止自由基的形成, 因此防止自由基对DNA、蛋白质和脂质的损伤; 胆红素属于强抗氧化剂能抑制不饱和脂肪酸的自氧化或过氧化自由基诱导的氧化损伤, 并且还能清除单线态氧能够阻止促炎症反应基因表达的信号转导通路中的一个确定成分活性氧族的产生从而抑制凋亡. 我们的实验表明胰岛在分离及培养过程中HO-1表达明显增加. 但为什么不能保护胰岛免受细胞因子所导致的细胞凋亡呢? 有一种解释是HO-1的表达明显迟于细胞因子的刺激时间, 当HO-1达到其保护剂量时细胞损伤已经不可逆. IL-1β刺激HO-1的表达是比较缓和的, HO-1的保护效应同IL-1β的损伤效应不相平衡. 另外胰岛暴露于细胞因子的刺激下能表达NO和前列腺素E2(PG-E2)[26-29], 此二者能抑制HO-1的活性. 因此, 受损的HO-1不能保护胰岛免受细胞因子引起的细胞毒性. 我们的实验结果与此相符合, 胰岛在培养7 d后其细胞凋亡率非常高, 而且影响到葡萄糖刺激的胰岛素释放功能. 如果在培养基中加入牛磺酸则可以看到HO-1 mRNA的表达比单纯培养的胰岛明显的上调, 培养胰岛凋亡率明显减低, 胰岛的分泌功能及葡萄糖刺激的胰岛素分泌功能优于对照组. 并且随着培养时间的延长HO-1 mRNA仍然在高水平表达. 表明牛磺酸能使HO-1在短时间内高强度表达, 从而实现细胞保护效应.
分离纯化后的胰岛的数量和质量是决定胰岛移植成功的关键, 胰岛在分离和纯化过程中的丢失影响了胰岛获得的数量, 我们改进了胰岛纯化过程中的Ficoll密度梯度离心方法, 分为5层密度梯度: 分别为27%、25%、23%、20.5%和11%, 保证胰岛获取的数量600-700 IEQ/只大鼠. 另外, 有活性、功能完整的胰岛是关键, 胰岛分离纯化过程中促炎性细胞因子的释放不仅影响胰岛的质量而且通过促使胰岛凋亡影响其数量; 实验证明牛磺酸确实能抑制促炎性细胞因子的释放发挥其细胞保护功能, 在胰岛移植前的胰岛培养阶段保护胰岛的活性和功能, 为临床提高移植胰岛的活性和功能奠定实验基础.
糖尿病是一种自身免疫反应性疾病. 胰岛移植是治疗糖尿病的最有效手段之一, 但是胰岛移植的长期疗效较差, 胰岛移植后的凋亡率是正常胰腺内胰岛的10倍, 移植胰岛很快失功. 国内外研究资料表明胰岛的分离、纯化、培养、及胰岛的保存均影响胰岛活性和功能.
傅志仁, 主任医师, 上海长征医院器官移植科
牛磺酸具有清除氧自由基, 抑制细胞凋亡, 调节细胞钙稳态, 维持细胞内外渗透压平衡, 抑制细胞因子的产生等药理学作用, 在移植领域的应用正日益受到人们的关注.
研究表明, 在大器官移植领域, 牛磺酸能抑制移植术后的缺血再灌注损伤和细胞因子的释放.
本研究首次证明了在细胞分离液和培养液中加入牛磺酸后能明显抑制NF-κB、TNF-α及IL-1β的表达, 增加HO-1的表达减轻胰岛凋亡, 保护胰岛的活性和功能.
牛磺酸作为药物的单体成分, 其化学结构、药代动力学、药效学及药理作用机制明确, 副作用很小,目前已用于临床.
本文对提高胰岛细胞的活性和临床胰岛细胞移植有一定的参考价值, 但有关方法可以再简洁些.
编辑: 李军亮 电编:郭海丽
| 1. | Biarnes M, Montolio M, Nacher V, Raurell M, Soler J, Montanya E. Beta-cell death and mass in syngeneically transplanted islets exposed to short- and long-term hyperglycemia. Diabetes. 2002;51:66-72. [PubMed] [DOI] |
| 2. | Takatani T, Takahashi K, Uozumi Y, Matsuda T, Ito T, Schaffer SW, Fujio Y, Azuma J. Taurine prevents the ischemia-induced apoptosis in cultured neonatal rat cardiomyocytes through Akt/caspase-9 pathway. Biochem Biophys Res Commun. 2004;316:484-489. [PubMed] [DOI] |
| 3. | Ahn BO, Kim KH, Lee G, Lee HS, Kim CD, Kim YS, Son MW, Kim WB, Oh TY, Hyun JH. Effects of taurine on cerulein-induced acute pancreatitis in the rat. Pharmacology. 2001;63:1-7. [PubMed] [DOI] |
| 4. | Serup J. Efficacy testing of cosmetic products. A proposal to the European Community by the Danish Environmental Protection Agency, Ministry of Environment and Energy. Skin Res Technol. 2001;7:141-151. [PubMed] [DOI] |
| 5. | Bailes BK. Diabetes mellitus and its chronic complications. AORN J. 2002;76:266-276, 278-282; quiz 283-286". [PubMed] |
| 6. | Bloomgarden ZT. Inpatient diabetes control: approaches to treatment. Diabetes Care. 2004;27:2272-2277. [PubMed] [DOI] |
| 7. | Rother KI, Harlan DM. Challenges facing islet transplantation for the treatment of type 1 diabetes mellitus. J Clin Invest. 2004;114:877-883. [PubMed] |
| 8. | Ehrnfelt C, Kumagai-Braesch M, Uzunel M, Holgersson J. Adult porcine islets produce MCP-1 and recruit human monocytes in vitro. Xenotransplantation. 2004;11:184-194. [PubMed] [DOI] |
| 9. | Thomas HE, Darwiche R, Corbett JA, Kay TW. Interleukin-1 plus gamma-interferon-induced pancreatic beta-cell dysfunction is mediated by beta-cell nitric oxide production. Diabetes. 2002;51:311-316. [PubMed] [DOI] |
| 10. | Kutlu B, Darville MI, Cardozo AK, Eizirik DL. Molecular regulation of monocyte chemoattractant protein-1 expression in pancreatic beta-cells. Diabetes. 2003;52:348-355. [PubMed] [DOI] |
| 11. | Eder J. Tumour necrosis factor alpha and interleukin 1 signalling do MAPKK kinases connect it all? Trends Pharmacol Sci. 1997;18:319-322. [PubMed] |
| 12. | Cao Z, Xiong J, Takeuchi M, Kurama T, Goeddel DV. TRAF6 is a signal transducer for interleukin-1. Nature. 1996;383:443-446. [PubMed] [DOI] |
| 13. | Kwon G, Corbett JA, Hauser S, Hill JR, Turk J, McDaniel ML. Evidence for involvement of the proteasome complex (26S) and NFkappaB in IL-1beta-induced nitric oxide and prostaglandin production by rat islets and RINm5F cells. Diabetes. 1998;47:583-591. [PubMed] [DOI] |
| 14. | Thomas HE, Darwiche R, Corbett JA, Kay TW. Interleukin-1 plus gamma-interferon-induced pancreatic beta-cell dysfunction is mediated by beta-cell nitric oxide production. Diabetes. 2002;51:311-316. [PubMed] [DOI] |
| 15. | Kuttler B, Hartmann A, Wanka H. Long-term culture of islets abrogates cytokine-induced or lymphocyte-induced increase of antigen expression on beta cells. Transplantation. 2002;74:440-445. [PubMed] [DOI] |
| 16. | Tran PO, Gleason CE, Poitout V, Robertson RP. Prostaglandin E(2) mediates inhibition of insulin secretion by interleukin-1beta. J Biol Chem. 1999;274:31245-31248. [PubMed] [DOI] |
| 17. | Tran PO, Gleason CE, Robertson RP. Inhibition of interleukin-1beta-induced COX-2 and EP3 gene expression by sodium salicylate enhances pancreatic islet beta-cell function. Diabetes. 2002;51:1772-1778. [PubMed] [DOI] |
| 18. | Wachlin G, Augstein P, Schroder D, Kuttler B, Kloting I, Heinke P, Schmidt S. IL-1beta, IFN-gamma and TNF-alpha increase vulnerability of pancreatic beta cells to autoimmune destruction. J Autoimmun. 2003;20:303-312. [PubMed] [DOI] |
| 19. | Sun Z, Andersson R. NF-kappaB activation and inhibition: a review. Shock. 2002;18:99-106. [PubMed] [DOI] |
| 20. | Datta SR, Brunet A, Greenberg ME. Cellular survival: a play in three Akts. Genes Dev. 1999;13:2905-2927. [PubMed] [DOI] |
| 21. | Aggarwal S, Ichikawa H, Takada Y, Sandur SK, Shishodia S, Aggarwal BB. Curcumin (diferuloylmethane) down-regulates expression of cell proliferation and antiapoptotic and metastatic gene products through suppression of IkappaBalpha kinase and Akt activation. Mol Pharmacol. 2006;69:195-206. [PubMed] |
| 22. | Kim D, Chung J. Akt: versatile mediator of cell survival and beyond. J Biochem Mol Biol. 2002;35:106-115. [PubMed] |
| 23. | Gurujeyalakshmi G, Wang Y, Giri SN. Taurine and niacin block lung injury and fibrosis by down-regulating bleomycin-induced activation of transcription nuclear factor-kappaB in mice. J Pharmacol Exp Ther. 2000;293:82-90. [PubMed] |
| 24. | Ye J, Laychock SG. A protective role for heme oxygenase expression in pancreatic islets exposed to interleukin-1beta. Endocrinology. 1998;139:4155-4163. [PubMed] [DOI] |
| 25. | Pileggi A, Molano RD, Berney T, Cattan P, Vizzardelli C, Oliver R, Fraker C, Ricordi C, Pastori RL, Bach FH. Heme oxygenase-1 induction in islet cells results in protection from apoptosis and improved in vivo function after transplantation. Diabetes. 2001;50:1983-1991. [PubMed] [DOI] |
| 26. | Midwinter RG, Cheah FC, Moskovitz J, Vissers MC, Winterbourn CC. IkappaB is a sensitive target for oxidation by cell-permeable chloramines: inhibition of NF-kappaB activity by glycine chloramine through methionine oxidation. Biochem J. 2006;396:71-78. [PubMed] [DOI] |
| 27. | Kanayama A, Inoue J, Sugita-Konishi Y, Shimizu M, Miyamoto Y. Oxidation of Ikappa Balpha at methionine 45 is one cause of taurine chloramine-induced inhibition of NF-kappa B activation. J Biol Chem. 2002;277:24049-24056. [PubMed] [DOI] |
| 28. | Madrid LV, Mayo MW, Reuther JY, Baldwin AS Jr. Akt stimulates the transactivation potential of the RelA/p65 Subunit of NF-kappa B through utilization of the Ikappa B kinase and activation of the mitogen-activated protein kinase p38. J Biol Chem. 2001;276:18934-18940. [PubMed] [DOI] |
| 29. | Hatano E, Brenner DA. Akt protects mouse hepatocytes from TNF-alpha- and Fas-mediated apoptosis through NK-kappa B activation. Am J Physiol Gastrointest Liver Physiol. 2001;281:G1357-G1368. [PubMed] |