修回日期: 2008-03-25
接受日期: 2008-05-02
在线出版日期: 2008-05-08
目的: 观察姜黄素对酒精性肝病大鼠肝脏氧化应激指标SOD, MDA和NO及血清ALT, AST和ALP水平的影响, 探讨姜黄素对酒精诱导的大鼠脂质过氧化反应的影响.
方法: 将40只SD大鼠随机分为对照组、模型组、姜黄素治疗Ⅰ组(40 mg/kg)、姜黄素治疗Ⅱ组(80 mg/kg)和姜黄素治疗Ⅲ组(160 mg/kg), 每组8只. 除对照组用等量生理盐水灌胃外, 其他组均采用56度白酒6.72 g/(kg•d)灌胃的方法制作酒精性肝病大鼠模型, 6 wk后姜黄素治疗Ⅰ、Ⅱ、Ⅲ组分别加用姜黄素ig, 至12 wk末, 处死大鼠, 抽取血标本测定血清ALT、AST及ALP水平; 留取肝组织标本测定SOD活性、MDA及NO含量, 常规HE染色观察肝脏病理变化.
结果: 与对照组相比, 模型组大鼠血清ALT、AST及ALP水平显著升高(86.4±7.5 vs 33.5±10.3; 201.0±16.8 vs 116.5±12.0; 205.1±20.0 vs 104.6±9.4; 均P<0.01); 肝组织SOD活性明显下降(80.21±4.55 vs 180.24±27.53, P<0.01), MDA及NO含量显著升高(3.29±0.34 vs 1.35±0.12; 4.37±0.21 vs 2.72±0.13; 均P<0.01). 与模型组相比, 各姜黄素治疗组血清ALT、AST及ALP水平(Ⅰ组: 66.5±9.6, 171.4±10.8, 176.4±13.7; Ⅱ组: 52.4±12.0, 145.8±11.9, 146.9±13.8; Ⅲ组: 40.9±7.9, 135.0±11.8, 127.1±12.6)明显降低(P<0.05或P<0.01), 肝组织MDA及NO含量(Ⅰ组: 2.84±0.27, 4.01±0.17; Ⅱ组: 1.95±0.23, 3.60±0.16; Ⅲ组: 1.65±0.08, 3.22±0.13)均显著降低(P<0.05或P<0.01), 而SOD活性(92.36±6.47, 117.69±21.96, 146.70±27.36)明显提高(P<0.05或P<0.01), 其中以Ⅱ、Ⅲ治疗组较为显著. 模型组大鼠肝细胞出现不同程度的脂肪变性, 伴有点、灶状坏死, 炎性细胞浸润, 各姜黄素治疗组肝脏病理变化不同程度的轻于模型组.
结论: 姜黄素能抑制脂质过氧化, 减轻或防治酒精诱导的肝损伤.
引文著录: 尹蓉, 王沁, 富翠芹. 姜黄素对酒精诱导的大鼠脂质过氧化反应的影响. 世界华人消化杂志 2008; 16(13): 1383-1387
Revised: March 25, 2008
Accepted: May 2, 2008
Published online: May 8, 2008
AIM: To reproduce an experimental rat model of alcoholic liver disease, and to investigate the effect of curcumin on lipid peroxidation induced by alcohol in rats.
METHODS: Forty Sprague-Dawley rats were randomly divided into 5 groups (n = 8): control group, model group, and three curcumin treatment (40, 80, 160 mg/kg) groups. Rats in the control group were intragastrically infused with normal saline, and those in the other groups were intragastrically infused with 560 mL/L alcohol (6.72 g/kg per day). After 6 wk, curcumin was added to rats in the curcumin treatment groups at 40, 80, and 160 mg/kg, respectively. At the end of the 12th wk, all of the rats were killed. The levels of serum alanine aminotransferase (ALT), aspartate aminotransferase (AST) and alkaline phosphatase (ALP) were measured. Liver samples were collected for determination of superoxide dismutase (SOD), malondialdehyde (MDA) and nitric oxide (NO) contents and routine histological examination.
RESULTS: In comparison with those in the control group, the serum ALT, AST and ALP levels (86.4 ± 7.5 vs 33.5 ± 10.3; 201.0 ± 16.8 vs 116.5 ± 12.0; 205.1 ± 20.0 vs 104.6 ± 9.4; all P < 0.01) and the tissue contents of MDA and NO (3.29 ± 0.34 vs 1.35 ± 0.12; 4.37 ± 0.21 vs 2.72 ± 0.13; both P < 0.05) were significantly increased in the model group, but SOD activity was markedly decreased (80.21 ± 4.55 vs 180.24 ± 27.53, P < 0.01). However, curcumin markedly down-regulated the levels of serum ALT, AST and ALP (40 mg/kg: 66.5 ± 9.6, 171.4 ± 10.8, 176.4 ± 13.7; 80 mg/kg: 52.4 ± 12.0, 145.8 ± 11.9, 146.9 ± 13.8; 160 mg/kg: 40.9 ± 7.9, 135.0 ± 11.8, 127.1 ± 12.6; P < 0.05 or P < 0.01), as well as the tissue contents of MDA and NO (40 mg/kg: 2.84 ± 0.27, 4.01 ± 0.17; 80 mg/kg: 1.95 ± 0.23, 3.60 ± 0.16; 160 mg/kg: 1.65 ± 0.08, 3.22 ± 0.13; P < 0.05 or P < 0.01). Inversely, the activity of SOD was elevated (92.36 ± 6.47, 117.69 ± 21.96, 146.70 ± 27.36; P < 0.05 or P < 0.01). Histological examination showed fatty degeneration, focal necrosis and inflammatory cell infiltration in the model group, but the changes were milder in the curcumin treatment groups at variable degrees.
CONCLUSION: Curcumin can prevent alcohol-induced liver injury in rats by inhibiting lipid peroxidation.
- Citation: Yin R, Wang Q, Fu CQ. Effect of curcumin on alcohol-induced lipid peroxidation in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(13): 1383-1387
- URL: https://www.wjgnet.com/1009-3079/full/v16/i13/1383.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i13.1383
姜黄素(curcumin)是从天然姜黄属植物根茎中提取出来的一种酚类色素, 除广泛应用于食品上色和佐味外, 姜黄素尚具有多种药理作用, 如抗肿瘤、降脂和抗微生物等作用, 尤其在抗氧化、清除自由基、抗炎和保护肝脏等方面效果显著[1-2]. 本研究通过酒精灌胃法建立慢性酒精性肝病大鼠模型, 观察姜黄素对酒精性肝病(alcoholic liver disease, ALD)大鼠肝组织超氧化物歧化酶(superoxide dismutase, SOD)活性、丙二醛(malondialdehyde, MDA)和一氧化氮(NO)含量, 血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬酸氨基转移酶(aspartate aminotransferase, AST)和碱性磷酸酶(alkaline phosphatase, ALP)水平的影响, 以探讨姜黄素的抗氧化作用及对酒精诱导的肝损伤的防治作用及可能的机制.
SPF级SD大鼠40只, 体质量180-220 g, 雌雄各半, 甘肃省中医学院SPF级动物实验室饲育. 市售56度二锅头白酒, 姜黄素(四川金郁金科技开发有限公司, 含量95.3%). SOD, MDA, NO试剂盒均购自南京建成生物制品公司, SOD活性用黄嘌呤氧化酶法测定, MDA含量用硫代巴比妥酸比色法测定, NO含量用硝酸还原酶法测定. UV-2401PC紫外分光光度计, 低温高速离心机, Beckman-LX-20全自动生化分析仪.
40只SD大鼠按体质量、性别相近原则随机分为5组(n = 8): 对照组、模型组、姜黄素治疗Ⅰ组(40 mg/kg)、姜黄素治疗Ⅱ组(80 mg/kg)和姜黄素治疗Ⅲ组(160 mg/kg). 喂养适应1 wk后, 除对照组以等量生理盐水ig外, 其余4组参照李舒丹 et al[3]的造模方法, 以56度白酒约1.5 mL/100 g体质量(折合成乙醇为6.72 g/kg体质量)每日清晨ig 1次. 6 wk后, 各姜黄素治疗组在继续酒精ig的基础上, 分别将姜黄素40、80、160 mg/kg加入酒中ig. 各组大鼠在实验期间均予以饮用水及全价营养颗粒喂养. 12 wk末, 所有大鼠在末次ig 24 h后, 以30 g/L戊巴比妥麻醉, 股动脉采血并处死. 血标本离心分装血清, Beckman-LX-20全自动生化分析仪测定ALT, AST和ALP水平; 留取肝组织, 部分制成100 g/L肝匀浆, 测定SOD, MDA和NO, 具体步骤按试剂盒说明操作; 部分肝组织40 g/L甲醛固定, 石蜡包埋、切片, 常规HE染色并观察.
统计学处理 采用SPSS11.5统计软件进行One-way ANOVA分析, 组间比较用Tukey法, 结果用mean±SD表示.
实验期间, 对照组大鼠全部存活, 其余4组共有6只死亡, 3只因酒精误灌入气管立即死亡, 2只尸解发现胃扩张穿孔, 1只死因不明. 各实验组大鼠较对照组, 出现不同程度毛色无光泽, 易掉毛, 食欲减退, 体质量下降, 稀便等, 尤以模型组明显.
模型组大鼠ALT, AST及ALP水平较对照组明显升高(P<0.01); 各姜黄素治疗组与模型组相比, 均有明显下降(P<0.05或P<0.01), 并呈剂量-效应关系(表1). 与对照组相比, 模型组MDA、NO含量显著升高, 而SOD活性明显下降(P<0.01); 各姜黄素治疗组与模型组相比, 可以不同程度地抑制MDA和NO水平, 提高SOD活性(P<0.05或P<0.01), 并呈剂量-效应关系(表1).
| 分组 | n(U/L) | ALT(U/L) | AST(U/L) | ALP(U/mgprot) | SOD(nmol/mgprot) | MDA(μmol/gprot) | NO |
| 对照组 | 8 | 33.5±10.3 | 116.5±12.0 | 104.6±9.4 | 180.24±27.53 | 1.35±0.12 | 2.72±0.13 |
| 模型组 | 6 | 86.4±7.5a | 201.0±16.8a | 205.1±20.0a | 80.21±4.55a | 3.29±0.34a | 4.37±0.21a |
| 姜黄素治疗Ⅰ组 | 6 | 66.5±9.6c | 171.4±10.8c | 176.4±13.7b | 92.36±6.47 | 2.84±0.27b | 4.01±0.17c |
| 姜黄素治疗Ⅱ组 | 6 | 52.4±12.0c | 145.8±11.9c | 146.9±13.8c | 117.69±21.96b | 1.95±0.23c | 3.60±0.16c |
| 姜黄素治疗Ⅲ组 | 8 | 40.9±7.9c | 135.0±11.8c | 127.1±12.6c | 146.70±27.36c | 1.65±0.08c | 3.22±0.13c |
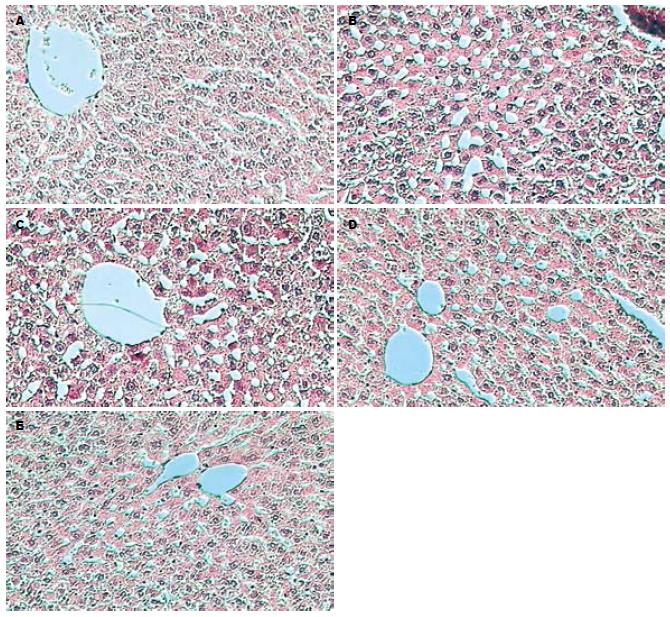
对照组可见正常的肝细胞以中央静脉为中心呈放射状排列: 模型组大鼠肝小叶结构紊乱, 肝细胞出现大、小泡性脂肪变, 以大泡性为主, 病变主要见于中央静脉区及肝包膜下, 伴有点、灶状坏死, 炎性细胞浸润; 各姜黄素治疗组大鼠肝组织脂肪变性、坏死及炎性改变较之模型组不同程度减轻(图1).
ALD的发病机制, 有人提出以氧应激和脂质过氧化为中心的"二次打击"假说[4-5]. 酒精可使细胞色素P4502E1(cytochrome P450 2E1, CYP2E1)活性增强, 在肝脏乙醇代谢中产生大量的氧自由基(ROS), 引发脂质过氧化反应, 导致微粒体和肝细胞损伤[6]. 而肝脏抗氧化剂, 如SOD、谷胱甘肽、维生素E等含量下降[7]. 脂质过氧化物使脂肪酸氧化受阻, 甘油三酯在体内合成增加并堆积, 而脂质沉积增多又能加重脂质过氧化反应, 形成恶性循环, 从而发生脂肪肝. MDA是最主要的脂质过氧化产物之一, 因而测试MDA的量可反映体内脂质过氧化的程度, 间接反映体内自由基的生成情况. SOD对机体的氧化和抗氧化平衡起着至关重要的作用, 他能清除自由基和过氧化物, 从而降低脂质过氧化物的生成并加速其清除, 减少其对细胞和组织的损伤. 本研究结果显示, 模型组大鼠SOD活性较之对照组明显下降(P<0.01), MDA含量明显增加(P<0.01), 提示肝组织中氧化应激明显, 促进肝脂肪变性的发生.
乙醇可使诱导型一氧化氮合酶(iNOS)活性增加, 催化生成过多的NO, 破坏了NO与超氧阴离子(O2-)间的平衡, 生成过量的过氧化亚硝离子(ONOO-). ONOO-及其毒性产物可通过氧化细胞膜上的多不饱和脂肪酸及胆固醇、氧化蛋白质如SOD及GSH等多种途径增强肝脏中的氧化应激水平. 另外, NO本身可抑制肝蛋氨酸腺苷转移酶活性, 引起GSH合成障碍, 还可降低谷胱甘肽过氧化物酶等抗氧化物酶活性, 导致脂质过氧化物积聚[8]. NO也可通过抑制蛋白质的合成及线粒体呼吸[9]使ALD加重. 本研究结果显示, 模型组大鼠NO含量较之对照组显著增加(P<0.01), 提示NO通过参与氧化应激在ALD的发生发展中发挥重要作用.
姜黄素具有较强的抗氧化、清除自由基作用, 既可以抑制ROS的产生[10], 又能清除氧化过程中产生的O2-, 过氧化氢(H2O2), NO等多种自由基.本研究结果表明, 与模型组相比, 各姜黄素治疗组均可降低血清ALT, AST, ALP水平, 提高SOD活性, 抑制MDA和NO的产生, 减轻脂质过氧化程度, 作用以Ⅱ、Ⅲ治疗组较为显著. 一些研究显示, 姜黄素可通过抑制CYP450的活性[11]; 减少iNOS mRNA的产生[12], 促进NO的清除而降低NO水平[13]; 抑制黄嘌呤氧化反应[10], 从而减少ROS和自由基的产生. 还能增加各种抗氧化酶, 如SOD、过氧化氢酶、谷胱甘肽还原酶等的活性, 有效地清除各种自由基[14]. 上述作用可使肝组织中ROS和自由基生成减少, 肝脏抗氧化能力增强, 氧应激减轻, 从而起到保护肝细胞的作用. 此外, 姜黄素可以改善脂肪酸代谢[15], 减少脂肪在肝脏的沉积, 本研究结果显示各姜黄素治疗组大鼠肝脂肪变性较之模型组不同程度减轻, 与文献相符. 另有报道, 姜黄素也可通过抑制核因子-κB(NF-κB)的激活及其介导的细胞因子的释放[16], 抑制胶原合成和肝星状细胞活化[17]等作用, 从而减轻肝脏炎症和纤维化的发展. 一项Ⅰ期临床证明, 姜黄素能安全po 4 mo而无副作用[18]. 因此, 基于姜黄素的多种药理作用, 其有可能成为一种理想的防治ALD的药物, 具有较好的临床应用前景.
长期过量饮酒可引起酒精性肝病, 包括肝脂肪变及炎症损伤, 严重者可发展为肝硬化. 在西方国家, 酒精性肝病是慢性肝病的主要类型, 近年来, 中国也有发病逐渐增加的趋势. 其病因复杂, 机制未明. 因此, 对酒精性肝病的发病机制及治疗靶点的研究势在必行.
范小玲, 主任医师, 北京地坛医院综合科
Nanji et al发现姜黄素也可通过抑制核因子-κB(NF-κB)的激活及其介导的细胞因子的释放; Kang et al提出通过抑制胶原合成和肝星状细胞活化等作用, 从而减轻肝脏炎症和纤维化的发展.
本研究选用安全易得的植物提取物姜黄素作为干预药物, 基于其较强的抗氧化、抗炎特性, 研究其对肝细胞结构及功能的影响, 探讨ALD的早期防治.
本研究为姜黄素应用于ALD的早期防治, 提供了一定的理论依据, 具有较好的临床应用前景.
本研究内容新颖, 设计较合理, 方法可靠, 对指导姜黄素的临床应用具有一定的意义.
编辑: 李军亮 电编:何基才
| 4. | Nanji AA, Khwaja S, Tahan SR, Sadrzadeh SM. Plasma levels of a novel noncyclooxygenase-derived prostanoid (8-isoprostane) correlate with severity of liver injury in experimental alcoholic liver disease. J Pharmacol Exp Ther. 1994;269:1280-1285. [PubMed] |
| 5. | Savas MC, Koruk M, Pirim I, Yilmaz O, Karakok M, Taysi S, Yilmaz A. Serum ubiquitin levels in patients with nonalcoholic steatohepatitis. Hepatogastroenterology. 2003;50:738-741. [PubMed] |
| 6. | Lieber CS. New concepts of the pathogenesis of alcoholic liver disease lead to novel treatments. Curr Gastroenterol Rep. 2004;6:60-65. [PubMed] [DOI] |
| 7. | 戴 宁, 曾 民德, 李 继强, 范 竹萍, 茅 益民, 彭 延申, 邱 德凯. 非酒精性脂肪肝肝细胞色素P450ⅡE1的表达与氧化抗氧化的关系. 中华肝脏病杂志. 1999;7:104-106. |
| 8. | 田 丽艳, 范 建高. 一氧化氮与酒精性肝病. 国外医学•消化系疾病分册. 2003;23:291-293. |
| 9. | Giulivi C. Functional implications of nitric oxide produced by mitochondria in mitochondrial metabolism. Biochem J. 1998;332:673-679. [PubMed] |
| 10. | Reddy AC, Lokesh BR. Studies on the inhibitory effects of curcumin and eugenol on the formation of reactive oxygen species and the oxidation of ferrous iron. Mol Cell Biochem. 1994;137:1-8. [PubMed] [DOI] |
| 11. | Thapliyal R, Maru GB. Inhibition of cytochrome P450 isozymes by curcumins in vitro and in vivo. Food Chem Toxicol. 2001;39:541-547. [PubMed] [DOI] |
| 12. | Chan MM, Huang HI, Fenton MR, Fong D. In vivo inhibition of nitric oxide synthase gene expression by curcumin, a cancer preventive natural product with anti-inflammatory properties. Biochem Pharmacol. 1998;55:1955-1962. [PubMed] [DOI] |
| 13. | Sreejayan , Rao MN. Nitric oxide scavenging by curcuminoids. J Pharm Pharmacol. 1997;49:105-107. [PubMed] |
| 14. | Okada K, Wangpoengtrakul C, Tanaka T, Toyokuni S, Uchida K, Osawa T. Curcumin and especially tetrahydrocurcumin ameliorate oxidative stress-induced renal injury in mice. J Nutr. 2001;131:2090-2095. [PubMed] |
| 15. | Asai A, Miyazawa T. Dietary curcuminoids prevent high-fat diet-induced lipid accumulation in rat liver and epididymal adipose tissue. J Nutr. 2001;131:2932-2935. [PubMed] |
| 16. | Nanji AA, Jokelainen K, Tipoe GL, Rahemtulla A, Thomas P, Dannenberg AJ. Curcumin prevents alcohol-induced liver disease in rats by inhibiting the expression of NF-kappa B-dependent genes. Am J Physiol Gastrointest Liver Physiol. 2003;284:G321-G327. [PubMed] |
| 17. | Kang HC, Nan JX, Park PH, Kim JY, Lee SH, Woo SW, Zhao YZ, Park EJ, Sohn DH. Curcumin inhibits collagen synthesis and hepatic stellate cell activation in-vivo and in-vitro. J Pharm Pharmacol. 2002;54:119-126. [PubMed] [DOI] |
| 18. | Sharma RA, Euden SA, Platton SL, Cooke DN, Shafayat A, Hewitt HR, Marczylo TH, Morgan B, Hemingway D, Plummer SM. Phase I clinical trial of oral curcumin: biomarkers of systemic activity and compliance. Clin Cancer Res. 2004;10:6847-6854. [PubMed] [DOI] |