修回日期: 2008-03-08
接受日期: 2008-05-02
在线出版日期: 2008-05-08
目的: 自肝细胞cDNA文库中筛选与HBV主蛋白(SHBs)相互作用的蛋白基因, 探讨主蛋白的生物学功能.
方法: 利用PCR扩增S主蛋白基因, 定向克隆技术将靶基因克隆到pDEST32构建出S主蛋白的诱饵质粒; Western blot方法验证转化诱饵质粒的酵母细胞表达SHBs; 将诱饵质粒与人肝cDNA文库猎物质粒共同转化MaV203酵母细胞, 在营养缺陷型培养基和X-gal上进行三重筛选阳性菌落, 提取阳性酵母菌落的猎物质粒进行DNA测序; 利用核苷酸数据库及生物信息学技术, 对于筛选结果进行分析.
结果: 构建S主蛋白及肝文库酵母细胞表达载体, 进行酵母双杂交系统筛选人肝细胞cDNA文库, 筛选出既能在缺陷培养基也能在X-gal的检测下变成蓝色的真阳性菌落3个, 分别为核糖体蛋白L3、微管蛋白α-1a和α-2巨球蛋白.
结论: 用酵母双杂交技术筛选出3个与SHBs相互作用的肝细胞结合蛋白编码基因, 提示SHBs可能参与到肝细胞内部的多种生物学反应.
引文著录: 周飞, 任建林, 卢雅丕, 陈美娅, 陈建民, 刘明, 施华秀, 张波, 董菁. 酵母双杂交法对HBV表面抗原主蛋白候选结合蛋白的筛选. 世界华人消化杂志 2008; 16(13): 1378-1382
Revised: March 8, 2008
Accepted: May 2, 2008
Published online: May 8, 2008
AIM: To screen candidate hepatocyte binding proteins interacting with the surface antigen protein (SHBs) of hepatitis B virus.
METHODS: Polymerase chain reaction (PCR) was used to amplify SHBs gene. The target gene of SHBs was cloned into the yeast expression plasmid pDEST32 to construct bait plasmid pDEST32-SHBs. Western blot was employed to test SHBs expression after pDEST32-SHBs was transformed into the yeast cell MaV203 by Liac-mediated method. Both pDEST32-SHBs and pDEST22-cDNA were contemporarily transformed into MaV203 cells to screen the binding protein of SHBs. MaV203 cells were plated on synthetic dropout nutrient media (SC/-Trp-Leu-His-Ura) and X-gal containing media for selection and screening. After that, the prey plasmids from true positive colonies were extracted and sequenced. The partial cDNA sequences in prey plasmids were analyzed by bioinformatics software.
RESULTS: The yeast expression vector pDEST32-SHBs was successfully constructed. After screening, 3 pieces of cDNA in prey plasmids from true positive blue colonies were sequenced. The cDNA sequences were alpha-2-macroglobulin, tubulin alpha 1a and ribosomal protein L3.
CONCLUSION: Yeast-two hybrid method is successfully used for screening out alpha-2-macroglobulin, tubulin alpha 1a and ribosomal protein L3 as candidate binding proteins of SHBs.
- Citation: Zhou F, Ren JL, Lu YP, Chen MY, Chen JM, Liu M, Shi HX, Zhang B, Dong J. Screening of hepatocyte proteins interacting with the small surface protein of hepatitis B virus using yeast-two hybrid technique. Shijie Huaren Xiaohua Zazhi 2008; 16(13): 1378-1382
- URL: https://www.wjgnet.com/1009-3079/full/v16/i13/1378.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i13.1378
乙型肝炎病毒(hepatitis B virus, HBV)是引起病毒性肝炎、肝硬化和肝细胞癌(hepatic cell carcinoma, HCC)的重要病因[1-3]. 针对HBV基因组的研究认为HBV S区通过3个启始密码子(ATG)被人为的分为3个结构区, 前-S1, 前-S2和S区, 编码3种长度的包膜蛋白, 即大蛋白(LHBs)、中蛋白(MHBs)和主蛋白(SHBs). 我们早期的研究认为中国HBV流行株还可能存在另一启始密码子[4], 该密码子可以同框(in frame)与下游LHBs表达. 目前研究认为SHBs为3种包膜蛋白中含量最多的一种, 与 HBV的感染密切相关[5-7], 但其具体的作用机制尚未明确. 本研究以SHBs为研究靶蛋白, 利用酵母双杂交技术寻找其与肝细胞相互作用的蛋白, 这对于明确HBV致病机制、进入细胞机制具有着重要意义.
Proquest2酵母双杂交系统、人肝细胞cDNA文库(货号10422-020)、酵母细胞感受态、醋酸锂、X-a-半乳糖苷酶(Gal)、酵母细胞质粒提取试剂盒等均购自Invitrogen公司. 酵母YPAD培养基、不含氨基酸的酵母氮碱基等购自Oxoid公司, 各种氨基酸及质粒提取试剂盒均购自北京博大泰克公司; 大肠埃希菌(DH5a)本实验室保存.
1.2.1 诱饵质粒载体的构建以及靶基因表达的验证: 利用多聚酶链反应(PCR)法扩增靶基因, 根据HBV中国流行病毒株基因序列, 设计上游引物: 5'-ATGGTCGACAACATGGAGAACACAACATCAG-3', 下游引物5'-GTGCGGCCGCTAGGTTCTAATGTATACCCAAAGAC-3', 上游引物画线部分为SalⅠ内切酶位点, 下游引物画线部分为NotⅠ内切酶位点; PCR扩增HBV S主蛋白编码基因; PCR条件: 94℃ 3 min, 94℃ 30 s, 58℃ 30 s, 72℃ 30 s, 72℃ 7 min, 35个循环; PCR产物经NotⅠ/SalⅠ双酶切后连接入酵母表达载体pDEST32中构建诱饵质粒, 经酶切及PCR鉴定后, DNA测序验证, 命名为: pDEST32-SHBs. 将重组质粒在大肠埃希菌中扩增, 提取诱饵质粒. 按说明书步骤, 将诱饵质粒pDEST32-SHBs转化入MaV203. 在缺亮氨酸培养基上培养2 d后, 挑取培养阳性克隆, 用缺亮氨酸营养培养液培养, 酵母裂解液裂解MaV203后, 保留上清备用.
Western blot方法验证靶基因的表达: 将样品及阴性对照的酵母裂解液加入上样缓冲液后煮沸5 min, 分别经120 g/L SDS-PAGE胶电泳, 积层胶60 V, 30 min; 分离胶80 V, 90 min. 60 V电转100 min将胶上的蛋白质电转移到PVDF膜. 5%脱脂牛奶封闭1 h, 然后加入抗-HBs鼠mAb, 室温孵育2 h, 用TBST在室温下脱色摇床上洗脱3次, 每次10 min; 再与1:1000羊抗鼠二抗室温孵育2 h, 用TBST在室温下脱色摇床上洗脱3次, 增强化学发光法进行放射自显影.
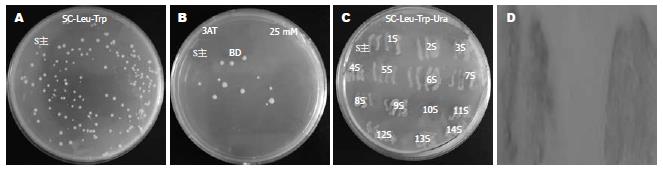
1.2.2 酵母双杂交筛选: 首先大量扩增猎物载体, 按照文库扩增手册操作滴定肝细胞文库原液, 使其浓度达到9×1012 cfu/L, 以大量质粒提取试剂盒提取猎物质粒. 按照Invitrogen公司Proquest2酵母双杂交操作指南, 醋酸锂法将诱饵质粒pDEST32-SHBs与肝细胞文库(克隆在pDEST22中)共同转化酵母MaV203, 之后将酵母细胞涂布在SC-leu/-trp以及SC-leu/-trp/-his+ 25 mM 3AT培养基上(3AT终浓度筛检试验将另文报道). 将生长在SC-leu/-trp/-his+3AT的阳性克隆划线到SC-leu/-trp/-ura的培养基上, 最后将阳性菌落接种于YPAD培养皿影印于硝酸纤维素膜用液氮裂解后置于含X-gal的Z-buffer反应体系上检查a-半乳糖苷酶活性, 变成蓝色的为真阳性菌落.
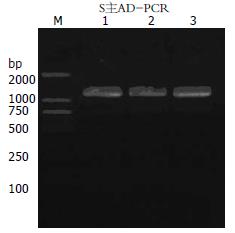
1.2.3 候选结合蛋白基因的克隆化与分析: 挑取真正的阳性集落按照Invitrogen公司酵母细胞提取试剂盒提供的操作指南提取酵母质粒. 提取的质粒后验证后, 利用Invitrogen公司提供的pDEST22质粒上, 插入文库序列两端的引物进行PCR扩增验证, 上游引物5'-TCGATGATGAA GATACCCCACC-3', 下游引物5'-CTCGACGTCTTACTTACTTAGC-3'; PCR条件: 94℃ 3 min, 94℃ 30 s, 58℃ 50 s, 72℃ 80 s, 72℃ 7 min经35个循环. 靶片段长度约为1200 bp; PCR产物经纯化后送生物公司进行DNA测序. 阳性克隆DNA测序结果提交GenBank比对, 进行生物信息学分析.
HBV S基因为本实验室克隆并测序, GenBank号为: EU075334, C2亚基因型. 将全S基因克隆到pDEST32中构建诱饵质粒pDEST32-SHBs, Western blot法验证诱饵质粒pDEST32-SHBs转化酵母后靶蛋白的表达(图1).
按照Invitrogen公司Proquest2酵母双杂交操作指南方法, 我们将构建并验证过的诱饵质粒pDEST32-SHBs与肝细胞文库(克隆在pDEST22中)共转化酵母MaV203, 之后利用不同缺陷培养基来筛选阳性克隆, 最后筛选出的阳性克隆可以表达His+、Ura+、LacZ报告基因(图2).
利用Invitrogen公司提供的肝细胞文库载体pDEST22引物扩增结合蛋白基因片段, 利用PCR方法验证并克隆酵母双杂交阳性克隆内猎物质粒携带的cDNA片段(图3).
我们共挑选13个阳性克隆测序, 测序结果与GenBank数据库进行初步比较, 获得3个SHBs候选结合蛋白的基因序列见表1.
| GenBank | 长度(aa) | 结合域 | |
| 核糖体蛋白L3 | NP_919369 | 449 | 217-414 |
| 微管蛋白α-1a | EAW60313 | 429 | 2-229 |
| α-2巨球蛋白 | AAA51552 | 643 | 304-558 |
HBV慢性感染以及感染后导致肝硬化、原发性肝癌的机制一直不明确, 目前研究认为HBV通过其病毒蛋白调节癌基因/抑癌基因的表达、诱导/对抗细胞凋亡、阻断细胞DNA损伤修复等方式导致病情演进[8-11]. 在上述过程中, 除X基因、截短型中蛋白具有的反式激活作用外, HBV干预肝细胞功能的方式也可能是通过蛋白-蛋白相互作用完成的[12-16]. 近年来, 酵母双杂交技术被成功的引进于蛋白-蛋白相互作用领域, 国内成军 et al探讨多种形态的表面抗原可能的结合蛋白, 本研究着重探讨SHBs候选结合蛋白[17-20].
我们应用Proquest酵母双杂交系统对SHBs进行了结合蛋白的筛选, 该系统的优点是假阳性率低, 按照该系统, 将我们构建的诱饵质粒pDEST32-SHBs与携带人肝cDNA文库的猎物质粒共同转化酵母细胞, 只有表达His+、Ura+、LacZ报告基因的阳性克隆才被纳入进一步研究. 通过该系统, 我们筛选出肝细胞文库中与SHBs相互作用蛋白, 共获得13个阳性克隆, 经过测序分析及与GenBank数据库进行比较, 其中3个阳性克隆测序结果为已知蛋白基因, 分别为核糖体蛋白L3、微管蛋白α-1a、α-2巨球蛋白. α-2巨球蛋白是具有多种生物活性的糖蛋白[21-22], 由肝脏、淋巴细胞、单核细胞等合成, 为免疫调节性蛋白, 属于正常血清中免疫反应抑制因子, 在体外能调节淋巴细胞对各种致有丝分裂原刺激和抗原性刺激反应, α-2巨球蛋白还能显著抑制自然杀伤细胞(natural killer cell, NK)和抗体依赖性细胞毒素细胞(antibody dependent cellular toxin cell, ADCC)活性. 目前已经观察到临床上慢性活动性肝炎和肝硬化患者α-2巨球蛋白血浓度升高, 在病情迁延时α-2巨球蛋白升高可作为急性肝炎演变为慢性的有用指标[23-26]. 这一发现为HBV感染致肝损伤机制的研究开辟了新的思路. α-2巨球蛋白全长643 aa, S主蛋白可与该蛋白的304-558 aa相互作用, 相互作用区域位于α-2巨球蛋白的下游. 另一个筛选出的SHBs候选结合蛋白核糖体蛋白L3是肽基转移酶中心, 能促进病毒在细胞中的繁殖[27-29], 核糖体蛋白L3编码449 aa, 可能与SHBs的结合区域位于217-414 aa. 筛选出的第三个结合蛋白为微管蛋白α-1a, 是一种细胞结构蛋白, 编码429 aa, 能调节微小管激活及细胞的分裂有关[30-31], 可能的与SHBs结合的区域位于微管蛋白α-1a的羧基端2-229 aa处.
总之, 我们自肝cDNA文库中应用酵母双杂交方法筛选出3种可能与SHBs结合的蛋白基因, 研究结果提示SHBs可能与上述蛋白相互作用, 可能通过干扰上述蛋白的功能导致HBV感染的持续化, 甚至影响到肝细胞功能, 其具体的作用机制是下一步研究的重点. 这些候选结合蛋白与靶蛋白结合的可靠性需要进一步通过反向酵母双杂交、哺乳细胞双杂交、免疫共沉淀等方法研究证实.
近年来, 酵母双杂交技术被成功的引进于蛋白-蛋白相互作用领域. 本研究以SHBs为研究靶蛋白, 利用酵母双杂交技术寻找其与肝细胞相互作用的蛋白, 这对于明确HBV致病机制、进入细胞机制具有着重要意义.
王凯, 教授, 山东大学齐鲁医院肝病科
SHBs为3种包膜蛋白中含量最多的一种与HBV的感染密切相关, 但其具体机制尚未明确.
本研究经过严格的酵母双杂交筛选, 通过对阳性克隆的测序, 初步提示核糖体蛋白L3、微管蛋白α-1a、α-2巨球蛋白部分或全基因编码产物可能与HBV主蛋白相互作用.
结合蛋白: 与某种蛋白发生物理相互结合作用, 并可能通过该结合作用干扰、失活蛋白原本的生物学功能
本研究选题明确, 设计思路清晰合理, 方法简单可靠, 具有一定的可读性.
编辑: 李军亮 电编:何基才
| 1. | Park NH, Song IH, Chung YH. Chronic hepatitis B in hepatocarcinogenesis. Postgrad Med J. 2006;82:507-515. [PubMed] [DOI] |
| 2. | Pollicino T, Squadrito G, Cerenzia G, Cacciola I, Raffa G, Craxi A, Farinati F, Missale G, Smedile A, Tiribelli C. Hepatitis B virus maintains its pro-oncogenic properties in the case of occult HBV infection. Gastroenterology. 2004;126:102-110. [PubMed] [DOI] |
| 3. | Arbuthnot P, Kew M. Hepatitis B virus and hepatocellular carcinoma. Int J Exp Pathol. 2001;82:77-100. [PubMed] [DOI] |
| 5. | Patient R, Hourioux C, Sizaret PY, Trassard S, Sureau C, Roingeard P. Hepatitis B virus subviral envelope particle morphogenesis and intracellular trafficking. J Virol. 2007;81:3842-3851. [PubMed] [DOI] |
| 6. | Blanchet M, Sureau C. Analysis of the cytosolic domains of the hepatitis B virus envelope proteins for their function in viral particle assembly and infectivity. J Virol. 2006;80:11935-11945. [PubMed] [DOI] |
| 7. | Bruss V, Ganem D. The role of envelope proteins in hepatitis B virus assembly. Proc Natl Acad Sci U S A. 1991;88:1059-1063. [PubMed] [DOI] |
| 8. | Ogden SK, Lee KC, Barton MC. Hepatitis B viral transactivator HBx alleviates p53-mediated repression of alpha-fetoprotein gene expression. J Biol Chem. 2000;275:27806-27814. [PubMed] |
| 9. | Oishi N, Shilagardi K, Nakamoto Y, Honda M, Kaneko S, Murakami S. Hepatitis B virus X protein overcomes oncogenic RAS-induced senescence in human immortalized cells. Cancer Sci. 2007;98:1540-1548. [PubMed] [DOI] |
| 10. | Ou DP, Tao YM, Tang FQ, Yang LY. The hepatitis B virus X protein promotes hepatocellular carcinoma metastasis by upregulation of matrix metalloproteinases. Int J Cancer. 2007;120:1208-1214. [PubMed] [DOI] |
| 11. | Peng Z, Zhang Y, Gu W, Wang Z, Li D, Zhang F, Qiu G, Xie K. Integration of the hepatitis B virus X fragment in hepatocellular carcinoma and its effects on the expression of multiple molecules: a key to the cell cycle and apoptosis. Int J Oncol. 2005;26:467-473. [PubMed] |
| 12. | Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis. World J Gastroenterol. 2007;13:74-81. [PubMed] |
| 13. | Hildt E, Munz B, Saher G, Reifenberg K, Hofschneider PH. The PreS2 activator MHBs(t) of hepatitis B virus activates c-raf-1/Erk2 signaling in transgenic mice. EMBO J. 2002;21:525-535. [PubMed] [DOI] |
| 14. | Kim DG. Differentially expressed genes associated with hepatitis B virus HBx and MHBs protein function in hepatocellular carcinoma. Methods Mol Biol. 2006;317:141-155. [PubMed] |
| 15. | Hildt E, Saher G, Bruss V, Hofschneider PH. The hepatitis B virus large surface protein (LHBs) is a transcriptional activator. Virology. 1996;225:235-239. [PubMed] [DOI] |
| 16. | Hildt E, Hofschneider PH. The PreS2 activators of the hepatitis B virus: activators of tumour promoter pathways. Recent Results Cancer Res. 1998;154:315-329. [PubMed] |
| 17. | 李 志群, 马 英骥, 成 军. 酵母双杂交技术筛选肝细胞中与羧基末端截短型乙型肝炎表面抗原中蛋白MHBst167蛋白结合蛋白的研究. 胃肠病学和肝病学杂志. 2006;15:138-140. |
| 18. | 田 江克, 成 军, 刘 妍, 崔 玉芳, 纪 冬, 王 琳, 程 勇前, 钟 彦伟, 徐 东平. 乙型肝炎病毒截短型表面抗原中蛋白结合蛋白的筛选. 世界华人消化杂志. 2006;14:2382-2385. |
| 21. | Zorina VN, Zorin NA, Lykova OF, Konysheva TV, Zorina RM. Alpha-2-macroglobulin ligands and their biotransport mechanisms. Biomed Khim. 2007;53:164-171. [PubMed] |
| 22. | Meijer AB, Rohlena J, van der Zwaan C, van Zonneveld AJ, Boertjes RC, Lenting PJ, Mertens K. Functional duplication of ligand-binding domains within low-density lipoprotein receptor-related protein for interaction with receptor associated protein, alpha2-macroglobulin, factor IXa and factor VIII. Biochim Biophys Acta. 2007;1774:714-722. [PubMed] |
| 24. | 宋 育林, 杨 文卓, 贾 一韬, 陆 伦根, 茅 益民, 曹 爱平, 朱 红音, 李 恩灵, 万 谟彬, 李 成忠. 慢性肝病病理分级、分期与血清学指标关系的初步研究. 胃肠病学. 2001;6:78-80. |
| 25. | Morali G, Maor Y, Klar R, Braun M, Ben Ari Z, Bujanover Y, Zuckerman E, Boger S, Halfon P. Fibrotest-Actitest: the biochemical marker of liver fibrosis--the Israeli experience. Isr Med Assoc J. 2007;9:588-591. [PubMed] |
| 26. | Fielden MR, Brennan R, Gollub J. A gene expression biomarker provides early prediction and mechanistic assessment of hepatic tumor induction by nongenotoxic chemicals. Toxicol Sci. 2007;99:90-100. [PubMed] [DOI] |
| 27. | Petrov A, Meskauskas A, Dinman JD. Ribosomal protein L3: influence on ribosome structure and function. RNA Biol. 2004;1:59-65. [PubMed] |
| 28. | Pringle M, Poehlsgaard J, Vester B, Long KS. Mutations in ribosomal protein L3 and 23S ribosomal RNA at the peptidyl transferase centre are associated with reduced susceptibility to tiamulin in Brachyspira spp. isolates. Mol Microbiol. 2004;54:1295-1306. [PubMed] [DOI] |
| 29. | Meskauskas A, Dinman JD. Ribosomal protein L3: gatekeeper to the A site. Mol Cell. 2007;25:877-888. [PubMed] [DOI] |
| 30. | Chang W, Webster DR, Salam AA, Gruber D, Prasad A, Eiserich JP, Bulinski JC. Alteration of the C-terminal amino acid of tubulin specifically inhibits myogenic differentiation. J Biol Chem. 2002;277:30690-30698. [PubMed] [DOI] |