修回日期: 2008-03-14
接受日期: 2008-04-21
在线出版日期: 2008-04-28
目的: 利用原核表达系统构建Tec激酶区作用蛋白RAI16的融合蛋白表达载体, 并进行表达条件的优化和初步纯化.
方法: 设计基因拼接引物, 合成RAI16 cDNA序列, 将其连接于克隆载体pMD18-T中; 将酶切、纯化的RAI16基因与pGEX4T-2载体相连接、转化、筛选. 将鉴定阳性的重组子质粒转人大肠杆菌BL-21表达菌中, 采用SDS-PAGE电泳分析不同浓度诱导剂异丙基硫代-D-半乳糖苷(IPTG)、不同诱导温度、不同诱导时间下目的蛋白的表达.
结果: 成功构建RAI16蛋白原核表达载体. 采用0.4 mmol/L IPTG、30℃诱导4 h, 获得较高表达目的蛋白. 融合蛋白主要以包涵体形式表达, 将包涵体进行尿素法变性复性和亲和层析柱处理后, 获得可溶的高纯度GST-多肽融合蛋白.
结论: Tec激酶区作用蛋白RAI16融合蛋白表达的载体和纯化, 是制备RAI16多抗以及进一步验证与Tec体外结合作用实验的基础.
引文著录: 许文, 王阁, 邓婧, 杨进, 郑继军, 王红中, 胡庆, 王东, 李增鹏, 杨志祥. Tec激酶区作用蛋白RAI16的原核表达和纯化. 世界华人消化杂志 2008; 16(12): 1350-1354
Revised: March 14, 2008
Accepted: April 21, 2008
Published online: April 28, 2008
AIM: To construct and purify an active region of prokaryotic expression vector retinoic acid induced 16 (RAI16) interacting with Tec kinase domain.
METHODS: TRAI16 cDNA sequence was synthesized, and then linked to pMD18-T vector. After enzyme digestion, the purified target fragment was linked to the expression vector pGEX4T-2, which was then transferred and screened. After the positive recombinants were transferred into human E.coil BL-21, the expression was induced by different concentrations of isopropyl β-D-thiogalactoside (IPTG) at different temperatures and culture time periods. The expression products were analyzed by SDS-PAGE.
RESULTS: RAI16 cDNA was successfully cloned in pGEX4T-2 plasmid. Using 0.4 mmol/L IPTG at 30℃ for 4 h, the soluble target protein was expressed efficiently. SDS-PAGE revealed glutathione S-transferase-RAI16 fusion protein bands expressed mainly in the form of inclusion bodies.
CONCLUSION: High expression of the extracellular region of Tec fusion protein is attained using E.coil BL-21, and the soluble target protein without any additional amino acid is successfully purified.
- Citation: Xu W, Wang G, Deng J, Yang J, Zheng JJ, Wang HZ, Hu Q, Wang D, Li ZP, Yang ZX. Prokaryotic expression and purification of retinoic acid induced 16 interacting with Tec kinase domain. Shijie Huaren Xiaohua Zazhi 2008; 16(12): 1350-1354
- URL: https://www.wjgnet.com/1009-3079/full/v16/i12/1350.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i12.1350
Tec(tyrosine kinase expressed in hepatocellular carcinoma)是一种存在于胞质内的非受体型蛋白酪氨酸激酶, 最初于肝癌组织中筛选得到, 他参与多种细胞因子的信号传递过程, 是多种细胞因子、辅助分子及受体型PTK信号转导过程中一个重要的靶分子. 一方面, Tec能够对受体型蛋白酪氨酸激酶(包括生长因子受体、细胞因子受体、G蛋白耦联受体、抗原受体)及整合素等传导的各种胞外刺激做出反应[1-2]. 同时, Tec可以被许多非受体型蛋白酪氨酸激酶调节, 如: Src、JAK、Syk和FAK家族激酶等. 研究表明Tec蛋白激酶经上游分子活化后, 通过SH2、SH3、PH、TH等的连接, 与下游作用底物BRDG1[3]、TIP3[4]、Grb10/GrbIR[5]、Sak丝-苏氨酸激酶[6]、p62Dok-1[7]、NF-AT[8]、PTP20[9]、LARG[10]、p85和p55PIK亚基及Vav等[11]相互结合, 从而调节多种主要信号传导路径, 包括磷脂酰肌3-激酶(PI3-K)通路、磷脂酶C(PLCγ)[12-14]通路以及蛋白激酶C(PKC)通路[15]. 我们前期以Tec激酶结构域作为"钓饵"蛋白, 利用酵母双杂交技术筛选构建于转录激活结构域(AD)载体的cDNA文库, 经筛选, 发现并确证了一个新的阳性克隆. 本实验以多组织cDNA试剂盒作为模板, 合成巢式PCR引物, 进行两步法PCR扩增, 得到RAI16基因, 并将其插入到原核表达质粒pGEX4T-2中, 与GST基因融合, 构建原核融合表达载体.
pGEX 4T-2 vector购自Amersham Biosciences公司, PMD18-T vector, 高保真LA Taq酶、EcoRI、XhoI、PMD18-T、Simple Vector TA克隆试剂盒购自大连TaKaRa公司, cDNA克隆模板购自ClonTech公司; 质粒小抽试剂盒购自Omega公司, DNA纯化回收试剂盒购自Promega公司, IPTG购自Bebco公司.
1.2.1 重组人TEC激酶区基因cDNA: 序列胞外段基因的改造和合成: (1)引物设计、连接、和PCR扩增: 根据GenBank上人TEC基因编码多肽氨基酸序列, 设计24条用于基因拼接的正、反链DNA引物, 在5'端和3'端分别含有与载体连接的NruⅠ或EcoRⅠ酶切位点. 以连接反应产物2 mL为模板, 加入10×LA Buffer 2.5 mL、dNTPs Mixture 2 mL、引物RAI16 N5'和RAI16 N3'各0.5 mL、LA Taq酶0.25 mL、ddH2O 25 mL, 混匀. DNA扩增: 预变性94℃, 2 min; 变性94℃, 45 s; 退火55℃, 45 s; 延伸72℃, 2 min; 25个循环后72℃延伸7 min. 以1 mL PCR扩增产物为模板, 加入10×LA Buffer 5 mL、dNTPs Mixture(10 mmol/L)4 mL、引物RAI16 N5'和RAI16 N3'各1 mL、LA Taq酶0.5 mL、ddH2O 50 mL, 混匀. DNA扩增: 30个循环后72℃延伸7 min, 其他同前. (2)目的基因的连接、转化、克隆筛选及鉴定: 取PCR产物5 mL, 10×T4 DNA配体Buffer 2 mL、pMD-18T载体1 mL、RAI16 4 mL ddH2O 10 mL置16℃水浴中连接过夜, 连接产物转化E.coil DH5a. 取2 mL反应产物加入100 mL感受态菌液中, 冰浴40 min, 设阳、阴性对照; 置42℃水浴, 热休克90 s, 冰浴1-2 min; 每管加LB培养液, 37℃ 100 r/min振摇1 h. 各取100 mL涂布LB平板上, 37℃过夜. 取可疑白色菌落接种于10 mL的LB培养液中, 37℃ 250 r/min过夜; 取10×LA Buffer 5 mL、Dntp 4 mL、RAI16 5' 1 mL、RAI16 3' 1 mL、LA Tag 0.5 mL、ddH2O 50 mL混匀; 94℃, 2 min; 94℃, 45 s; 55℃, 45 s; 72℃, 1.5 min; 30个循环后72 ℃延伸7 min. 琼脂糖凝胶电泳, XhoⅠ和EcoRⅠ双酶切鉴定, 阳性的载体测序. 将阳性菌株接种于LB液体培养基, 37℃, 200 r/min过夜. 将测序证实完全正确的序列命名为pMD-18T/RAI16.
1.2.2 重组人TEC基因cDNA原核表达载体pGEX 4T-2/RA116的构建: 取表达载体pGEX 4T-2质粒DNA及pMD18-T/RAI16质粒DNA各1 mg, 分别加入EcoRⅠ、XhoⅠ各1 mL, 10×H Buffer 2 mL, ddH2O 20 mL, 37℃水浴, 酶切4-6 h. 酶切产物行琼脂糖凝胶电泳, 回收载体及目的基因片断. 取PCR产物5 mL, 10×T4 DNA配体Buffer 2 mL、pGEX 4T-2 2 mL、RAI16 3 mL、ddH2O 20 mL, 置16℃水浴中连接过夜, 连接产物转化E.coil BL-21. 取2 mL连接反应产物加入100 mL感受态菌液中, 冰浴40 min, 设阳、阴性对照; 置42℃水浴, 热休克90 s, 冰浴1-2 min; 加LB培养液, 37℃100 r/min振摇1 h. 各取100 mL涂布LB平板上, 37℃过夜. 挑取可疑白色菌落接种于10 mL的LB培养液中, 37℃ 250 r/min 过夜; 取10×LA Buffer 5 mL、dNTP 4 mL、RAI16 5' 1 mL、RAI16 3' 1 mL、LA Tag 0.5 mL、ddH2O 50 mL混匀. DNA扩增: 72℃, 1.5 min; 30个循环后72℃延伸7 min, 余其他同前. 琼脂糖凝胶中电泳. 质粒抽提, XhoⅠ和EcoRⅠ鉴定, 阳性的载体测序. 将测序证实完全正确的序列命名为pGEX 4T-2/RA116.
1.2.3 融合蛋白的诱导表达: pGEX4T-2/RAI16表达质粒和pGEX4T-2载体转化至蛋白表达菌株E.coli BL-21中; 挑取单个BL21/pGEX4T-2/RAI16, BL21/pGEX4T-2(+)转化菌落和单个BL-21菌, 用10 mL的LB培养基在37℃以200 r/min过夜振荡; 抽提质粒, 酶切鉴定; 挑取单个菌落, 接种l0 mL LB培养基, 37℃ 200 r/min过夜; 按1:100的比例接种10 mL LB 培养基, 37℃ 200 r/min摇菌培养至A600约为0.4-0.6; 各取1 mL菌液离心收集菌体, 各用0.5 mL PBS重悬沉淀, 离心弃上清, 加入水和2×SDS上样缓冲液, 4℃备用; 加入IPTG至终浓度0.4 mmol/L, 37℃, 4 h; 各取1 mL菌液, 以4000 r/min离心5 min, 收集菌体; 用0.5 mL PBS重悬沉淀, 离心弃上清; 以水和2×SDS上样缓冲液重悬沉淀, 100℃, 10 min, 以1000 r/min离心3 min; 各取20 mL上清的标本进行10% SDS-PAGE. IPTG以上述浓度, 诱导1、2、3、4 h后, 检测表达量; 以30℃和37℃诱导表达, 观察诱导温度变化后融合蛋白的表达量; 菌液离心收集沉淀, 用PBS重悬, 离心, 弃液, 加无菌水和2×SDS上样缓冲液, 混匀, 100℃, 5 min, 上样20 mL进行10% SDS-PAGE. 电泳, 染色, 脱色, 扫描, 凝胶成像系统扫描分析表达产物.
1.2.4 融合蛋白的纯化: (1)融合蛋白的大量诱导表达: 取转化的单克隆菌落, 用LB培养基振荡过夜; 次晨按1:100比例分别接种于含Amp的LB培养基中, 于37℃振荡培养至为约A600 = 0.5-0.6; 各加IPTG至终浓度为0.4 mmol/L, 30℃培养4 h至约A600 = 1.2-1.3; 取1 mL菌液离心收集菌体, 重悬, 加无菌水和上样缓冲液, SDS-PAGE电泳分析; 离心收集菌体. 各用5 mL PBS重悬菌体. 置-70℃冷冻1 h; 取出标本, 消冻, 超声破碎; 加入Triton X-100至终浓度为1%, 轻振荡20 min; 4℃, 以8000 g×10 min离心; 弃上清, 加DTT至终浓度为1 mmol/L; 取20 μL进行SDS-PAGE电泳分析; (2)包涵体洗脱、变性和复性: 将沉淀分别用包涵体洗涤液Ⅰ和包涵体洗涤液Ⅱ洗脱包涵体, 洗脱后产物用蛋白变性液溶解, 室温放置3 h; 用含不同浓度梯度尿素的透析溶液在8000 MWCO的透析袋透析处理24 h, 透析中换液多次, 透析液各达约2 L; 以含25 mmol/L Tris-HCl和20 mmol/L NaCl的溶液透析2 h; 透析袋内容物行SDS-PAGE分析; (3)融合蛋白的纯化: 混匀树脂填料, 装柱; 用1×GST Wash Buffer冲洗至平衡状态; 加入细菌混合物, 流速为每小时10个柱床体积. 收集流过液置于冰上; 用10倍柱床体积1×GST Wash Buffer冲洗, 收集流过液置于冰上; 用3倍体积1×GST Elution Buffer洗脱融合蛋白, 置-70℃冷藏.
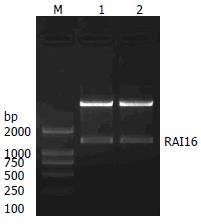
显示6号(PGEX-RAI16-6)和8号(PGEX-RAI16-8)在2000 bp与1000 bp之间约1300 bp处出现一明亮条带, 与预期值相符(图1).
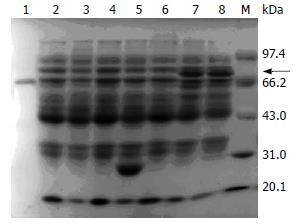
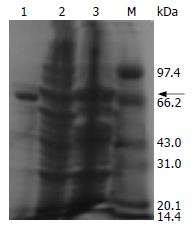
发现pGEX4T-2(+)诱导后有约26 kDa的GST蛋白表达, 而pGEX4T-2/RAI16重组质粒诱导后有约75 kDa大小的目的蛋白条带出现, 大小与我们的预期值一致(图2). 用细胞裂解物的上清和沉淀分别电泳后, 发现有部分可溶的目的蛋白表达, 而目的蛋白大多以包涵体形式存在(图3).
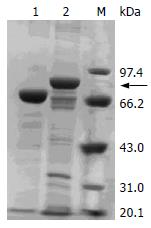
将融合蛋白大量诱导表达后, 超声碎菌, 在7 mol/L尿素存在的条件下, 其包涵体溶解, 经变性复性处理后可得到可溶的目的蛋白. 另外, 将以可溶形式存在于上清中的表达产物用谷胱甘肽-琼脂糖树脂进行免疫亲和层析纯化, 得到了可溶的GST-多肽融合蛋白(图4).
表达载体是指含有强启动子的质粒载体. 原核表达载体分为两类: 一类是可直接表达不含任何原核序列的外源蛋白的载体, 称为非融合型表达载体; 另一类则是以融合蛋白的形式进行表达的载体, 融合蛋白的一部分由载体编码, 而其余部分则由外源片段的开放阅读框编码, 称为融合表达载体. 可调控的强启动子和有效的核糖体结合位点(ribosome binding site, RBS), 是原核表达载体表达完整的天然蛋白所必不可少的两个要素. 原核表达系统通常用来表达天然状态下糖基化影响不大的重组蛋白, 其中pGEX-4T系列载体是比较常用的原核表达载体, 具有一个强的tac启动子, 表达与GST蛋白相融合的重组蛋白, 两者之间有凝血酶或Ⅹa因子酶切位点. 细胞中的生物学活性蛋白质常以可溶性或分子复合物的形式存在, 功能性的蛋白质总是折叠成特定的三维结构型. 而包涵体内的蛋白是非折叠状态的聚集体, 不具有生物学活性. 不可溶、无生物活性的包涵体必须经过变性、复性才能获得天然结构和生物活性, 因此应该选择一个合适的复性过程来实现蛋白质的正确折叠, 获得生物活性.
本实验中采用7 mol/L的尿素成功地进行了RAI16蛋白的变性复性工作, 在7 mol/L尿素存在的条件下, 其包涵体溶解, 经变性复性处理后可得到可溶的目的蛋白. 另一方面, 参照pGEX4T-2(+)载体外源基因表达纯化方法, 结合GST亲合层析说明书的纯化条件, 摸索RAI16蛋白的纯化方法. 将RAI16超声后离心的上清用谷胱甘肽-琼脂糖树脂进行免疫亲和层析纯化, 得到GST-RAI16融合蛋白纯化物, 为制备RAI16多抗以及进一步验证与Tec体外结合作用等后续实验提供了充足的蛋白来源. 我们对诱导前培养条件、诱导温度、时间及IPTG用量与表达量的关系进行了研究后发现, 首先接种量不宜过大, 才能保证A600约为0.5左右时, 工程菌的生长处于对数生长的中、后期, 一般选用1%-5%的接种比例. 其次诱导点的选择, 我们选用了1%的接种量, 诱导点选择A600达到0.6时. 诱导温度、时间与诱导剂IPTG用量的关系[16]是我们研究的重点. 37℃是大肠杆菌生长的最适温度, 但并非是其中外源基因表达时的最佳温度. 如果表达需要的温度与菌体生长温度不同时, 在加诱导剂之前, 即应在短时间内改变培养温度, 使之与加入诱导剂以后的温度相一致, 这样有利于重组蛋白进行高效表达[17]. 通过一系列实验研究, 我们摸索发现RAI16高效表达的条件, 最后进行SDS-PAGE鉴定, 其表达产物部分主要以包涵体形式存在, 有部分融合蛋白以可溶形式存在于上清中. 本研究对筛库所得基因片段测序并经BLAST比对分析后, 确定为RAI16基因, 已被GenBank收录(编号为BC052237), 组织来源为脑Ⅳ型星状细胞瘤, 其编码蛋白为人视黄酸诱导蛋白16. 随后以RAI16蛋白为切入点, 一方面利用相关的生物信息学站点及计算机软件, 对RAI16进行生物信息学分析, 从中获得其编码蛋白质结构方面的重要信息, 从而根据结构预测其功能; 另一方面将RAI16基因构建于原核表达载体中, 进行融合表达, 并进一步纯化融合蛋白, 为下一步RAI16功能研究奠定重要基础.
Tec是一种存在于胞质内的非受体型蛋白酪氨酸激酶, 最初于肝癌组织中筛选得到, 其参与多种细胞因子的信号传递过程, 是多种细胞因子、辅助分子及受体型PTK信号转导过程中一个重要的靶分子. 经测序及BLAST比对分析, RAI16确定为一种Tec相关新基因.
刘彬彬, 副研究员, 复旦大学附属中山医院、复旦大学肝癌研究所.
Tec是肝干细胞和肝细胞增殖、定向诱导分化及凋亡信号转导途径中关键的蛋白激酶连接分子, 但其分子机制还有待于进一步深入研究. 由于研究上下游蛋白分子间的相互作用是研究信号转导分子作用机制的重要组成部分, 因此, 探寻新的Tec相关作用分子具有十分重要的意义.
近几年发现RAI系列基因, 但对就构建TEC激酶区作用蛋白RAI16的融合蛋白表达载体, 以及表达条件的优化和初步纯化未见报道.
本研究将RAI16基因构建于原核表达载体pGE X4T-2中, 与GST基因融合, 再进行诱导表达得到GST-RAI16融合蛋白, 并进一步纯化融合蛋白, 为后续实验进一步验证RAI16与Tec蛋白之间的相互作用, 以及RAI16蛋白在体外的某些生物学活性奠定重要基础.
本文在原工作基础上构建了RAI16蛋白的原核表达载体, 为后续研究工作奠定基础, 提供了充分的实验信息, 结果可信, 有一定的学术价值.
编辑: 程剑侠 电编:何基才
| 1. | Berg LJ, Finkelstein LD, Lucas JA, Schwartzberg PL. Tec family kinases in T lymphocyte development and function. Annu Rev Immunol. 2005;23:549-600. [DOI] |
| 2. | Finkelstein LD, Shimizu Y, Schwartzberg PL. Tec kinases regulate TCR-mediated recruitment of signaling molecules and integrin-dependent cell adhesion. J Immunol. 2005;175:5923-5930. [PubMed] |
| 3. | Ohya K, Kajigaya S, Kitanaka A, Yoshida K, Miyazato A, Yamashita Y, Yamanaka T, Ikeda U, Shimada K, Ozawa K. Molecular cloning of a docking protein, BRDG1, that acts downstream of the Tec tyrosine kinase. Proc Natl Acad Sci U S A. 1999;96:11976-11981. [PubMed] [DOI] |
| 4. | Ohya K, Kajigaya S, Yamashita Y, Miyazato A, Hatake K, Miura Y, Ikeda U, Shimada K, Ozawa K, Mano H. SOCS-1/JAB/SSI-1 can bind to and suppress Tec protein-tyrosine kinase. J Biol Chem. 1997;272:27178-27182. [PubMed] [DOI] |
| 5. | Mano H, Ohya K, Miyazato A, Yamashita Y, Ogawa W, Inazawa J, Ikeda U, Shimada K, Hatake K, Kasuga M. Grb10/GrbIR as an in vivo substrate of Tec tyrosine kinase. Genes Cells. 1998;3:431-441. [PubMed] [DOI] |
| 6. | Yamashita Y, Kajigaya S, Yoshida K, Ueno S, Ota J, Ohmine K, Ueda M, Miyazato A, Ohya K, Kitamura T. Sak serine-threonine kinase acts as an effector of Tec tyrosine kinase. J Biol Chem. 2001;276:39012-39020. [PubMed] [DOI] |
| 7. | van Dijk TB, van Den Akker E, Amelsvoort MP, Mano H, Löwenberg B, von Lindern M. Stem cell factor induces phosphatidylinositol 3'-kinase-dependent Lyn/Tec/Dok-1 complex formation in hematopoietic cells. Blood. 2000;96:3406-3413. [PubMed] |
| 8. | Tomlinson MG, Kane LP, Su J, Kadlecek TA, Mollenauer MN, Weiss A. Expression and function of Tec, Itk, and Btk in lymphocytes: evidence for a unique role for Tec. Mol Cell Biol. 2004;24:2455-2466. [PubMed] [DOI] |
| 9. | Aoki N, Ueno S, Mano H, Yamasaki S, Shiota M, Miyazaki H, Yamaguchi-Aoki Y, Matsuda T, Ullrich A. Mutual regulation of protein-tyrosine phosphatase 20 and protein-tyrosine kinase Tec activities by tyrosine phosphorylation and dephosphorylation. J Biol Chem. 2004;279:10765-10775. [PubMed] [DOI] |
| 10. | Suzuki N, Nakamura S, Mano H, Kozasa T. Galpha 12 activates Rho GTPase through tyrosine-phosphorylated leukemia-associated RhoGEF. Proc Natl Acad Sci U S A. 2003;100:733-738. [PubMed] [DOI] |
| 11. | Takahashi-Tezuka M, Hibi M, Fujitani Y, Fukada T, Yamaguchi T, Hirano T. Tec tyrosine kinase links the cytokine receptors to PI-3 kinase probably through JAK. Oncogene. 1997;14:2273-2282. [PubMed] [DOI] |
| 12. | Lucas JA, Miller AT, Atherly LO, Berg LJ. The role of Tec family kinases in T cell development and function. Immunol Rev. 2003;191:119-138. [DOI] |
| 13. | Finkelstein LD, Schwartzberg PL. Tec kinases: shaping T-cell activation through actin. Trends Cell Biol. 2004;14:443-451. [PubMed] [DOI] |
| 14. | Reynolds LF, Smyth LA, Norton T, Freshney N, Downward J, Kioussis D, Tybulewicz VL. Vav1 transduces T cell receptor signals to the activation of phospholipase C-gamma1 via phosphoinositide 3-kinase-dependent and -independent pathways. J Exp Med. 2002;195:1103-1114. [PubMed] [DOI] |
| 15. | Qiu Y, Kung HJ. Signaling network of the Btk family kinases. Oncogene. 2000;19:5651-5661. [PubMed] [DOI] |
| 16. | Piatak M, Lane JA, Laird W, Bjorn MJ, Wang A, Williams M. Expression of solube and fully functional ricin a chain in in Escherichia coli is temperature-senstive. J Biol Chem. 1990;268:4837-4843. |
| 17. | Hounsa CG, Aubry JM, Dubourguier HC, Hornez JP. Application of factorial and Doehlert design for optimization of pectate lyase production by a recombinant Escherichia coli. Appl Microbiol Biotechnol. 1996;45:764-770. [DOI] |