修回日期: 2008-03-20
接受日期: 2008-04-21
在线出版日期: 2008-04-28
目的: 探讨胃癌血清中MUC1、MUC2及MUC5AC与胃癌的关系.
方法: 利用黏蛋白MUC1、MUC2及MUC5AC的单抗及多抗, 制备黏蛋白芯片, 用免疫荧光原理进行检测, 并用CEA作为指示指标, 对30例胃癌患者及30例健康人进行黏蛋白血清水平的检测.
结果: 胃癌组与对照组相比, 3种黏蛋白血清水平均增高, 两组间差异显著. MUC1的阳性表达与胃癌TNM分期相关(P = 0.0047), MUC2和MUC5AC的阳性表达与TNM分期无关(P = 0.136, P = 0.201). 3种黏蛋白的表达均随胃癌分化程度降低而阳性表达增高的趋势. 各单一黏蛋白以及黏蛋白两两之间联合用于胃癌诊断的敏感性及特异性均较高, 其中单一黏蛋白中, MUC1的的敏感性和特异性最好, 分别达到81.5%、75.8%, 联合诊断(3种黏蛋白中至少2种阳性)的敏感性和特异性达到96.0%、82.9%.
结论: 检测血清黏蛋白MUC1、MUC2及MUC5AC水平, 可以提高胃癌诊断的敏感性及特异性, 为早期诊断提供新的思路, 并对判断分期及预后提供帮助.
引文著录: 黄晓辉, 徐迎新, 李荣, 刘洪一, 张敏丽. 血清MUC1、MUC2及MUC5AC表达与胃癌的关系. 世界华人消化杂志 2008; 16(12): 1299-1303
Revised: March 20, 2008
Accepted: April 21, 2008
Published online: April 28, 2008
AIM: To explore the association of mucins (MUC1, MUC2 and MUC5AC) expression in serum with gastric cancer.
METHODS: Mucin protein chip was made using monoclonal and multiclonal antibodies and then applied to measure the levels of serum MUC1, MUC2 and MUC5AC in 30 gastric cancer patients and 30 healthy adults using the method of immunofluorescence (carcinoembryonic antigen as an indicator).
RESULTS: The levels of serum mucins and CEA in gastric cancer patients were significantly higher than those in the healthy controls. The positive expression of MUC1 was related with the TNM staging for gastric cancer (P = 0.0047), but the positive rates of MUC2 and MUC5AC expression had no relationship with the TNM staging (P = 0.136, P = 0.201). The positive rates of mucins expression were increased with the descending of cancer differentiation degree. Single mucin or either two mucins were sensitive and specific in the diagnosis of gastric cancer. For single mucin detection, MUC1 was the most sensitive and specific, with a sensibility of 81.5% and a specificity of 75.8%, respectively. Mucins in combination (at least 2 positive) had a sensibility of 96.0% and a specificity of 82.9%, respectively.
CONCLUSION: Serum mucins detection has higher sensibility and specificity in the diagnosis of gastric cancer, which may provide a new approach to early diagnose and prognose gastric cancer.
- Citation: Huang XH, Xu YX, Li R, Liu HY, Zhang ML. Relationship between serum expression of MUC1, MUC2 and MUC5AC and gastric cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(12): 1299-1303
- URL: https://www.wjgnet.com/1009-3079/full/v16/i12/1299.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i12.1299
黏蛋白是黏液凝胶的主要成分, 是一组高度糖基化的不同糖蛋白的总称, 主要起细胞保护、黏性维持、细胞识别等作用[1], 在肿瘤的进程中扮演着重要的角色[2]. 我们应用蛋白芯片技术,对胃癌患者及正常人的血清标本进行黏蛋白MUC1、MUC2、MUC5AC表达的研究, 以揭示黏蛋白MUC在胃癌患者血清中的表达规律及可能预示的临床意义.
本研究实验组的血清标本30例均收集2006-01/2006-10我院经手术、病理证实的胃癌患者, 男21例, 女9例, 年龄在35-68(中位年龄54)岁; 病理分期: Ⅰ期: 5例, Ⅱ期: 5例, Ⅲ期: 7例, Ⅳ期: 13例; 病理分期采用美国癌症联合委员会(AJCC)TNM分期方法. 对照组30例血清标本均取自住院非肿瘤患者或正常献血者, 实验组及对照组的血液标本均于晨起空腹时采取, 自然凝固后, 3000 r/min离心, 取上清, -70℃冻存备用. MUC1、MUC2的单抗及多抗和MUC5AC的多抗均购自美国Santa Cruz公司, CEA的单抗、多抗和MUC5AC的单抗均购自美国的Neo2marker公司, 芯片片基(环氧基化玻璃片)购自美国CEL Associates公司, 辣根过氧化酶(HRP)标记的二抗及免疫荧光底物购自美国的Amersham公司. 肿瘤标志物定标液(含CEA 400 μg/L, Ca153 267 kU/L)由本院生化科惠赠. 洗涤液: 0.1 mol/L磷酸盐, 缓冲液(PBS): 0.1% Tween220, pH7.4, 封闭液: 0.1 mol/L PBS, pH7.4, 2% BSA. 免疫荧光分析仪为军事医学科学院二所提供应用.
1.2.1 芯片设计及制备: 将环氧基化玻璃片分隔成10个正方形的凹槽, 将捕获抗体(多抗)以200 mg/L的浓度, 点于片基上, 每点0.25 μL, 其中每个方格内分别点MUC1、MUC2、MUC5AC及CEA的多克隆抗体, 湿盒中室温、轻振1 h, 用封闭液室温封闭1 h, 备用.
1.2.2 免疫反应: 将芯片用洗涤液洗涤2 min×3次后, 将待检样品加入芯片上(每孔20 mL), 湿盒中室温、轻振1 h, 洗涤液洗涤5 min×3次后, 加入黏蛋白的单抗(包括MUC1、MUC2、MUC5AC及CEA的单抗, 各浓度均为2 mg/L), 湿盒中室温、轻振1 h, 洗涤液洗涤5 min×3次, 加入HRP标记的二抗(浓度为1 mg/L), 湿盒中室温、轻振1 h, 洗涤液洗涤5 min×3次.
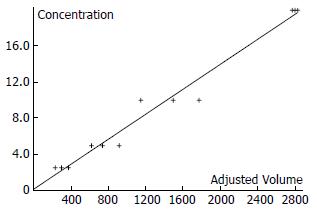
1.2.3 检测和标准曲线的绘制: 加入免疫荧光底物, 通过荧光分析仪检测, 使用GenePixPro4.0分析软件进行分析. 采用CEA的浓度荧光强度曲线作为标准曲线间接地用于黏蛋白的浓度荧光强度曲线(图1). 由于每份肿瘤定标液中各抗原的荧光强度相同, 也就是400 mg/L的CEA与267 kU/L的CA153有相同的荧光强度, 而CA153和MUC1是同一黏蛋白的不同片段[3], 因此测出标本中MUC1的荧光强度, 就可以对应地计算出标本中MUC1的浓度. 同样方法计算出各血清标本的MUC2及MUC5AC的浓度. 对每种黏蛋白的血清浓度进行统计分析, 找到临界值, 也就是检测敏感度+特异度为最大时所对应的血清值(因本实验的设计基于普查性应用, 因此可以适当增加敏感度), 并分别计算出各自的阳性例数, 以及每两种黏蛋白中, 至少有一种黏蛋白阳性的例数和三种黏蛋白中, 至少有两种黏蛋白阳性例数.
统计学处理 数据采用SPSS10.0, t检验及χ2检验.
胃癌患者血清中黏蛋白MUC1、MUC2、MUC5AC和CEA的浓度分别为5.85±2.57 kU/L、4.46±2.47 kU/L、5.07±3.24 kU/L、8.52±3.36 µg/L; 对照组血清中黏蛋白MUC1、MUC2、MUC5AC和CEA的浓度分别为3.65±1.82 kU/L, 2.73±1.63 kU/L、3.16±1.57 kU/L、5.36±2.58 µg/L; 经t检验两组之间差异有统计学意义.
经统计学分析(χ2检验), MUC1与胃癌分期相关, 中晚期胃癌中阳性率高(P = 0.0047), MUC2、MUC5AC与胃癌分期无明显相关(P = 0.136, P = 0.201). 3种黏蛋白(MUC1、MUC2、MUC5AC)在患者血清中的表达与胃癌不同分化程度相关(P = 0.017, P = 0.036, P = 0.022), 均有随分化程度降低而阳性表达增高的趋势(表1).
| MUC1 | MUC2 | MUC5AC | 总计 | ||||
| + | - | + | - | + | - | ||
| Ⅰ | 1 | 4 | 2 | 3 | 3 | 2 | 5 |
| Ⅱ | 4 | 1 | 3 | 2 | 2 | 3 | 5 |
| Ⅲ | 5 | 2 | 6 | 1 | 4 | 3 | 7 |
| Ⅳ | 12 | 1 | 11 | 2 | 11 | 2 | 13 |
| 高分化与中分化 | 7 | 3 | 6 | 4 | 5 | 5 | 10 |
| 低分化与未分化 | 17 | 3 | 15 | 5 | 16 | 4 | 20 |
胃癌组中各种黏蛋白的阳性率分别为MUC1 73.3%、MUC2 73.3%、MUC5AC 66.6%, 各单一黏蛋白以及黏蛋白两两之间(每两种黏蛋白中, 至少有一种黏蛋白阳性)和联合诊(3种黏蛋白中, 至少有两种黏蛋白阳性)用于胃癌诊断的敏感性及特异性均较高, 其中单一黏蛋白中, MUC1的的敏感性和特异性最好, 分别达到81.5%、75.8%, 联合诊断的敏感性和特异性更是达到96.0%、82.9%(表2).
| 敏感度(%) | 特异度(%) | P | |
| MUC1 | 81.5 | 75.8 | 0.000 |
| MUC2 | 78.6 | 75.0 | 0.000 |
| MUC5AC | 74.1 | 69.7 | 0.001 |
| CEA | 71.4 | 68.8 | 0.002 |
| MUC1+MUC2 | 73.0 | 87.0 | 0.000 |
| MUC1+MUC5AC | 70.3 | 82.6 | 0.000 |
| MUC2+MUC5AC | 67.6 | 78.3 | 0.001 |
| 联合 | 96.0 | 82.9 | 0.000 |
自1990年以来, 黏蛋白基因不断地被发现, 关于其核心蛋白特性的研究近来亦倍受关注. 当机体发生病理改变时, 黏蛋白也随着病理变化而变化, 这种改变在肿瘤发生的早期和癌前病变中就可以表现出来. 研究这些黏蛋白的改变有可能在肿瘤的筛查和早期诊断及判断预后中发挥重要作用.
MUC1[4]是一种Ⅰ型跨膜蛋白, 高度糖基化(糖基化大于50%), 正常情况下主要表达于多种组织、器官中的上皮细胞近管腺腔面, 呈顶端表达, 极性分布, MUC1在肿瘤组织中多出现异常表达. MUC1基因在胃癌中的阳性表达率约为82.6%[4-5]. 有研究表明MUC1的阳性表达与胃癌病理类型相关[6], 而与分化程度及Lauren氏分型无关[7]. 多数研究认为MUC1的阳性表达率与胃癌TNM分期相关[8-9], MUC1的高表达多提示预后不良. 陈锡美 et al[10]应用RT-PCR方法对胃癌患者血清进行半定量检测, 结果胃癌患者外周血中MUC1阳性率44.6%; 其中具有淋巴结转移的阳性率73%, 其阳性率与TNM分期及淋巴结转移率正相关. 本实验通过蛋白芯片技术定量检测胃癌患者及正常对照组血清MUC1水平, 结果显示两者之间差异显著, 胃癌组阳性率达到73%, 且MUC1的阳性表达与TNM分期相关, 中晚期胃癌MUC1阳性率较早期胃癌升高, 这与多数研究结果相似. 本实验还发现MUC1的表达与分化程度相关(P<0.01), 分化程度差的肿瘤高表达. 这些结果表明血清MUC1高含量可能预示该患者预后不佳. 以血清MUC1作为肿瘤标志物用于胃癌诊断, 灵敏度为81.5%, 特异度为75.8%, 对于胃癌诊断有一定的临床应用价值.
MUC2基因是1989年由美国学者Aubert et al[11]从人小肠cDNA文库中克隆到的一种黏蛋白核心肽基因, 编码一种分泌型黏液基因蛋白, 正常胃黏膜无MUC2表达. 王立顺 et al[12]研究证实MUC2的表达与胃癌病理类型明显相关, 在腺癌及肠型恶性程度较低的组织中呈强阳性表达, 在黏液癌及弥漫性恶性程度较高的癌组织中呈弱表达. 且MUC2表达与胃癌分化程度负相关, 即中高分化强表达, 低分化弱表达, 但与TNM分期无明显关系[13]. MUC2的高阳性表达率与胃癌好的预后相关, 这可能是由于MUC2中富含半胱氨酸区域, 在控制细胞增生中起作用并导致MUC2阳性表达患者具有低度恶性潜在性[14]. 但血清MUC2水平与胃癌关系尚不清楚, 本研究结果显示胃癌组与正常对照组血清MUC2水平之间差异显著, 胃癌组血清MUC2水平高于对照组(P<0.01), MUC2水平与胃癌分期无明显关系(P>0.05), 这与文献报道相似, 但本实验结果却发现MUC2表达在低未分化时高表达, 提示不良预后, 并未表现出高表达时预后好, 可能与样本数量较少有关. 本研究显示血清MUC2用于胃癌诊断时, 灵敏度为78.6%, 特异度为75.0%, 在诊断中具有重要参考价值.
MUC5AC是一种分泌型黏蛋白, 最早由法国学者Crepin从人支气管cDNA文库克隆成功[15], 后又在人胃cDNA文库克隆到该基因. 他在正常胃黏膜浅表1/3范围内广泛表达, 在不典型增生及胃癌组织中表达率下降[16-17], 在胃癌演进过程中下调表达, 说明黏蛋白表达的大量丧失与胃癌发生相关. 冯美燕 et al[18]报道在胃癌的癌前病变及癌症发生早期MUC5AC的异常表达就已经发生, 可以考虑应用其抗体或与其他因子联合检测用于胃癌的早期诊断. Machado et al[19]研究发现, 胃癌组织中MUC5AC的表达与肿瘤的组织学类型、TNM分期无关, 而与Lauren分型有关[20]. 黄文斌 et al[21]报道MUC5AC在早期胃癌的阳性率要明显高于进展期胃癌(P<0.01). 我们的研究结果显示胃癌组血清MUC5AC含量高于正常对照组(P<0.05), 但与胃癌TNM分期无关(P>0.05), 早晚期胃癌之间MUC5AC的阳性率无明显差异, 但随分化程度降低MUC5AC的表达有增高趋势, 表明MUC5AC的高表达预示着胃癌的分化程度较好, 可能有较好预后.
目前已经有多种肿瘤标志物在临床诊断中得到广泛应用, 比如常用的对腺癌较为特异性的标志物为CA19-9、CA15-3、CA-125、CA72-4等. CEA在胃癌患者血清中的灵敏度为 13%-35.7%, CA72-4的敏感性为31.3%-45.1%, CA19-9的敏感性为31.5%-68%[22-24]. 但是同一种肿瘤可能产生多种肿瘤标志物, 单一指标检测似乎始终存在特异性不强、阳性率较低等不足, 合理地选择多种肿瘤标志物进行联合检测可以提高诊断的准确性. 在我们的实验中, 单一黏蛋白标志物在胃癌诊断中虽有不错的灵敏度及特异度, 但考虑到同一胃癌患者血清中不同黏蛋白表达的差异性, 联合检测多种黏蛋白的血清水平用于联合诊断中可望提高诊断的灵敏度及特异度, 有望在胃癌的筛查及早期诊断中发挥重要作用.
蛋白质芯片技术的应用使得对数以千计的蛋白质进行高通量、平行分析成为可能. 我们应用蛋白芯片技术, 成功对MUC1、MUC2、MUC5AC 3种黏蛋白在胃癌中的表达谱进行了研究, 取得了一定结果, 为进一步阐明有关问题, 应继续研究更多的黏蛋白在血清中的表达谱, 这样可以适当提高各黏蛋白的诊断标准, 以降低误诊率, 同时通过联合诊断降低漏诊率. 另外, 应监测黏蛋白在手术前后和放、化疗中的动态变化, 以探讨其作为检测指标在判定手术及放、化疗效果中的意义. 从临床应用的角度来说, 由于蛋白芯片技术尚处于发展的初级阶段, 仍有很多环节需要突破性进展, 在检测技术方面还需要进一步完善.
胃癌是我国主要恶性肿瘤之一, 每年死亡约16万人, 占恶性肿瘤死亡的23.03%. 从20世纪初开始, 人们不断研究新的诊断手段, 希望达到早期性、普查性、无创性的诊断目的, 但是单一肿瘤标志物, 因其特异性差和较高的漏诊率, 决定了他只能作为辅助诊断和术后复发的指标. 应用蛋白芯片技术, 进行多种黏蛋白表达谱的联合研究, 用于胃癌的诊断指标, 具有较高的研究和临床应用价值.
熊斌, 教授, 武汉大学中南医院肿瘤科.
应用蛋白芯片技术同时检测胃癌患者和健康志愿者血清中MUC1、MUC2、MUC5ACA的含量, 探讨其用于针对胃癌筛查和特异性诊断指标的可行性成为研究热点和重点.
国内外对MUC1、MUC2、MUC5AC在胃癌组织中表达的规律及意义研究比较集中, 但定量检测血清中各种黏蛋白浓度用于恶性肿瘤诊断的研究尚不多见, 刘洪一对定量检测血清中各种黏蛋白浓度用于胰腺癌的诊断进行了研究, 认为3种黏蛋白(MUC1、MUC2、MUC5AC)联合检测可以提高胰腺癌诊断的敏感性及特异性.
应用蛋白芯片技术检测血清中多种黏蛋白含量用于胃癌诊断的肿瘤标志物, 可以克服单一肿瘤标志物特异性差和漏诊率高的缺点, 有利于提高临床中胃癌的早期诊断率, 有较好的临床应用前景.
本文引言包括了该研究的目的和其他相关研究的关系, 科学结论较明确, 实验证据充足, 讨论条理分明, 参考文献恰当充分. 文章有一定的科学性、创新性和可读性, 较好地反映了我国或国际胃肠病学临床和基础研究的水平.
编辑: 李军亮 电编:吴鹏朕
| 1. | Corfield AP, Carroll D, Myerscough N, Probert CS. Mucins in the gastrointestinal tract in health and disease. Front Biosci. 2001;6:D1321-D1357. [PubMed] [DOI] |
| 2. | Moniaux N, Escande F, Porchet N, Aubert JP, Batra SK. Structural organization and classification of the human mucin genes. Front Biosci. 2001;6:D1192-D1206. [PubMed] [DOI] |
| 3. | Sternberg LR, Byrd JC, Yunker CK, Dudas S, Hoon VK, Bresalier RS. Liver colonization by human colon cancer cells is reduced by antisense inhibition of MUC2 mucin synthesis. Gastroenterology. 1999;116:363-371. [PubMed] [DOI] |
| 6. | Taylor KL, Mall AS, Barnard RA, Ho SB, Cruse JP. Immunohistochemical detection of gastric mucin in normal and disease states. Oncol Res. 1998;10:465-473. [PubMed] |
| 7. | Tajima Y, Shimoda T, Nakanishi Y, Yokoyama N, Tanaka T, Shimizu K, Saito T, Kawamura M, Kusano M, Kumagai K. Gastric and intestinal phenotypic marker expression in gastric carcinomas and its prognostic significance: immunohistochemical analysis of 136 lesions. Oncology. 2001;61:212-220. [PubMed] [DOI] |
| 8. | Baldus , ZirbesTK , Engel S, Hanish FG, Lorenzen J, Glossmann J, Fromm S, Thiele J, Pichlmaier H, Dienes HP. Correlation of the immunohistochemical reactivity of mucin peptide cores MUC1 and MUC2 with the histopathological subtype and prognosis of gastric carcinomas. Int J Cancer. 1998;79:133-138. [PubMed] |
| 9. | von Mensdorff-Pouilly S, Snijdewint FG, Verstraeten AA, Verheijen RH, Kenemans P. Human MUC1 mucin: a multifaceted glycoprotein. Int J Biol Markers. 2000;15:343-356. [PubMed] |
| 11. | Aubert JP, Porchet N, Crepin M, Duterque-Coquillaud M, Vergnes G, Mazzuca M, Debuire B, Petitprez D, Degand P. Evidence for different human tracheobronchial mucin peptides deduced from nucleotide cDNA sequences. Am J Respir Cell Mol Biol. 1991;5:178-185. [PubMed] |
| 13. | Akyurek N, Akyol G, Dursun A, Yamac D, Guenl N. Expression of MUC1 and MUC2 mucins in gastric carcinomas: their relationship with clinicopathologic parameters and prognosis. Pathol Res Pract. 2002;198:665-674. [PubMed] [DOI] |
| 14. | Cornberg M, Enss ML, Wagner S. Differential mucin expression in the gastrointestinal tract. Z Gastroenterol. 2001;39:369-376, 378. [PubMed] |
| 15. | Rens CA, David L, Carvalbo F, Mandel U, Mirgorodskaya E, Clausen H, Sobrinho-Simoes M. Immunohistochemical study of the expression of MUC6 mucin and co-expression of other secreted mucins (MUC5AC and MUC2) in human gastric carcinomas. J Histochem Cytochem. 2000;48:377-388. [PubMed] |
| 16. | Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Mucin gene expression in normal, preneoplastic, and neoplastic human gastric epithelium. Cancer Res. 1995;55:2681-2690. [PubMed] |
| 18. | Machado JC, Nogucira AM, Carneiro F, Reis CA, Sobrinho-Simoes M. Gastric carcinoma exhibits distinct types of cell differentiation: an immunohistochemical study of trefoil peptides (TFF1 and TFF2) and mucins (MUC1, MUC2, MUC5AC, and MUC6). J Pathol. 2000;190:437-443. [PubMed] [DOI] |
| 19. | Lau SK, Weiss LM, Chu PG. Differential expression of MUC1, MUC2, and MUC5AC in carcinomas of various sites: an immunohistochemical study. Am J Clin Pathol. 2004;122:61-69. [PubMed] [DOI] |
| 22. | Nakajima K, Ochiai T, Suzuki T, Shimada H, Hayashi H, Yasumoto A, Takeda A, Hishikawa E, Isono K. Impact of preoperative serum carcinoembryonic antigen, CA 19-9 and alpha fetoprotein levels in gastric cancer patients. Tumour Biol. 1998;19:464-469. [PubMed] [DOI] |
| 23. | Ychou M, Duffour J, Kramar A, Gourgou S, Grenier J. Clinical significance and prognostic value of CA72-4 compared with CEA and CA19-9 in patients with gastric cancer. Dis Markers. 2000;16:105-110. [PubMed] |