修回日期: 2008-03-29
接受日期: 2008-04-21
在线出版日期: 2008-04-28
目的: 观察柴胡皂甙D(saikosaponin-d, SSd)对大鼠肝脏癌变过程中环氧化酶-2(cycloxygenase-2, COX-2)、血管内皮细胞生长因子(vascular endothelial cell growth factor, VEGF)及CD34表达的调节作用, 并探讨其与SSd抗肝肿瘤作用的关系.
方法: 清洁级雄性SD大鼠90只, 随机分为5组: 模型组(n = 20), 对照组(n = 10)与SSd大、中、小剂量治疗组(各组n = 20). 对照组给予(ig)等量生理盐水, 其余各组大鼠均给予(ig)2 g/L二乙基亚硝胺(DEN, 10 mg/kg), 每周5次, 同时各治疗组每天腹腔注射不同浓度SSd(2.0, 1.5, 1.0 mg/kg), 至16 wk停药. 分别于第6、12、16周处死大鼠, HE染色观察实验大鼠各期肝组织病理学结构的改变, 免疫组化检测大鼠肝脏癌变过程中COX-2、VEGF及CD34的表达.
结果: 实验第6、12、16周, 单纯造模组大鼠呈现典型的肝细胞损伤、增生硬化和肝癌形成的病理变化. SSd各治疗组大鼠癌结节数及灶的大小均小于模型组. 镜下单纯造模组癌细胞呈多形性, 异形性明显; 相反, SSd各干预组癌细胞分化程度高, 异形性较低. 免疫组化结果显示COX-2、VEGF及CD34均在诱癌早期表达较少, 肝癌期表达明显增强. SSd干预后, 肝癌形成期COX-2、VEGF及CD34表达的抑制作用最明显, 与单纯造模组相比差异显著(P<0.05或P<0.01); COX-2与VEGF(r = 0.815, P<0.01), VEGF与MVD(r = 0.862, P<0.01)以及COX-2与MVD(r = 0.726, P<0.01)的表达均明显正相关.
结论: SSd对实验性大鼠肝癌形成具有一定的抑制作用, 其作用机制可能与SSd下调肝肿瘤中COX-2的表达, 抑制VEGF的活性有关.
引文著录: 王宝峰, 程延安, 王西京, 刘振国, 马红兵, 白明华, 党双锁, 贾晓黎. 柴胡皂甙D对实验性大鼠肝癌血管形成的抑制作用. 世界华人消化杂志 2008; 16(12): 1273-1280
Revised: March 29, 2008
Accepted: April 21, 2008
Published online: April 28, 2008
AIM: To investigate the effect of saikosaponin-d (SSd) on the expressions of cycloxygenase-2 (COX-2), vascular endothelial cell growth factor (VEGF) and CD34 during hepatocellular carcinogenesis induced by diethylinitrosamine (DEN).
METHODS: Ninety male SD rats were randomly divided into 5 groups: control group (n = 10), model group (n = 20) and three treatment groups (n = 20 in each group). Except for the control group, the other groups were administered (ig) with 2 g/L DEN at a dose of 10 mg/kg body weight (5 times/wk for 16 wk). At the same time, the rats in the treatment groups were injected intraperitoneally with SSd at different doses (1.0, 1.5 and 2.0 mg/kg) once per day for 16 wk. The rats were anesthetized and killed at 6, 12, and 16 wk. Hematoxylin and eosin (HE) staining was used to examine the changes of liver pathology and the expression of COX-2, VEGF and CD34 in liver tissues were dynamically monitored by SABC immunohistochemistry.
RESULTS: During 6, 12, and 16 wk of experiment, typical pathological changes such hepatocyte injury, hyperplasia, cirrhosis, and carcinogenesis appeared in the rats of model group. Both the volume and the number of tumors were significantly reduced in 3 SSd treatment groups. Under microscope, the cancer cells in the rats of model group showed polymorphic and abnormal shape. In contrast, the cancer cells in the rats of SSd treatment groups were well differentiated. Immunohistochemistry demonstrated that the expression of COX-2 and VEGF and the value of microvessel density (MVD) in the model group were low in the early stage of carcinogenesis, but they were all remarkably increased in the stage of carcinoma. Whereas, the expression of COX-2 and VEGF and MVD value were all reduced in every stage of carcinogenesis after SSd treatment, especially in the stage of carcinoma after high-dose SSd treatment. There was a highly positive correlation between COX-2 and VEGF expression (r = 0.815, P < 0.01), VEGF expression and MVD value (r = 0.862, P < 0.01) and between COX-2 expression and MVD value (r = 0.726, P < 0.01).
CONCLUSION: SSd has inhibitory effect on the angiogenesis during DEN-induced hepatocarcinogenesis in rats, which may be related to the down-regulation of COX-2 expression and VEGF activity.
- Citation: Wang BF, Cheng YA, Wang XJ, Liu ZG, Ma HB, Bai MH, Dang SS, Jia XL. Inhibitory effect of saikosaponin-d on the angiogenesis of experimental hepatocarcinoma in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(12): 1273-1280
- URL: https://www.wjgnet.com/1009-3079/full/v16/i12/1273.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i12.1273
肝细胞肝癌(hepatocellular carcinoma, HCC)术后复发和转移率极高, 血管形成丰富为其特点, 因此抑制血管形成在抗肝肿瘤的研究中意义重大. 环氧化酶-2(cycloxygenase-2, COX-2)是一种诱导酶, 有诱导肿瘤血管生成的特性, 与肝癌的发生、发展、浸润、转移及血管形成有密切关系[1-4]. 柴胡皂甙D(saikosaponin-d, SSd)是从传统中药柴胡中提取的有效单体成分, 具有明显抑制肝肿瘤细胞生长、促凋亡及抑制肿瘤细胞分泌COX-2蛋白的作用[5-7]. 因此, 本研究通过动态检测SSd对大鼠肝脏癌变过程中COX-2、血管内皮细胞生长因子(vascular endothelial cell growth factor, VEGF)及CD34表达的调节作用, 初步探讨SSd抑制血管形成与其抗肝癌作用的关系.
二乙基亚硝胺, 纯度>0.99 kg/L(Sigma公司), 柴胡皂甙D(SSd, 江西本草天工科技有限责任公司), 二甲基亚砜(DMSO, Sigma公司), VEGF、COX-2、CD34均为兔抗鼠多克隆抗体, VEGF购自北京中山生物公司, COX-2、CD34、SABC试剂盒及DAB显色剂均购自武汉博士德生物公司, 图像信号采集分析系统(QWin550CW, Leica), 架盘药物天平(北京医用天平厂), 电热三用水箱(北京市医疗设备厂), 台式高速离心机(上海安亭科学仪器厂), 自动石蜡包埋机(Leitz, Germany), 组织切片机(RM2135, Leica), 隔水式电热恒温干燥箱(上海医疗器械厂).
90只♂清洁级SD大鼠, 平均体质量248.18±12.32 g, 由西安交通大学医学院动物实验中心提供. 将大鼠随机分为5组: 正常对照组10只, 肝癌模型组及SSd大、中、小剂量治疗组每组各20只. SSd溶液的配制: 称取SSd 40、30、20 mg, 分别溶于DMSO 3 mL中, 静止10 min, 然后用生理盐水稀释至100 mL, 避光保存; 2 mg/L DEN溶液的配制: 500 mL生理盐水加1 mL DEN, 振荡混匀, 避光保存.
1.2.1 造模: 模型组与治疗组均给予2 mg/L DEN ig, 按体质量10 mg/kg给药, 每只1.5-2.0 mL/d, 5次/wk, 至16 wk停药, 对照组给予等量生理盐水ig; 造模同时, 治疗组大鼠分别给以不同浓度SSd ip(按0.50 mL/100 g)干预, 1 次/d, 共16 wk. 每天观察动物的精神状态、饮食状况及背毛等一般情况的变化, 1 次/wk称体质量, 记录1次进水量和进食量. 灌胃给药严格遵循操作规则及剂量要求, 减少由操作不当引起的动物死亡. 分别于第6、12、16周麻醉后处死动物.
1.2.2 免疫组化: SABC法检测大鼠肝脏癌变过程中COX-2、VEGF及CD34的表达. 参考SABC试剂盒说明书, 三种因子临用前按1:50比例稀释, 检测时均用PBS液代替一抗作阴性对照.
1.2.3 判断标准: COX-2染色阳性以细胞质内出现棕黄色颗粒状染色为标准, 参照文献[8]并加以改进后采用半定量积分法, 即对每张切片的阳性细胞(基本不着色、着色淡、着色适中、着色强)及阳性细胞率(≤5%, 6%-30%, 31%-70%, ≥71%)分别计分为0, 1, 2, 3然后根据两项评分之和判断结果: 0-2分为阴性(-), 3-4分为阳性(+), ≥5分为强阳性(++). VEGF阳性判定标准参照有关文献[9]. 以细胞质内出现棕黄色颗粒状染色为阳性标准, 高倍镜下(×400)对每张切片随机选取5个视野, 每个视野计数200个细胞, 共计1000个, 计算阳性细胞的百分数. MVD的测定参照Weidner et al[10]的方法: (1)CD34阳性以血管内皮细胞胞质内出现棕黄色颗粒状染色为标准; (2)微血管计数以被染成棕黄色的单个内皮细胞或内皮细胞簇作为1个血管计数. 只要结构不相连, 其分支结构也计作一个血管计数(肌层较厚以及管腔面积大于8个红细胞直径的不计数). (3)先在低倍(×40)下观察切片, 选择微血管分布最高密度区; 然后在高倍(×200)计数5个视野的微血管数, 取其平均值为该例的MVD值, 分辨不清或染色模糊的细胞不计入计数结果.
统计学处理 采用SPSS13.0统计软件包进行统计分析, 根据资料的性质和数据类型分别用t检验、方差分析及卡方检验, 相关性检验用Spearman等级相关分析, 显著性水平α≤0.05.
实验开始时, 各组大鼠进食、饮水好, 喜活动, 背毛柔顺、有光泽. 模型组在第4周死亡1只, 经病理确诊死亡原因为肝细胞的中毒坏死、肺部感染, 死前背毛倒竖、无光泽, 精神萎靡, 活动减少, 体质量明显下降. 治疗组无1例死亡; 8-10 wk模型组及中、小剂量治疗组各死亡2只, 经病理确诊均有肝硬化形成, 死前除精神差, 活动减少外, 其他无异常表现; 14-16 wk模型组死亡3只, 治疗组各死亡1只(表1), 经病理确诊为肝癌, 死前精神萎靡, 进食较差, 活动减少, 背毛倒竖, 但体质量无明显变化, 其中2例解剖发现腹腔大量出血, 1例可见大量腹水形成伴肝癌肺部转移, 1例可见肠胀气并与肝脏粘连未见转移; 实验结束时, 除SSd大剂量治疗组有两例未见肝癌形成外, 其他各治疗组及模型组均可见明显的肝癌形成. 提示SSd能够减轻造模大鼠早期的中毒症状, 降低大鼠死亡率, 抑制肝癌的形成与发展.
| 空白对照组 | 单纯造模组 | SSd | |||
| 大剂量组 | 中剂量组 | 小剂量组 | |||
| n | 10 | 20 | 20 | 20 | 20 |
| 死亡n(%) | 0(0) | 6(30.0) | 1(5.0) | 3(15.0) | 3(15.0) |
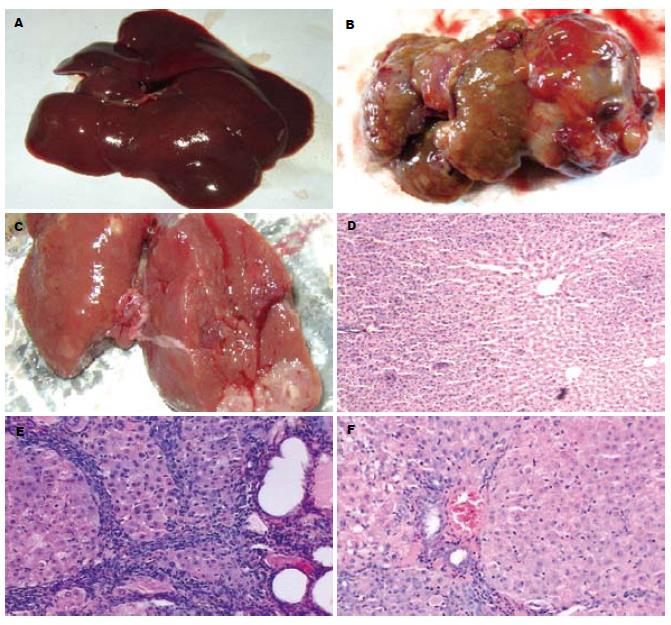
正常对照组大鼠肝脏表面光滑, 色淡红, 边缘锐利, 质地软. 随着诱癌过程的进行, 实验经历肝炎、肝硬化阶段进而形成肝癌. 实验结束时, 单纯造模组大鼠肝脏表面粗糙, 可见多个大小不一的灰白色癌结节, 最大者1.5 cm×1.0 cm×0.8 cm, 切面呈结节状, 可见出血和坏死, 癌周肝脏常伴有结节或肝硬化改变; 相反, SSd各治疗组癌结节数及灶的大小均小于对照组, 其中SSd大剂量治疗组有两例未见肝癌形成(图1A-C). 镜下观: 对照组大鼠肝小叶结构完整, 肝细胞索排列整齐, 细胞核清晰. 单纯造模组正常肝小叶结构被破坏, 大体观白色结节处为肝癌细胞, 瘤细胞呈多形性, 异形性明显, 胞核增大, 胞质少, 嗜碱性. 根据Edmondson分级法[11]多数属于Ⅲ级; 相反, SSd各干预组镜下癌细胞分化程度高, 异型性低, 分级多为Ⅰ-Ⅱ级(图1D-F), 提示SSd能够抑制肝癌的形成与发展.
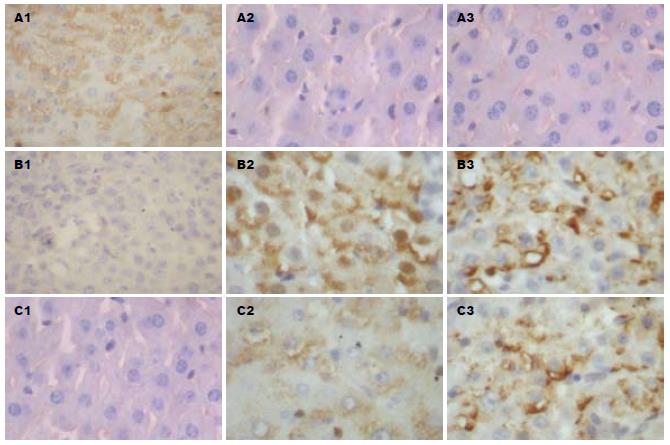
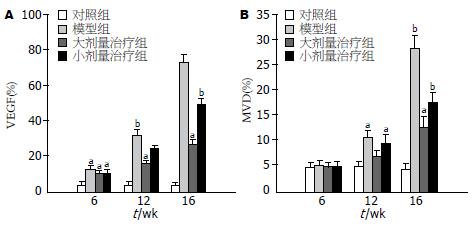
诱癌早、中期, 单纯造模组中可见COX-2蛋白的微弱表达, 相应SSd各治疗组中COX-2蛋白的表达较单纯造模组有所下降, 但无统计学差异; 诱癌晚期单纯造模组中COX-2蛋白的表达明鲜增强(图2A1), 与早、中期单纯造模组COX-2蛋白的表达相比差异显著(P<0.001, 表2), 相应SSd各治疗组中COX-2蛋白的表达均较单纯造模组明显下降, 以SSd大、中剂量组效果最明显(图2B1), 与单纯造模组相比(P<0.01), 但SSd大、中剂量间无显著性差异(P>0.05), 在正常肝脏中未见COX-2蛋白的表达(图2C1). VEGF在正常肝脏中及诱癌早期阶段表达均较少, 分别为(3.9±1.5, 12.8±3.2, 图2A2), 随着诱癌过程的进行, 表达增强, 晚期肝癌组织中VEGF呈弥漫性表达(图2B2), 单纯造模组中、晚期VEGF的表达分别为(31.9±4.2, 72.8±10.6), 较正常肝脏及诱癌早期阶段表达均明显增强(P<0.001, 图3A); SSd大、中、小剂量干预组中, 诱癌早期VEGF表达分别为(10.3±2.2, 11.2±3.1, 10.6±2.6), 和单纯造模组相比无统计学差异. 相反, 诱癌中、晚期各干预组VEGF的表达分别为(16.1±2.1, 17.4±3.9, 24.6±5.2; 27.2±11.5, 30.5±9.7, 48.9±12.3), 均较单纯造模组明显下降(P<0.05, P<0.01).
| 分组 | 诱癌早、中期 | 诱癌晚期 | ||||||
| n | - | + | ++ | n | - | + | ++ | |
| 模型组 | 8 | 3 | 3 | 2 | 12 | 1 | 5 | 6 |
| SSd大剂量组 | 10 | 5 | 4 | 1 | 10 | 4 | 5 | 1 |
| SSd中剂量组 | 8 | 4 | 2 | 2 | 12 | 3 | 5 | 4 |
| SSd小剂量组 | 8 | 3 | 4 | 1 | 12 | 3 | 4 | 5 |
CD34在正常大鼠肝脏及诱癌早期肝组织中表达量极低, MVD分别为(4.8±1.1, 5.4±1.6), 组间无差异性. 在诱癌中期表达增加, 诱癌晚期表达最明显, MVD分别为(10.7±2.1, 28.4±4.5)(图2A3、B3, 图3B); SSd干预后, 对早期CD34在大鼠肝组织中的表达几乎无影响, 和单纯造模组相比无统计学差异. 诱癌中、晚期, SSd大、中、小剂量组MVD分别为(7.2±3.0, 8.4±1.5, 9.6±2.2; 12.8±4.9, 14.9±3.7, 17.8±5.4)均较单纯造模组有不同程度减少, 其中SSd大剂量组抑制血管生成作用最明显(P<0.05, P<0.01. 图2C3, 图3B).
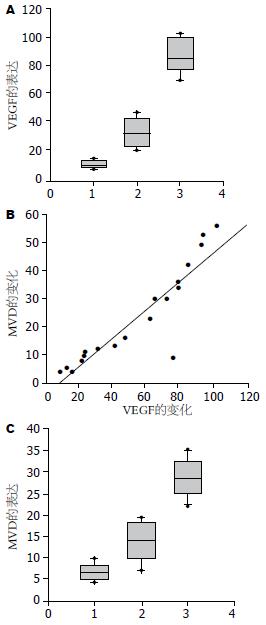
相关分析显示, 在大鼠肝脏癌变过程中, COX-2与VEGF(r = 0.815, P<0.01), VEGF与MVD(r = 0.862, P<0.01)以及COX-2与MVD(r = 0.726, P<0.01)的表达均明显正相关(图4).
DEN具有很强的化学毒性, 所含的亚硝胺基因具有中毒剂和诱癌剂的双重效应[12], 并且其诱发的肿瘤多为肝细胞癌, 和人肝细胞癌比较相似. 我们每周5次给予SD大鼠2 mg/L DEN, 按体质量10 mg/kg给药, 由于我们精确控制给药剂量, 减少了实验早期DEN对大鼠的毒性, 实验早期仅死亡1只大鼠, 降低了早期实验大鼠的死亡率. 实验经历肝炎、肝硬化阶段进而形成肝癌, 很好的模拟了人肝癌的发生、发展过程. 诱癌16 wk后, 病理结果证实大鼠肝癌形成, 所诱发出的肝癌多数是结节型肝癌, 而人肝癌也是以结节型最为常见[13]. 因此, 通过间断小剂量DEN ig诱发肝肿瘤是一种经典的建立大鼠肝癌的模型.
造模同时, 我们给予SSd干预治疗, 发现SSd各治疗组大鼠饮食、精神、活动等一般情况变差, 均比单纯造模组出现的晚且程度较轻; 实验结束时共死亡大鼠13只, 其中模型组6只, SSd大剂量治疗组1只, 中、小剂量组各3只; 模型组, SSd大、中、小剂量组死亡率分别为30%、5%、15%、15%; 肉眼下SSd各治疗组癌结节数及灶的大小均小于对照组, 其中SSd大剂量治疗组有两例未见肝癌形成. 镜下可见单纯造模组正常肝小叶结构破坏, 瘤细胞呈多形性, 异形性明显, 胞核增大, 胞质少, 嗜碱性. 根据Edmondson分级法[11]多数属于Ⅲ级; 相反, SSd各干预组镜下癌细胞分化程度高, 异型性较低, 分级多为Ⅰ-Ⅱ级, 提示SSd具有抵抗DEN对大鼠的毒性作用, 抑制肝癌的形成与发展.
环氧化酶(cyclooxygenase, COX), 又称前列腺素内过氧化物合成酶(prostaglandin H synthase, PGHS), 是合成前列腺素(prostaglandin, PG)的一个关键限速酶. 目前发现, 哺乳动物中至少存在两种COX的异构酶: COX-1和COX-2. COX-1属于结构型基因, 在正常组织和细胞中稳定表达, 促进PG的产生, 参与机体多种生理功能的完成; 而COX-2是一种诱导型表达蛋白, 主要表达于核膜, 被认为是"快速反应基因"一般只在各种诱导因子如炎症因子、内毒素、肿瘤诱导剂等的诱导下迅速合成, 从而参与炎症、肿瘤等多种病理生理的发生、发展过程. 近年来研究表明, COX-2有诱导肿瘤血管生成的特性, 在许多癌前病变及恶性肿瘤中均表达增强, 被认为与肝癌的发生、发展、浸润、转移及血管形成有密切关系[1-4]. 肿瘤血管生成是肿瘤生长和转移的形态学基础, 他不仅为肿瘤提供充足的营养, 而且为转移的肿瘤细胞提供了通道. VEGF为分子质量为36-45 kDa的二聚体糖蛋白, 是目前己知最强烈的血管发生蛋白, 当与其受体(flt-1和KDR/flt-1)特异性结合后通过诱导血管内皮细胞增殖、增强血管通透性, 促进包括肝癌在内的多种肿瘤新生血管的形成及癌细胞的侵袭和转移[14].
我们在建立大鼠肝癌模型基础上, 全程检测其癌变过程中COX-2与VEGF的动态变化. 结果显示, 正常肝脏组织中未见或者仅有少量COX-2与VEGF的阳性表达, 随着诱癌过程的进行, 肝脏中逐渐出现COX-2与VEGF的阳性表达, 并且表达逐渐增加, 肝癌形成时表达最明显, 提示COX-2与VEGF参与了大鼠肝癌的发生与发展过程; 另外, 在诱癌各期, 我们还全程检测了CD34标记的MVD值变化, 研究认为CD34标记的微血管是真正的新生肿瘤血管[15-16], 我们发现CD34在正常大鼠及诱癌早、中期肝组织表达量极低, 而在诱癌晚期即肝癌期表达明显增加(P<0.01); 同时我们发现, MVD值与COX-2及VEGF的表达明显正相关, 在COX-2表达阴性以及VEGF低表达时, CD34在肝组织中几乎不表达. 相反, 在COX-2表达阳性时, 且在VEGF高表达时MVD值明显增加(P<0.01); 说明COX-2和VEGF与肝癌的肿瘤血管生成有关, 与肝癌的恶性生物行为密切相关, 但两个分子在时间和空间上如何协同作用的机制还不清楚.
目前认为, COX-2的高表达使其催化花生四烯酸生成的前列腺素E2(PGE2)显著增多, PGE2通过与细胞表面的PGE2受体或通过核受体过氧化物酶体增殖物激活受体δ(peroxisome proliferator-activated receptor δ, PPARδ)直接进入核内, 诱导多种血管生长因子尤其是VEGF的表达, 促进了肿瘤血管生成. 同时, COX-2基因通过核受体(PPARδ)可直接作用于VEGF基因, 诱导VEGF mRNA和蛋白表达水平的上调[17-18], VEGF升高又可上调COX-2蛋白的表达和活性[19]. 从而使COX-2与VEGF之间形成一种正反馈调节, 共同促进了肿瘤血管的形成. 近年来, 自从Williams et al[20]初步证实COX-2选择性抑制剂可明显抑制野生型纤维母细胞VEGF的合成, 从而有效抑制血管形成以来, 越来越多的证据表明, 包括肝癌在内的多种恶性肿瘤中COX-2的高表达常伴有VEGF的高表达[21-22], COX-2可以使肿瘤中VEGF的表达上调[23-24], 抑制COX-2则可抑制VEGF的表达[25]. 由此推测VEGF可能是COX-2参与肿瘤血管生成的中介物质. HCC是人类最常见的一种血管性恶性肿瘤, 丰富而又扭曲的血管是其重要的特征, 结扎血管或栓塞血管可有效地治疗部分肝癌. 因此, 抑制COX-2的活性, 下调VEGF的表达, 从而减少血管形成在肝肿瘤的治疗中具有重要的现实意义.
本研究发现, 经SSd干预后, 诱癌早、中、晚各期COX-2、VEGF以及CD34的表达均较单纯造模组有所下降, 但以诱癌晚期即肝癌形成期SSd的抑制效果最明显, 与单纯造模组相比差异显著(P<0.01); 相应SSd对诱癌早、中期, 即肝细胞的变性坏死期与肝硬化期, COX-2、VEGF及CD34表达的抑制作用较弱, 其中, 诱癌早期SSd各治疗组中COX-2、VEGF与CD34的表达和单纯造模组相比无统计学差异(P>0.05); 因此, SSd对DEN诱导大鼠肝癌模型各期的血管形成均有抑制作用, 但对诱癌晚期即肝癌期的血管形成抑制作用最明显.
肝癌术后复发与转移率极高, 血管形成丰富为其特点, 目前尚缺乏有效的治疗方法. 实验模型提示诱导血管生成的能力在肿瘤发生的早期即表现出来, 是肿瘤的一种固有的生物属性, 肿瘤新生血管生成与恶性肿瘤的发生、发展和转移关系密切.
同行评价者
黄志勇, 副教授, 华中科技大学同济医院普外科.
探讨血管生成的机制及寻找血管生成抑制剂已经成为当前肿瘤防治研究的热点.
Nagatsuka et al报道在植入人结肠癌细胞株的小鼠中, COX-2抑制剂可阻抑VEGF的产生, 影响肿瘤组织血管形成. Lara-Pezzi et al报道在裸鼠肝转移模型上, COX-2抑制剂可抑制结肠癌细胞株产生MMP-2, 减弱肿瘤的侵袭力.
本文通过动态检测大鼠肝脏癌变过程中COX-2与VEGF的变化, 结果发现SSd对诱癌晚期即肝癌期的血管形成抑制作用明显, 而对诱癌早、中期即肝炎、肝硬化期的血管形成未见明显的抑制作用.
本研究表明柴胡皂甙D可能通过抑制肿瘤血管生成的效应, 达到靶向抗肝肿瘤治疗的目的, 有望成为一种新的毒副作用小的天然抗肝肿瘤药物投入临床应用, 具有良好的应用前景.
柴胡皂甙D(SSd): 是从传统中药柴胡中提取的有效单体成分, 具有糖皮质激素(GC)样甾环结构, 能够抑制花生四烯酸等代谢产物的生成,具有显著的抗炎、抗肿瘤作用.
本文立体新颖, 设计较合理, 对揭示柴胡皂苷D对肝癌的治疗作用及其机制有一定的科学意义.
编辑: 李军亮 电编:何基才
| 1. | Tang TC, Poon RT, Lau CP, Xie D, Fan ST. Tumor cyclooxygenase-2 levels correlate with tumor invasiveness in human hepatocellular carcinoma. World J Gastroenterol. 2005;11:1896-1902. [PubMed] |
| 2. | Rahman MA, Dhar DK, Yamaguchi E, Maruyama S, Sato T, Hayashi H, Ono T, Yamanoi A, Kohno H, Nagasue N. Coexpression of inducible nitric oxide synthase and COX-2 in hepatocellular carcinoma and surrounding liver: possible involvement of COX-2 in the angiogenesis of hepatitis C virus-positive cases. Clin Cancer Res. 2001;7:1325-1332. [PubMed] |
| 3. | Bae SH, Jung ES, Park YM, Kim BS, Kim BK, Kim DG, Ryu WS. Expression of cyclooxygenase-2 (COX-2) in hepatocellular carcinoma and growth inhibition of hepatoma cell lines by a COX-2 inhibitor, NS-398. Clin Cancer Res. 2001;7:1410-1418. [PubMed] |
| 4. | Soumaoro LT, Uetake H, Higuchi T, Takagi Y, Enomoto M, Sugihara K. Cyclooxygenase-2 expression: a significant prognostic indicator for patients with colorectal cancer. Clin Cancer Res. 2004;10:8465-8471. [PubMed] [DOI] |
| 5. | Hsu YL, Kuo PL, Chiang LC, Lin CC. Involvement of p53, nuclear factor kappaB and Fas/Fas ligand in induction of apoptosis and cell cycle arrest by saikosaponin d in human hepatoma cell lines. Cancer Lett. 2004;213:213-221. [PubMed] [DOI] |
| 6. | Chou CC, Pan SL, Teng CM, Guh JH. Pharma-cological evaluation of several major ingredients of Chinese herbal medicines in human hepatoma Hep3B cells. Eur J Pharm Sci. 2003;19:403-412. [PubMed] [DOI] |
| 7. | He SX, Luo JY, Zhao G, Xu JL, Wang YL, Fu H, Dong L. Effect of saikosaponins-d on cyclo-oxygenase-2 expression of human hepatocellular carcinoma cell line SMMC-7721. Zhonghua Ganzangbing Zazhi. 2006;14:712-714. [PubMed] |
| 8. | Gallo O, Franchi A, Magnelli L, Sardi I, Vannacci A, Boddi V, Chiarugi V, Masini E. Cyclooxygenase-2 pathway correlates with VEGF expression in head and neck cancer. Implications for tumor angiogenesis and metastasis. Neoplasia. 2001;3:53-61. [PubMed] [DOI] |
| 9. | Xie YH, Yuan MB. A relationship between cyclooxygenase-2 expression and tumor angio-genesis in experimental rat liver carcinogenesis. Zhonghua Ganzangbing Zazhi. 2006;14:676-679. [PubMed] |
| 10. | Weidner N, Semple JP, Welch WR, Folkman J. Tumor angiogenesis and metastasis--correlation in invasive breast carcinoma. N Engl J Med. 1991;324:1-8. [PubMed] |
| 11. | Edmondson HA, Steiner PE. Primary carcinoma of the liver: a study of 100 cases among 48, 900 necropsies. Cancer. 1954;7:462-503. [PubMed] [DOI] |
| 12. | Okubo H, Moriyama M, Tanaka N, Arakawa Y. Detection of serum and intrahepatic hepatocyte growth factor during DEN-induced carcinogenesis in the rat. Hepatol Res. 2002;24:385-394. [PubMed] [DOI] |
| 13. | Shimizu M, Iijima H, Horibe T, Yamada M, Suzuki S, Yanagisawa K, Seki T, Moriyasu F. Usefulness of contrast-enhanced ultrasonography with a new contrast mode, Agent Detection Imaging, in evaluating therapeutic response in hepatocellular carcinoma treated with radio-frequency ablation therapy. Hepatol Res. 2004;29:235-242. [PubMed] [DOI] |
| 14. | Toi M, Matsumoto T, Bando H. Vascular endothelial growth factor: its prognostic, predictive, and therapeutic implications. Lancet Oncol. 2001;2:667-673. [PubMed] [DOI] |
| 15. | Kim KW, Bae SK, Lee OH, Bae MH, Lee MJ, Park BC. Insulin-like growth factor II induced by hypoxia may contribute to angiogenesis of human hepatocellular carcinoma. Cancer Res. 1998;58:348-351. [PubMed] |
| 16. | Lin P, Buxton JA, Acheson A, Radziejewski C, Maisonpierre PC, Yancopoulos GD, Channon KM, Hale LP, Dewhirst MW, George SE. Antiangiogenic gene therapy targeting the endothelium-specific receptor tyrosine kinase Tie2. Proc Natl Acad Sci U S A. 1998;95:8829-8834. [PubMed] [DOI] |
| 17. | Seno H, Oshima M, Ishikawa TO, Oshima H, Takaku K, Chiba T, Narumiya S, Taketo MM. Cyclooxygenase 2- and prostaglandin E(2) receptor EP(2)-dependent angiogenesis in Apc(Delta716) mouse intestinal polyps. Cancer Res. 2002;62:506-511. [PubMed] |
| 18. | Glinghammar B, Skogsberg J, Hamsten A, Ehrenborg E. PPARdelta activation induces COX-2 gene expression and cell proliferation in human hepatocellular carcinoma cells. Biochem Biophys Res Commun. 2003;308:361-368. [PubMed] [DOI] |
| 19. | Tamura M, Sebastian S, Gurates B, Yang S, Fang Z, Bulun SE. Vascular endothelial growth factor up-regulates cyclooxygenase-2 expression in human endothelial cells. J Clin Endocrinol Metab. 2002;87:3504-3507. [PubMed] [DOI] |
| 20. | Williams CS, Tsujii M, Reese J, Dey SK, DuBois RN. Host cyclooxygenase-2 modulates carcinoma growth. J Clin Invest. 2000;105:1589-1594. [PubMed] [DOI] |
| 21. | Yuan A, Yu CJ, Shun CT, Luh KT, Kuo SH, Lee YC, Yang PC. Total cyclooxygenase-2 mRNA levels correlate with vascular endothelial growth factor mRNA levels, tumor angiogenesis and prognosis in non-small cell lung cancer patients. Int J Cancer. 2005;115:545-555. [PubMed] [DOI] |
| 22. | Liu J, Yu JP, Wang XL, Zhou XD, Yu HG. The role of cyclooxygenase-2 and vascular endothelial growth factor-C in lymphatic metastasis of gastric cancer. Zhonghua Neike Zazhi. 2004;43:841-844. [PubMed] |
| 23. | Beraza N, Marqués JM, Martínez-Ansó E, Iñiguez M, Prieto J, Bustos M. Interplay among cardiotrophin-1, prostaglandins, and vascular endothelial growth factor in rat liver regeneration. Hepatology. 2005;41:460-469. [PubMed] [DOI] |
| 24. | Cheng AS, Chan HL, To KF, Leung WK, Chan KK, Liew CT, Sung JJ. Cyclooxygenase-2 pathway correlates with vascular endothelial growth factor expression and tumor angiogenesis in hepatitis B virus-associated hepatocellular carcinoma. Int J Oncol. 2004;24:853-860. [PubMed] |
| 25. | Wu AW, Gu J, Li ZF, Ji JF, Xu GW. COX-2 expression and tumor angiogenesis in colorectal cancer. World J Gastroenterol. 2004;10:2323-2326. [PubMed] |