修回日期: 2008-03-13
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 观察对甲苯磺酰胺(para-toluenesul-fonamide, PTS)瘤内局部注射对大鼠移植性肝癌的治疗作用.
方法: 制作SD大鼠皮下移植性肿瘤模型, 将60只荷瘤大鼠随机分为4组, 即PTS组、无水乙醇组、乙酸组和对照组, 分别经皮瘤内注射330 g/L PTS、无水乙醇、500 mL/L乙酸和生理盐水, 观察大鼠肿瘤及心肝肺肾等组织病理变化、抑瘤率和生存时间.
结果: 330 g/L PTS、无水乙醇和500 mL/L乙酸均致肿瘤坏死, 无水乙醇组和乙酸组坏死区内可见残留癌细胞; PTS治疗14 d后肿瘤抑瘤率与无水乙醇组比较, 差别有统计学意义(74.4% vs 52.0%, P<0.05), 治疗21 d后肿瘤抑瘤率明显高于无水乙醇组和乙酸组, 差别有显著性(92.0% vs 68.7%, 75.9%, P<0.05); PTS组荷瘤大鼠生存时间与无水乙醇组和乙酸组比较, 明显延长(55±4.2 d vs 45±3.2 d, 46±2.2 d, P<0.05).
结论: 330 g/L PTS用于局部注射治疗大鼠移植性肝癌, 肿瘤消融效果优于无水乙醇和500 mL/L乙酸.
引文著录: 李民英, 孟辉, 周韶璋, 李虹义, 朱伟良, 张积仁. 瘤内注射对甲苯磺酰胺对大鼠肝癌的治疗作用. 世界华人消化杂志 2008; 16(11): 1232-1236
Revised: March 13, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To investigate the therapeutic effects of percutaneous para-toluenesulfonamide (PTS) injection on hepatocarcinoma in rats.
METHODS: Rat models with subcutaneous transplanted hepatocarcinoma were made, and then 60 tumor-bearing rats were randomly divided into 4 groups, subcutaneously injected with 330 g/L PTS, absolute alcohol, 500 mL/L acetic acid and normal saline, respectively. The pathological changes in tumor, heart, liver, lung and kidney tissues were observed, and tumor inhibition rate and survival time of tumor-bearing rats were compared between groups.
RESULTS: PTS, absolute alcohol and acetic acid caused the necrosis of cancer cells, but there were residual cancer cells in the necrosis areas of both absolute alcohol group and acetic acid group. On the 14th day after treatment in the PTS group, the tumor inhibition rate was higher than that in the absolute alcohol group (74.4% vs 52.0%, P < 0.05), and on the 21st day it was significantly higher than that in the absolute alcohol group or acetic acid group (92.0% vs 68.7%, 75.9%, P < 0.05). The mean survival time in the PTS group was significantly longer than that in the alcohol group or acetic acid group (55 ± 4.2 d vs 45 ± 3.2 d, 46 ± 2.2 d, P < 0.05).
CONCLUSION: Local injection of PTS at a concentration of 330 g/L has better effect in the treatment of hepatocarcinoma than absolute alcohol and 500 mL/L acetic acid in rats.
- Citation: Li MY, Meng H, Zhou SZ, Li HY, Zhu WL, Zhang JR. Effect of percutaneous para-toluenesulfonamide injection in treatment of hepatocarcinoma in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1232-1236
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1232.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1232
局部化学消融治疗肝癌, 具有侵袭性小、可在影像引导下经皮完成操作等优势, 近10多年来得到较大发展. 应用最为广泛的局部消融剂为无水乙醇和500 mL/L乙酸等, 但还存在肿瘤灭活不彻底导致局部复发, 或伴患者无法忍受的局部疼痛等不良反应, 因此, 人们仍在不断探索新的消融剂. 本实验应用330 g/L对甲苯磺酰胺(para-toluenesulfonamide, PTS)瘤内局部注射治疗大鼠肝癌, 评价其疗效, 为临床应用提供实验依据.
CBRH-7919大鼠肝癌细胞株和Balb/c(nu/nu)♂裸鼠均由中山大学医学部实验动物中心提供, Balb/c(nu/nu)♂裸鼠3只, 体质量18-22 g; ♂SD大鼠80只, 体质量180-220 g, 南方医科大学实验动物中心提供. 330 g/L PTS为北京健达康新药开发公司惠赠; 无水乙醇为广州洛辛宝化学试剂有限公司生产, 分析纯; 冰乙酸为广州市番禺力强化工厂生产, 分析纯; 100 g/L水合氯醛(动物麻醉用)为珠江医院制剂室制备.
1.2.1 造模: (1)收集培养的CBRH-7919鼠肝癌细胞, 调整细胞浓度为107/L, 取0.1 mL细胞悬液注入裸鼠背部皮下, 放置SPF级环境饲养, 7-10 d裸鼠背部长出直径为0.8-1.0 cm大小的肿瘤; (2)取出皮下肿瘤, 剔除筋膜, 选用其中鱼肉样部分, 加入生理盐水2 mL, 用眼科剪剪成糊状备用; (3)取SD大鼠, 参照程文 et al[1]的方法予以免疫抑制; (4)于全身照射当天, 采用100 g/L水合氯醛麻醉(5 mL/kg, ip), 80 g/L Na2S脱去背部体毛, 常规消毒, 用2 mL注射器将上述备用糊状肿瘤组织注入大鼠背部皮下, 每只注射0.1 mL, 放置清洁级环境饲养. 种植后2-3 wk大鼠背部皮下长出直径1 cm左右类圆形肿瘤, 形成大鼠皮下移植肿瘤模型.
1.2.2 分组及处理: 取荷瘤大鼠60只, 按随机表法将其随机分为PTS组、无水乙醇组、乙酸组和对照组, 每组15只.
用药前用精密游标卡尺测量肿瘤长径(a)和横径(b), 分别计算使肿瘤完全灭活所需要注射330 g/L PTS、无水乙醇和500 mL/L乙酸的总量. 330 g/L PTS注射总量计算公式采用我们预实验的结果: PTS注射总量Y(mL) = 4/3π[(a+b)/4]3×0.4. 无水乙醇和500 mL/L乙酸的注射总量计算公式按照文献[2]报道. 注射方式: 将总量均分3次瘤体内注射, 3天1次, 多点注射. 对照组瘤内注射生理盐水, 0.1 mL/次, 3天1次, 共3次.
1.2.3 观测指标: 各组随机抽取10只大鼠用于生存期的观察. 自首次用药当天起计算, 记录大鼠的生存天数, 观察截至期限为60 d. 同时, 用精密游标卡尺测量用药前和首次用药后第7、14、21天肿瘤最长径及横径. 按体积公式V = 4/3π[(a+b)/4]3计算肿瘤体积, 进行肿瘤抑制率的比较. 肿瘤抑制率 = (对照组肿瘤平均体积-实验组肿瘤体积)/对照组肿瘤平均体积×100%. 各组余下的5只大鼠, 于末次注射后24 h处死, 取出整个肿瘤及心、肝、肺、肾组织, 100 g/L甲醛溶液固定, 石蜡包埋, 制片, HE染色, 光镜下观察肿瘤组织及心肝肺肾组织的病理变化; 同时取肿瘤中央及周边组织, 25 g/L戊二醛溶液固定, 超薄切片, 透射电镜下观察肿瘤细胞的超微结构变化.
统计学处理 统一采用SPSS10.0统计软件进行处理, 计量资料用mean±SD表示; 多组间均数比较采用F检验, P<0.05差异有统计学意义; 采用Kaplan-Meier法进行生存时间分析.
荷瘤大鼠均可耐受治疗, 处理过程中无死亡. PTS组、无水乙醇组和乙酸组大鼠于用药当天均出现食欲差、行为迟缓、毛发耸立等, 第2天即恢复正常; 处理后对照组无异常表现, 但2-3 wk后因肿瘤增大而逐渐消瘦.
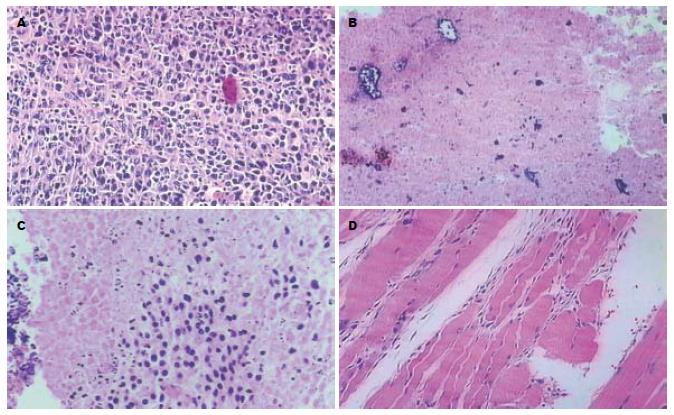
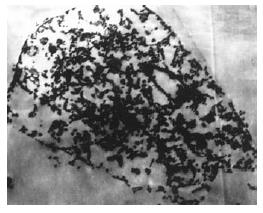
光镜下对照组瘤细胞染色深, 大小、形态不一, 核大深染, 异形性明显, 核分裂像多见, 肿瘤保持了原接种癌细胞的特点(图1A). PTS组、无水乙醇组和乙酸组肿瘤组织光镜下为均质红染的坏死; 其中PTS组5个样本均发生完全坏死(图1B); 无水乙醇组有4个样本坏死区周边可见肿瘤细胞残留, 乙酸组3个样本见肿瘤细胞残留(图1C-D). 电镜下PTS组肿瘤坏死区中心瘤细胞呈溶解样坏死, 基本为无结构的中等电子密度物质所取代; 边缘区细胞膜、核膜断续, 胞质明显空泡化, 细胞核染色质浓缩成块、边集(图2); 无水乙醇组和乙酸组肿瘤周边可见正常肿瘤细胞残留; 对照组瘤细胞膜性结构完整, 细胞器形态、结构良好. 光镜下心、肝、肺、肾组织未见病理改变.
用于生存期观察的各组荷瘤大鼠治疗前和治疗后7 d、14 d、21 d肿瘤体积大小(表1). 治疗前各组肿瘤体积无显著性差异, (P>0.05), 具有可比性. 治疗后7 d, PTS组、无水乙醇组、乙酸组肿瘤抑瘤率分别为29.3%、24.8%、25.6%, 3组间无显著性差别(P>0.05); 治疗后14 d肿瘤抑瘤率分别为74.4%、52.0%、60.2%, PTS组与乙酸组之间、乙酸组与无水乙醇组之间差别无显著性(P>0.05), 而PTS组与无水乙醇组之间差别有统计学意义(P<0.05); 治疗后21 d分别为92.0%、68.7%、75.9%, PTS组肿瘤抑制率明显高于无水乙醇组和乙酸组, 差别有显著性(P<0.05), 用药后21 d PTS组有5只大鼠肿瘤体积比治疗前缩小50%以上, 3只肿瘤完全消失; 无水乙醇组和乙酸组分别有1只和3只大鼠肿瘤缩小为治疗前的50%以上, 两组未见肿瘤完全消失.
| 分组 | 治疗前 | 治疗后 | ||
| 7 d | 14 d | 21 d | ||
| 对照组 | 0.585±0.15 | 1.273±0.34 | 3.474±0.78 | 6.717±0.78 |
| PTS组 | 0.679±0.14 | 0.899±0.13 | 0.889±0.44 | 0.534±1.00 |
| 无水乙醇组 | 0.648±0.10 | 0.957±0.16 | 1.670±0.59 | 2.106±0.83 |
| 乙酸组 | 0.654±0.12 | 0.947±0.16 | 1.381±0.64 | 1.623±1.10 |
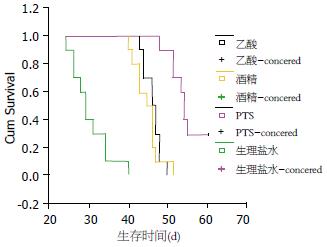
对照组、PTS组、无水乙醇组和乙酸组荷瘤大鼠生存时间分别为30±4.7 d、55±4.2 d、45±3.2 d和46±2.2 d. PTS组、无水乙醇组和乙酸组荷瘤大鼠生存时间与对照组相比均明显延长, 而PTS组大鼠生存期又明显长于无水乙醇组和乙酸组(P<0.05), 各组荷瘤大鼠生存曲线见图3.
目前经皮局部消融是无法手术切除的原发性肝癌的主要治疗方法之一. 其中, 最早应用于临床的经皮酒精注射(percutaneous ethanol injection, PEI), 始于1980年代[3-6], 系在超声引导下经皮穿刺将无水乙醇直接注入瘤灶内, 引起细胞脱水和蛋白质变性, 导致癌细胞发生凝固性坏死. 这一方法在临床上已得到广泛应用并取得了较好效果[7-11]. 但无水乙醇在组织内弥散难以确定边界, 对纤维分隔无效, 需要多次治疗, 增加患者痛苦, 甚至出现严重并发症, 单次大剂量注射又可增加死亡率[12]. 近期有文献[10,13-14]报道, PEI联合经肝动脉栓塞化疗(transcatheter arterial chemoembolization, TACE)或射频消融(radiofrequency ablation, RAF)治疗肝癌可提高疗效. 乙酸pH值低,能引起隔膜中的纤维肿胀, 破坏肿瘤内部的分隔. 文献资料显示其肿瘤灭活作用强于无水乙醇[15-17], 但其并发症也随之增加[18-19]. 至今, 仍无确切证据说明乙酸的安全性及有效性.
本实验结果显示, 无水乙醇和500 mL/L乙酸治疗大鼠肝肿瘤, 均取得了明显疗效, 但部分瘤体内仍有肿瘤细胞残留. 分析其原因, 一方面考虑两者在消融效力上可能存在不足, 另一方面不排除本实验使用普通注射针头注射药物导致药物在瘤体内呈偏心弥散的可能.
330 g/L对PTS注射液是以对甲苯磺酰胺(PTS)为活性成分的一种新的抗肿瘤药物和致肿瘤坏死制剂, 分子式为C7H9NO2S. 其突出优点是具有一定的克服肿瘤耐药作用和选择性地杀伤肿瘤细胞的特性[20]. 本实验结果显示, 瘤体内直接注射330 g/L对PTS注射液, 24 h后发现肿瘤组织呈现凝固性坏死, 坏死区内未见瘤细胞残留; 电镜观察肿瘤坏死区域中心瘤细胞呈溶解样坏死, 基本为无结构的中等电子密度物质所取代, 边缘区细胞质膜、核膜断续, 胞质明显空泡化, 细胞核染色质浓缩成块、边集. 从用药前后肿瘤体积大小来看, 用药后7 d、14 d, PTS组、无水乙醇组和乙酸组肿瘤体积比用药前都略有增大, 可能因肿瘤坏死后其周围出现炎性水肿而致. 用药后21 d, PTS组肿瘤体积较治疗前明显缩小, 有30%(3/10)肿瘤完全消失; 而此时, 无水乙醇组和乙酸组肿瘤体积仍大于治疗前体积, 且未见有肿瘤完全消退, 可能主要是由于肿瘤未能被彻底灭活的缘故. PTS组荷瘤大鼠治疗后生存期明显长于无水乙醇组和乙酸组.
总之, 330 g/L对PTS对大鼠肝肿瘤的灭活作用优于无水乙醇和500 mL/L乙酸. 采用他作为一种新的化学消融剂进行局部消融治疗肝肿瘤, 将具有良好的临床应用前景, 值得进一步深入研究.
肝癌是我国常见的恶性肿瘤之一, 手术切除是目前最有效的治疗手段, 但手术切除率低、复发率高. 因此, 非手术治疗方法治疗肝癌的研究有着极其重要的临床意义.
梁力建, 教授, 中山大学附属第一医院肝胆外科; 禄韶英, 主治医师; 西安交通大学医学院第一附属医院普外科
经皮酒精注射治疗肝癌疗效肯定、易于操作而经济, 已广泛应用于临床, 但其组织弥散能力有限, 需反复多次治疗, 且治疗效果不一. 为进一步提高疗效, 探索一种高效低毒的消融剂成为近年来局部化学消融治疗领域研究的热点和重点.
本研究重点观察PTS瘤内注射后肿瘤组织病理变化, 对其肿瘤消融效果进行初步评价.
PTS是一种新的抗肿瘤药物和致肿瘤坏死制剂,主要用药途径为瘤内注射, 局部消融效果好, 毒副作用小, 具有良好应用前景.
本文有一定的科学根据和说服力, 数据可靠, 结果是可信的.
编辑: 程剑侠 电编:郭海丽
| 3. | Tanikawa K. New therapy of hepatocellular carcinoma-topical infusion of ethanol guided by ultrasonics. Kango Gijutsu. 1985;31:1813-1814. [PubMed] |
| 4. | Livraghi T, Festi D, Monti F, Salmi A, Vettori C. US-guided percutaneous alcohol injection of small hepatic and abdominal tumors. Radiology. 1986;161:309-312. [PubMed] |
| 5. | Shiina S, Yasuda H, Muto H, Tagawa K, Unuma T, Ibukuro K, Inoue Y, Takanashi R. Percutaneous ethanol injection in the treatment of liver neoplasms. AJR Am J Roentgenol. 1987;149:949-952. [PubMed] |
| 6. | Livraghi T, Salmi A, Bolondi L, Marin G, Arienti V, Monti F, Vettori C. Small hepatocellular carcinoma: percutaneous alcohol injection-results in 23 patients. Radiology. 1988;168:313-317. [PubMed] |
| 7. | Sung YM, Choi D, Lim HK, Lee WJ, Kim SH, Kim MJ, Paik SW, Yoo BC, Koh KC, Lee JH. Long-term results of percutaneous ethanol injection for the treatment of hepatocellular carcinoma in Korea. Korean J Radiol. 2006;7:187-192. [PubMed] |
| 8. | Dettmer A, Kirchhoff TD, Gebel M, Zender L, Malek NP, Panning B, Chavan A, Rosenthal H, Kubicka S, Krusche S. Combination of repeated single-session percutaneous ethanol injection and transarterial chemoembolisation compared to repeated single-session percutaneous ethanol injection in patients with non-resectable hepatocellular carcinoma. World J Gastroenterol. 2006;12:3707-3715. [PubMed] |
| 9. | Ebara M, Okabe S, Kita K, Sugiura N, Fukuda H, Yoshikawa M, Kondo F, Saisho H. Percutaneous ethanol injection for small hepatocellular carcinoma: therapeutic efficacy based on 20-year observation. J Hepatol. 2005;43:458-464. [PubMed] |
| 10. | Luo BM, Wen YL, Yang HY, Zhi H, Xiao XY, Ou B, Pan JS, Ma JH. Percutaneous ethanol injection, radiofrequency and their combination in treatment of hepatocellular carcinoma. World J Gastroenterol. 2005;11:6277-6280. [PubMed] |
| 11. | Chen MS, Li JQ, Zheng Y, Guo RP, Liang HH, Zhang YQ, Lin XJ, Lau WY. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma. Ann Surg. 2006;243:321-328. [PubMed] |
| 12. | Livraghi T, Giorgio A, Marin G, Salmi A, de Sio I, Bolondi L, Pompili M, Brunello F, Lazzaroni S, Torzilli G. Hepatocellular carcinoma and cirrhosis in 746 patients: long-term results of percutaneous ethanol injection. Radiology. 1995;197:101-108. [PubMed] |
| 13. | Becker G, Soezgen T, Olschewski M, Laubenberger J, Blum HE, Allgaier HP. Combined TACE and PEI for palliative treatment of unresectable hepatocellular carcinoma. World J Gastroenterol. 2005;11:6104-6109. [PubMed] |
| 14. | Vallone P, Catalano O, Izzo F, Siani A. Combined ethanol injection therapy and radiofrequency ablation therapy in percutaneous treatment of hepatocellular carcinoma larger than 4 cm. Cardiovasc Intervent Radiol. 2006;29:544-551. [PubMed] |
| 15. | Hou C, Chen SC, Chang WY, Chen CH. Comparison of necrotic characteristics and benefits between 50% acetic acid and pure ethanol in local hepatic injection: a study in rats. Kaohsiung J Med Sci. 1999;15:414-418. [PubMed] |
| 16. | Ohnishi K, Yoshioka H, Ito S, Fujiwara K. Prospective randomized controlled trial comparing percutaneous acetic acid injection and percutaneous ethanol injection for small hepatocellular carcinoma. Hepatology. 1998;27:67-72. [PubMed] |
| 17. | Huo TI, Huang YH, Wu JC, Lee PC, Chang FY, Lee SD. Comparison of percutaneous acetic acid injection and percutaneous ethanol injection for hepatocellular carcinoma in cirrhotic patients: a prospective study. Scand J Gastroenterol. 2003;38:770-778. [PubMed] |
| 18. | Koda M, Tanaka H, Murawaki Y, Horie Y, Suou T, Kawasaki H, Ikawa S. Liver perforation: a serious complication of percutaneous acetic acid injection for hepatocellular carcinoma. Hepatogastroenterology. 2000;47:1110-1112. [PubMed] |
| 19. | Van Hoof M, Joris JP, Horsmans Y, Geubel A. Acute renal failure requiring haemodialysis after high doses percutaneous acetic acid injection for hepatocellular carcinoma. Acta Gastroenterol Belg. 1999;62:49-51. [PubMed] |