修回日期: 2008-02-29
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 探讨胃癌组织中p53和MDM2蛋白表达的相互关系.
方法: 47例石蜡包埋胃癌组织制成组织阵列, 应用免疫组织化学方法检测其p53和MDM2蛋白表达, 并运用统计软件SPSS11.5对两个蛋白之间的相互关系进行对应分析.
结果: p53与MDM2蛋白阳性表达率分别为34.0% (16/47)和42.5% (20/47). p53蛋白与MDM2蛋白表达呈负相关(P = 0.012).
结论: p53突变是胃癌发生发展中重要的一步, MDM2可能在胃癌的恶性增生过程中起重要作用.
引文著录: 李慧灵, 陈小艳, 刘芳, 黄作平, 褚红娟, 王辛, 张弓, 赵彤. 组织微阵列技术对胃癌组织p53和MDM2蛋白表达的同步检测与对应分析. 世界华人消化杂志 2008; 16(11): 1190-1193
Revised: February 29, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To investigate the correlation between the expression of p53 and MDM2 proteins in human gastric cancer.
METHODS: Tissue microarray and immunohistochemical method were used to detect the expression of p53 and MDM2 proteins in 47 patients with gastric cancer. The correlation between the two proteins was correspondingly analyzed using the SPSS11.5 software.
RESULTS: The positive rates of p53 and MDM2 protein expression were 34.0% (16/47) and 42.5% (20/47), respectively. MDM2 positive expression was predominant in the p53-negative samples and MDM2 negative expression corresponded to p53 positive expression (P = 0.012).
CONCLUSION: p53 mutation is a significant step in gastric carcinogenesis, during which MDM2 protein may take an active part.
- Citation: Li HL, Chen XY, Liu F, Huang ZP, Chu HJ, Wang X, Zhang G, Zhao T. Correspondence analysis and simultaneous detection of p53 and MDM2 protein expression in human gastric cancer using tissue microarray. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1190-1193
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1190.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1190
p53是一种肿瘤抑制基因, 许多肿瘤中可以发现有野生型p53的突变[1-6]. 野生型p53在维持基因组稳定性方面起着重要作用, 可以抑制一些与细胞增生和恶性增殖有关的促进因子活性, 是一种有效的肿瘤抑制基因[7]. 其突变或功能丧失, 显然是癌症发生或发展中的重要一步[8]. p53突变可以见于大多数肿瘤中, 然而在部分肿瘤中没有p53基因的突变, 这表明可能还有其他的基因参与到这一过程; 而鼠双微体基因MDM2编码的蛋白质可以和p53结合[9-10], 抑制p53的功能并能与p53形成作用反馈环[11-14]. 因此本文同步检测了胃癌组织中p53和MDM2蛋白表达, 并比较分析二者之间的对应关系.
收集2002-05/2006-05南方医院手术切除胃癌标本47例, 其中腺癌35例, 印戒细胞癌7例, 黏液腺癌5例, 全部中性甲醛固定, 石蜡包埋. 免疫组化抗体(p53与MDM2均为鼠抗人mAb), SP试剂盒和DAB显色试剂盒均购自福州迈新生物技术开发公司.
1.2.1 制作组织阵列: 对胃癌蜡块组织的苏木素-伊红染色切片作形态学观察, 选择有代表性的肿瘤区域, 在相应位置进行标记; 然后使用组织微阵列仪制作受体蜡块并打孔, 根据原有切片的标记部位, 用供体针在蜡块相应部位取样, 所用组织芯直径为0.6 mm, 将供体组织芯放入受体蜡块. 每例标本在标记区域内随机取3条组织芯. 在组织样本填入蜡孔时记录每个样本在二维阵列中的具体位置, 并在一定位置上标记出组织微阵列的方位(图1).
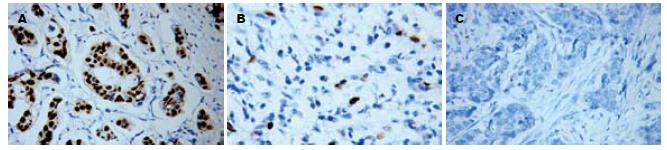
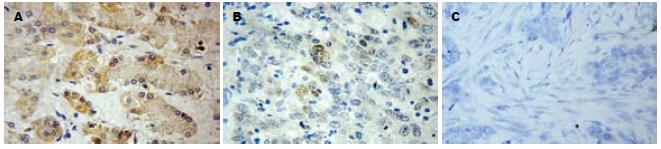
1.2.2 免疫组织化学染色: 采用链霉菌抗生物素过氧化酶(Streptavidin-Peroxidase, SP)免疫组化法. 按SP试剂盒操作说明进行试验, 所有样本经40 g/L甲醛溶液固定, 石蜡包埋, 制成厚4 μm的切片, 60℃烘烤, 脱蜡, 高压修复抗原, 3%过氧化氢灭活内源性过氧化物酶, 10%非免疫血清封闭, 加入1:50稀释的第一抗体, 室温孵育1小时, PBS冲洗, 滴加1 :300生物素标记二抗, 室温下10 min, 冲洗, 滴加1:40稀释的SP溶液, 室温下10 min, 冲洗后DAB显色, 苏木素复染, 中性树胶封片. 突变型p53阳性定位于细胞核, MDM2在核与胞质均可见表达. 免疫组化染色设阳性与阴性对照, 以乳腺癌阳性标本作为阳性对照, 以PBS液代替一抗作为阴性对照.
1.2.3 免疫组织化学染色阳性判定标准: p53以细胞核中出现棕黄色颗粒为阳性细胞, 阳性细胞>10%为阳性(+)结果, 阳性细胞在10%-5%之间为弱阳性(+/-)结果, 5%-0%为阴性(-)结果. MDM2以细胞质和/或细胞核中出现棕黄色颗粒为阳性细胞, 阳性细胞>10%为阳性(+)结果, 阳性细胞在10%-5%之间为弱阳性(+/-)结果, 5%-0%为阴性(-)结果.
统计学处理 应用SPSS11.5统计软件, 对p53与MDM2表达之间的相关性, 差异性和相似性采用对应分析, 并借助图形表示其对应关系.
p53和MDM2蛋白在组织中的阳性表达、弱阳性表达和阴性表达情况见图2与图3. p53蛋白阳性表达率为34.0%(16/47); 弱阳性表达率为17.0%(8/47); MDM2蛋白阳性表达率42.5% (20/47), 弱阳性表达率为21.3%(10/47, 表1).
| MDM2 | 合计 | |||
| + | +/- | - | ||
| p53+ | 6 | 4 | 6 | 16(34.0%) |
| p53+/- | 1 | 5 | 2 | 8(17.0%) |
| p53- | 13 | 1 | 9 | 23(49.0%) |
| 合计 | 20(42.5%) | 10(21.3%) | 17(36.2%) | 47(100.0%) |
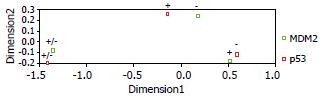
对p53和MDM2蛋白表达进行对应分析, 自由度为4, P = 0.012. p53阳性点与MDM2阴性点接近, 而MDM2阳性点与p53阴性点接近, 两者的弱阳性点接近. 说明p53蛋白突变型阳性表达与MDM2蛋白阴性表达呈对应关系, p53蛋白突变型阴性表达与MDM2蛋白强阳性表达呈对应关系(图4).
p53是一种肿瘤抑制基因, 许多肿瘤中可以发现有野生型p53的突变[15-16]. 野生型p53基因编码的蛋白能抑制细胞增殖, 使细胞停在G1期, 有利于受损的DNA进行修复, 若修复失败, 则p53蛋白诱发凋亡以阻断突变DNA的遗传. p53基因突变后, p53蛋白失去对细胞的监控作用, 细胞容易带着受损伤的DNA进入S期, 使细胞因遗传不稳定而产生突变和染色体畸变导致细胞恶性变, 形成肿瘤. p53突变可以见于大多数肿瘤中, 而在部分肿瘤中没有p53基因的突变, 人们试图了解这些肿瘤中野生型p53失去抑制肿瘤的作用是否与其他一些生物学机制有关. 高水平的MDM2基因产物可以使p53的功能失活是其中的一种[17-18]. MDM2是近年来发现的癌基因, 在体内最重要的作用是抑制野生型p53的激活转录功能和抗肿瘤活性[19]. MDM2是p53的转录靶基因, 直接结合p53, 与p53形成一个精细的负反馈调节环[20-21], 野生型p53基因诱导MDM2蛋白高表达, 后者与p53结合形成复合物, 反过来抑制p53的转录活性, 严格控制p53蛋白水平[22-23]. MDM2表达过强则可封闭p53介导的反式激活作用, 使p53功能丧失[24-25], 抑制其抗肿瘤活性. 我们发现在胃癌组织内p53蛋白突变型阳性表达与MDM2蛋白阴性表达呈对应关系, p53蛋白突变型阴性表达与MDM2蛋白强阳性表达呈对应关系, 说明MDM2参与与p53有关的肿瘤的发生过程, 部分肿瘤虽然没有p53突变, 但是MDM2高表达在某种程度上起到了使野生型p53失活的作用, 使p53失去对细胞的监控作用, 导致细胞恶性变, 形成肿瘤. 这一结论与p53蛋白和MDM2蛋白表达呈负相关的报道相符. 关于MDM2与p53的相关性, 有不同的报道. 李凤歧 et al[26]对尿路肿瘤的观察表明MDM2与p53表达呈负相关; 薄爱华 et al[27]在胃癌食管癌中的研究发现p53与MDM2蛋白表达呈负相关性; 孙迎娟 et al[28]报道在胃癌组织中MDM2与p53表达呈正相关; 而有些研究[29-30]则显示p53蛋白与MDM2蛋白的表达无明显相关性.
我们还发现47例胃癌病例中有6例(12.8%)出现了p53蛋白和MDM2蛋白的过表达, 肿瘤同时具有p53蛋白和MDM2阳性表达, 这说明少部分肿瘤发生过程中的p53与MDM2负反馈调节环可能被破坏, 提示了细胞核内的精细调节可能出现了紊乱, 这与肿瘤发展中出现各种各样细胞核内的失调相符. 有文献也报道, 这种同时具有p53蛋白和MDM2阳性表达的病例具有更差的预后.
总之, p53突变是胃癌发生发展中的重要一步, 部分没有发现p53突变的胃癌组织MDM2蛋白过表达, 反映了胃癌的恶性增生过程中MDM2可能起重要作用.
p53是一种肿瘤抑制基因, 许多肿瘤中可以发现有野生型p53的突变. 野生型p53在维持基因组稳定性方面起着重要作用, 其突变或功能丧失是癌症发生或发展中的重要一步, 然而在部分肿瘤中没有p53基因的突变, 表明可能还有其他基因参与到这一过程; 而鼠双微体基因MDM2编码的蛋白质可以和p53结合, 可以抑制p53的功能并能与p53形成作用反馈环, 其可能参与这一过程.
赵景民, 主任医师, 中国人民解放军第302医院病理科
MDM2是近年来发现的癌基因, 在体内最重要的作用是抑制野生型p53的激活转录功能和抗肿瘤活性. MDM2是p53的转录靶基因, 直接结合p53, 与p53形成一个精细的负反馈调节环, MDM2表达过强则可封闭p53介导的反式激活作用, 使p53功能丧失, 抑制其抗肿瘤活性.
李凤歧 et al对尿路肿瘤的观察和薄爱华 et al在胃癌食管癌中的研究表明MDM2与p53表达呈负相关; 孙迎娟 et al报道在胃癌组织中MDM2与p53表达呈正相关; 而有些研究则显示p53蛋白与MDM2蛋白的表达无明显相关性.
本研究对进一步探讨胃癌发生机制和早期胃癌的发现有一定的理论参考价值和潜在引用价值.
本文部分研究内容较新颖, 研究结果对相关研究领域目前尚存在争议性的问题有一定参考价值.
编辑: 李军亮 电编:郭海丽
| 1. | Adamson DJ, Thompson WD, Dawson AA, Bennett B, Haites NE. p53 mutation and expression in lymphoma. Br J Cancer. 1995;72:150-154. [PubMed] |
| 2. | Ichikawa A. Prognostic and predictive significance of p53 mutation in aggressive B-cell lymphoma. Int J Hematol. 2000;71:211-220. [PubMed] |
| 3. | Keohavong P, Gao WM, Zheng KC, Mady H, Lan Q, Melhem M, Mumford J. Detection of K-ras and p53 mutations in sputum samples of lung cancer patients using laser capture microdissection microscope and mutation analysis. Anal Biochem. 2004;324:92-99. [PubMed] |
| 4. | Shimmyo T, Okada A, Hashimoto T, Kobayashi Y, Miyagi Y, Ishikawa Y, Nakagawa K, Osada H, Tsuchiya E. Etiologic value of p53 mutation spectra and differences with histology in lung cancers. Cancer Sci. 2008;99:287-295. [PubMed] |
| 5. | Furihata M, Shuin T, Takeuchi T, Sonobe H, Ohtsuki Y, Akiyama Y, Yuasa Y. Missense mutation of the hMSH6 and p53 genes in sporadic urothelial transitional cell carcinoma. Int J Oncol. 2000;16:491-496. [PubMed] |
| 6. | Yamada H, Shinmura K, Okudela K, Goto M, Suzuki M, Kuriki K, Tsuneyoshi T, Sugimura H. Identification and characterization of a novel germ line p53 mutation in familial gastric cancer in the Japanese population. Carcinogenesis. 2007;28:2013-2018. [PubMed] |
| 7. | Jenks PJ, Jeremy AH, Robinson PA, Walker MM, Crabtree JE. Long-term infection with Helicobacter felis and inactivation of the tumour suppressor gene p53 cumulatively enhance the gastric mutation frequency in Big Blue transgenic mice. J Pathol. 2003;201:596-602. [PubMed] |
| 8. | Lu C, Xu HM, Ren Q, Ao Y, Wang ZN, Ao X, Jiang L, Luo Y, Zhang X. Somatic mutation analysis of p53 and ST7 tumor suppressor genes in gastric carcinoma by DHPLC. World J Gastroenterol. 2003;9:2662-2665. [PubMed] |
| 9. | Haitel A, Wiener HG, Baethge U, Marberger M, Susani M. mdm2 expression as a prognostic indicator in clear cell renal cell carcinoma: comparison with p53 overexpression and clinicopathological parameters. Clin Cancer Res. 2000;6:1840-1844. [PubMed] |
| 10. | Lahav G, Rosenfeld N, Sigal A, Geva-Zatorsky N, Levine AJ, Elowitz MB, Alon U. Dynamics of the p53-Mdm2 feedback loop in individual cells. Nat Genet. 2004;36:147-150. [PubMed] |
| 11. | Bond GL, Hu W, Levine AJ. MDM2 is a central node in the p53 pathway: 12 years and counting. Curr Cancer Drug Targets. 2005;5:3-8. [PubMed] |
| 12. | Bose I, Ghosh B. The p53-MDM2 network: from oscillations to apoptosis. J Biosci. 2007;32:991-997. [PubMed] |
| 13. | Cheung AN, Shen DH, Khoo US, Chiu MP, Tin VP, Chung LP, Ngan HY. Immunohistochemical and mutational analysis of p53 tumor suppressor gene in gestational trophoblastic disease: correlation with mdm2, proliferation index, and clinicopathologic parameters. Int J Gynecol Cancer. 1999;9:123-130. [PubMed] |
| 14. | Dobbelstein M, Wienzek S, Konig C, Roth J. Inactivation of the p53-homologue p73 by the mdm2-oncoprotein. Oncogene. 1999;18:2101-2106. [PubMed] |
| 17. | Zhu J, Zhang S, Jiang J, Chen X. Definition of the p53 functional domains necessary for inducing apoptosis. J Biol Chem. 2000;275:39927-39934. [PubMed] |
| 18. | Freedman DA, Wu L, Levine AJ. Functions of the MDM2 oncoprotein. Cell Mol Life Sci. 1999;55:96-107. [PubMed] |
| 19. | Yin Y, Stephen CW, Luciani MG, Fahraeus R. p53 Stability and activity is regulated by Mdm2-mediated induction of alternative p53 translation products. Nat Cell Biol. 2002;4:462-467. [PubMed] |
| 20. | 黄 越承, 蔡 建明. MDM2功能及其调控机制. 国外医学•肿瘤学分册. 2004;31:336-339. |
| 22. | Clegg HV, Itahana K, Zhang Y. Unlocking the Mdm2-p53 loop: ubiquitin is the key. Cell Cycle. 2008;7:287-292. [PubMed] |
| 24. | Inoue S, Tezel E, Nakao A. Molecular diagnosis of pancreatic cancer. Hepatogastroenterology. 2001;48:933-938. [PubMed] |
| 25. | Lev Bar-Or R, Maya R, Segel LA, Alon U, Levine AJ, Oren M. Generation of oscillations by the p53-Mdm2 feedback loop: a theoretical and experimental study. Proc Natl Acad Sci U S A. 2000;97:11250-11255. [PubMed] |