修回日期: 2008-02-15
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 探讨生长激素(growth hormone, GH)在体外对胰腺癌细胞株BXPC-3增殖及其可能机制.
方法: 将胰腺癌细胞随机分为实验组(GH组)和对照组(NS组), GH组按剂量和培养时间分为4个亚组(50 μg/L: 2, 24 h; 100 μg/L: 2, 24 h), 分别吸取上清用ELISA法检测类胰岛素生长因子1、2(IGF-1和IGF-2)并将细胞计数; 胰腺癌细胞用50和100 μg/L GH培养24 h后固定, 以流式细胞仪测定细胞周期; 同时在不同浓度GH干预的培养液进行细胞爬片、固定, 用原位杂交的方法检测类胰岛素生长因子1、2受体mRNA (IGF-1R mRNA和IGF-2R mRNA).
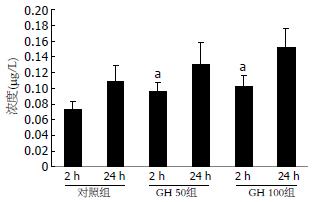
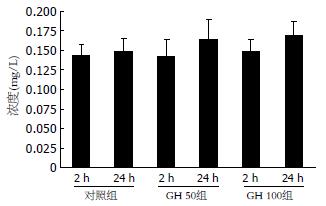
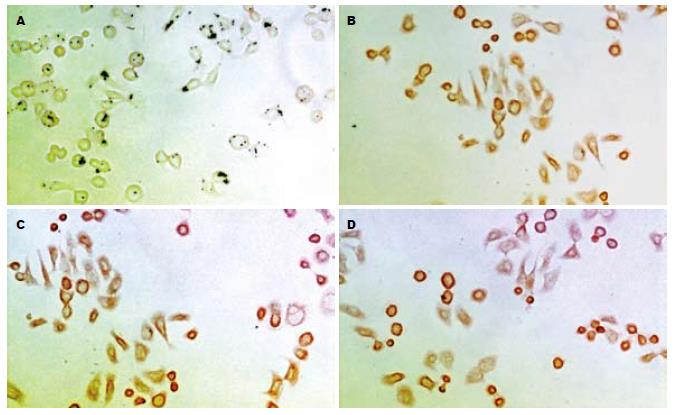
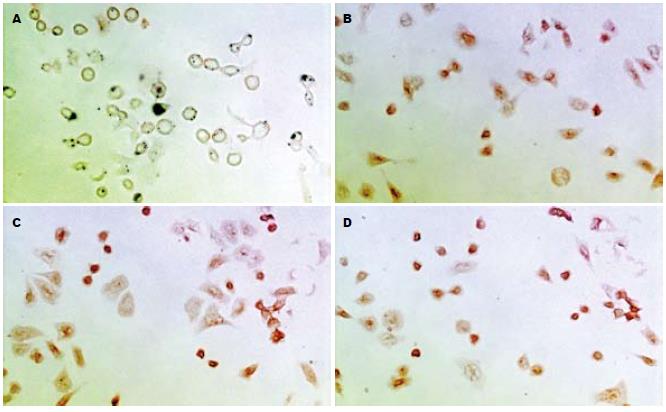
结果: 加入GH培养24 h后细胞数目增加明显(8.44±1.25, 7.50±0.64 vs 5.26±0.65, P<0.05), 且GH组的增殖指数明显高于对照组(0.60±0.06, 0.57±0.04 vs 0.50±0.04, P<0.05), S期细胞数与对照组相比也显著增多(47.62%±6.74%, 54.60%±7.59% vs 38.37%±4.99%, P<0.05). 2 h后实验组的IGF1的量明显增加(P<0.05), 但24 h后各组的IGF-1之间无统计学意义. IGF-1、IGF-2R mRNA在肿瘤细胞中均呈阳性表达, 且GH可诱导细胞IGF-1R mRNA表达增强, 而IGF-2R mRNA则没增加.
结论: GH在体外能促进胰腺癌BXPC-3细胞的增殖, 其机制可能是通过GH-IGF1轴发挥作用的.
引文著录: 蔡辉华, 孙跃明, 白剑峰, 陆文熊, 石毅, 赵翰林, 苗毅. 生长激素对胰腺癌细胞株BXPC-3增殖的作用及其机制. 世界华人消化杂志 2008; 16(11): 1157-1161
Revised: February 15, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To explore the in vitro effect of human growth hormone (GH) on the proliferation of pancreatic carcinoma cell line (BXPC-3 cells) as well as the possible mechanism.
METHODS: BXPC-3 cells during exponential growth stage were harvested and divided into experimental group and control group. The experimental group was separated into four sub-groups according to the doses of GH (50, 100 μg/L) and culture time (2, 24 h). Insulin-like growth factors 1, 2 (IGF-1, IGF-2) were detected by enzyme-linked immunosorbent assay (ELISA). BXPC-3 cells cultured for 24 h with various GH concentrations were made into single cell suspensions and the samples underwent subsequent cell cycle evaluation. IGF-1 receptor mRNA and IGF-2 receptor mRNA were tested with in situ hybridization.
RESULTS: The GH-stimulated cell growth in vitro and the cell proliferation index (PI) were significantly increased after 24-h culture (cell number: 8.44 ± 1.25, 7.50 ± 0.64 vs 5.26 ± 0.65, P < 0.05; PI: 0.60 ± 0.06, 0.57 ± 0.04 vs 0.50 ± 0.04, P < 0.05), while the number of S-phase cells was also markedly increased (47.62% ± 6.74%, 54.60% ± 7.59% vs 38.37% ± 4.99%, P < 0.05). The quantity of IGF-1 was significantly increased after 2-h culture in the experimental group, but there was no statistical significance between the two groups after 24-h culture. The IGF-1 receptor mRNA and the IGF-2 receptor mRNA were positively expressed in BXPC-3 cells. Furthermore, the expression of IGF-1 receptor mRNA was increased after GH induction, but the expression of IGF-2 receptor mRNA was not.
CONCLUSION: GH can stimulate the proliferation of pancreatic carcinoma cells in vitro and the possible mechanism may be related to the axis of GH-IGF-1.
- Citation: Cai HH, Sun YM, Bai JF, Lu WX, Shi Y, Zhao HL, Miao Y. Effect of human recombinant growth hormone on proliferation of pancreatic carcinoma cell line BXPC-3 and its possible mechanism. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1157-1161
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1157.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1157
自Serono公司研制的重组人生长激素(recom-binant human growth hormone, rhGH)应用于生长激素(growth hormone, GH)缺乏的替代治疗获得成功以来, 其应用范围不断扩大. 国内一些学者[1]认为, 胃肠道恶性肿瘤术后的患者通过围手术期肠内和/或肠外营养支持可安全度过术后营养难关, 而在给患者营养的同时加用rhGH后可明显促进蛋白质合成和组织修复, 增强免疫功能, 从而减少术后并发症. 但GH在改善患者营养、缓解蛋白丢失、减轻恶病质的同时也可能增加某些细胞的恶性转化素质, 或加剧肿瘤细胞的恶性生物学行为. GH在肿瘤患者术后的应用仍存在一定的争议[2-3]. 本实验通过观察体外BXPC-3的数量、细胞周期和的胰岛素生长因子1、2(insulin-like growth factor-1, 2, IGF-1, 2)及胰岛素生长因子1、2受体mRNA(IGF-1, 2R mRNA)的表达情况, 来探讨GH对胰腺癌细胞是否有增殖作用及其可能机制.
BXPC-3细胞购自中科院上海细胞研究所, 生长激素购自瑞士Serono公司, IGF1, 2的ELISA试剂盒购自R&B公司, IGF1, 2R mRNA的原位杂交试剂盒购自武汉博士德生物公司.
1.2.1 细胞周期的检测: 将胰腺癌BXPC-3细胞用含100 mL/L的胎牛血清、1×105 U/L青霉素和1×105 U/L链霉素的DMEM完全培养液在37℃、50 mL/L CO2孵箱中培养. 培养至对数生长期时收集, 调整浓度为2.5×108/L, 接种于25 cm2一次性培养瓶中, 每瓶加培养液至5 mL, 实验组给予GH, 使其终浓度为50 μg/L及100 μg/L, 对照组加足培养液, 培养24 h, 2.5 mg/L的胰酶(含2 mg/L的EDTA)消化, 吹打成悬液后离心, 去上清, 1×PBS(0.01 mol/L, pH7.4)漂洗3次, 加入1 mL, -20℃, 800 mL/L乙醇吹打成细胞成单细胞悬液固定-20℃过夜, 次日用PBS漂洗2次, 调整为1 mL, 加入RNA酶A, 37℃水浴30 min, 制冷到4℃, 加入碘化丙锭, 300目滤网过滤后用流式细胞仪及Multicycle软件分析细胞周期(激发波长为488 nm), 计算增殖指数(PI)值[PI = (S+G2M)/(G0/G1+S+G2M)].
1.2.2 IGF1, 2的检测: 收集指数生长期中的BXPC-3细胞, 调整浓度为2.5×108/L, 接种于6孔板中, 每孔加培养液至2 mL, 实验组给予GH使成终浓度为50 μg/L及100 μg/L, 对照组加足培养液, 在培养2 h和24 h后计数并收集上清1 mL, 按试剂盒说明书步骤进行ELISA检测.
1.2.3 IGF1, 2R mRNA的检测: (1)细胞爬片制作: 盖玻片在涂有10 mL/L多聚赖氨酸后烘干, 高压蒸汽灭菌, 置于6孔板中, 同时将调整指数生长期、浓度为5×108/L的BXPC-3细胞于移于其中, 每孔加培养液至2 mL, 实验组给予GH使成终浓度为50 μg/L及100 μg/L, 对照组加足培养液, 再于37℃、50 mL/L CO2孵箱中培养. 24 h后吸去培养液, 用PBS洗5 min×3次, 加入4 g/L多聚甲醛固定30 min. 再以PBS洗涤5 min×3次, ddH2O充分洗涤, 晾干后用中性树胶将盖玻片无细胞面粘在载玻片上, 晾干后-20℃冰冻保存待检. (2)原位杂交检测: 在室温晾干的细胞爬片上加H2O2-甲醇(1:50)50 mL 30 min灭活内源性酶, 蒸馏水洗5 min×3次; 3 g/L柠檬酸新鲜胃蛋白酶消化1 min以暴露mRNA核酸片段, 10×PBS(0.1 mol/L, pH7.4)洗5 min×3次; 1 g/L多聚甲醛后固定, 室温10 min, 蒸馏水洗涤3次; 加入预杂交液, 20 μL/片, 湿盒40℃ 3 h; 加入杂交液, 20 μL/片, 湿盒40℃过夜; 37℃ SSC梯度洗涤; 滴加封闭液, 37℃ 30 min后加入生物素化鼠抗地高辛, 37℃ 60 min; 10×PBS洗5 min×4次; 滴加SABC, 37℃ 20 min, PBS洗5 min×3次; 加入生物素化过氧化物酶, 37℃ 20 min, PBS洗5 min×4次后DAB显色20 min, 充分水洗; 酒精脱水, 二甲苯透明, 封片. 以PBS代替一抗作空白对照. (3)结果判定: 细胞质内无着色为阴性, 淡黄色代表弱阳性, 黄色代表阳性, 深黄色和棕黄色代表强阳性.
统计学处理 所有数据以mean±SD表示, 用软件SPSS11.0进行数据统计.
在给予GH后, 与对照组相比, 培养2、24 h的细胞计数明显增多(P<0.05), 但不同浓度GH组(50 μg/L组及100 μg/L组)之间无差别(表1). GH对BXPC-3细胞周期的影响, 显示GH在体外能提高S(%)及PI(P<0.05). 但50 μg/L组及100 μg/L组差异无显著性(表2).
GH干预后2 h后, 实验组细胞分泌的IGF1比对照组明显增多(P<0.05), 而GH 50组与GH 100组间无明显差别, 而24 h后IGF1在各组之间没有差别. IGF2在肿瘤上清中呈阳性表达, 但不受GH调控(图1-2).
IGF1R mRNA阳性表达的细胞胞质着色为黄色, 少量细胞核亦可着色. 本组实验中空白组细胞不着色, 对照组细胞染成淡黄色, 而GH组则染成深黄色或棕黄色(图3). IGF2RmRNA在各组中均有表达, 胞质着色为黄色, GH干预组表达无明显增强(图4).
GH是由脑垂体前叶嗜酸性细胞分泌的一种分子质量为22 ku的单一肽链的蛋白质激素, 有191个氨基酸组成, 其生理功能主要是刺激所有机体组织的发育, 增加体细胞的体积和数目. GH的功能主要通过两种可能的机制发挥其功能: (1)直接作用假说, GH可以直接与靶细胞表面的GHR和/或催乳素受体(PRLR)结合, 刺激靶细胞的生长; (2)经IGFs等生长介质(somatomedin, SM)介导假说, 该假说认为GH刺激肝细胞和释放IGFs, 再经过IGFs作用于靶细胞促进细胞的增殖和生长. 除了肝脏, 身体其他组织细胞均能通过内分泌、旁分泌和自分泌IGFs. IGFs包括IGF1和IGF2, 他们与人体多种肿瘤的发生发展有一定的关系, 是很强的丝裂原[4-7]: IGF1通过与他的受体(IGF1R)结合介导GH的作用促靶细胞分裂增殖; 而IGF2则与两个不同受体(IGF1R和IGF2R)的亲合力几乎相同, 通过IGF1R介导胞内信号转导而发挥细胞增殖作用,通过IGF2R则介导溶酶体内吞噬溶酶体对IGF2进行降解使其灭活, 有人提出IGF2R是某些肿瘤的抑制基因[8-9].
国内学者石毅 et al[10]经研究后发现, GH在体外促进胰腺癌细胞SW-1990的生长, 而GHR在细胞中呈弱阳性表达(低于正常淋巴细胞的表达), 说明GH-GHR不是GH促SW-1990细胞增殖分化的主要途径, 但其机制未行进一步的阐明.
由于胰腺癌恶性程度高, 早诊断率低, 预后差, 患者总的5年生存率多在5.0%以下[11-12]. 石毅 et al[13]在体内实验时发现, GH不能改变胰腺癌在体肿瘤的细胞增殖特性, 但有利于维持小肠黏膜的形态. 如果将外源性GH应用于胰腺癌患者, 使其延缓机体总蛋白及细胞群的丢失, 改善营养, 增加体质量, 增进细胞及体液免疫功能, 减轻恶病质, 减少病死率, 从而最终使宿主受益.
为了观察GH对胰腺癌细胞增殖的影响, 该实验研究参照Izadyar et al[14]的方法, 细胞培养中采用的GH浓度选择为50 μg/L和100 μg/L, 药物暴露时间选为2 h和24 h. 结果显示GH可使BXPC-3细胞增殖加快、S期百分比及PI升高, 在实验组细胞培养2 h的上清中IGF1的浓度比对照组明显增高, 而24 h无明显差异, 这可能与GH半衰期短有关, 24 h后在实验组爬片的胰腺癌细胞的胞质中IGF1RmRNA表达增强, 而IGF2 RmRNA表达无增强, 提示GH在体外对QBC939细胞有促进分裂、增加DNA合成的作用, 机制可能是通过GH-IGF1轴发挥作用的. 本实验认为, 在体外GH通过GH-IGF1轴能促进胰腺癌BXPC-3细胞的增殖和分化, 但GH能否应用于临床恶性肿瘤术后患者, 有待于进一步的研究.
自从生长激素(GH)重组并应用于临床以来, 取得良好的效果. 最近有学者将GH应用于胃肠道恶性肿瘤术后患者, 能明显改善营养、促进蛋白质合成、增强免疫力, 减少术后并发症和延长患者的生存期. 本实验以胰腺癌细胞BXPC-3为研究对象, 探讨GH在体外能否促进增值及其机制.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
在GH广泛应用于临床的同时, 有学者质疑GH会否增加某些细胞的恶性转化素质, 或加剧肿瘤细胞的恶性生物学行为. 现在认为GH在体外能促进肿瘤细胞的增殖, 但体内不促进肿瘤的生长, 其机制不明.
有研究表明, GH除能促进小肠吸收营养, 还能调整细胞增殖期, 增强化疗药物的效果.
本文以胰腺癌细胞BXPC-3为研究对象, 在体外GH干预下, 观察细胞的数量、细胞周期和的IGF1、2及IGF1、2R mRNA的表达情况, 探讨GH对BXPC-3细胞是否有增殖作用及其可能机制.
本文的科学性, 创新性和可读性较好的反映我国或国际胃肠病学临床和基础研究的水平, 对临床恶性肿瘤患者应用生长激素有一定的参考价值.
编辑: 李军亮 电编:吴鹏朕
| 2. | Swerdlow AJ, Higgins CD, Adlard P, Preece MA. Risk of cancer in patients treated with human pituitary growth hormone in the UK, 1959-85: a cohort study. Lancet. 2002;360:273-277. [PubMed] |
| 3. | Schally AV, Varga JL, Engel JB. Antagonists of growth-hormone-releasing hormone: an emerging new therapy for cancer. Nat Clin Pract Endocrinol Metab. 2008;4:33-43. [PubMed] |
| 4. | Ibrahim YH, Yee D. Insulin-like growth factor-I and cancer risk. Growth Horm IGF Res. 2004;14:261-269. [PubMed] |
| 5. | Favoni RE, de Cupis A, Ravera F, Cantoni C, Pirani P, Ardizzoni A, Noonan D, Biassoni R. Expression and function of the insulin-like growth factor I system in human non-small-cell lung cancer and normal lung cell lines. Int J Cancer. 1994;56:858-866. [PubMed] |
| 6. | 邱 历伟, 姚 登福, 吴 信华, 吴 玮, 苏 小琴, 邹 黎. 肝癌组织IGF-Ⅱ表达与HBV DNA复制及病理学特征的关系. 世界华人消化杂志. 2006;14:1267-1271. [DOI] |
| 8. | Kong FM, Anscher MS, Washington MK, Killian JK, Jirtle RL. M6P/IGF2R is mutated in squamous cell carcinoma of the lung. Oncogene. 2000;19:1572-1578. [PubMed] |
| 9. | Rodriguez S, Gaunt TR, Day IN. Molecular genetics of human growth hormone, insulin-like growth factors and their pathways in common disease. Hum Genet. 2007;122:1-21. [PubMed] |
| 11. | MacKenzie MJ. Molecular therapy in pancreatic adenocarcinoma. Lancet Oncol. 2004;5:541-549. [PubMed] |
| 12. | Yamamoto M, Davydova J, Wang M, Siegal GP, Krasnykh V, Vickers SM, Curiel DT. Infectivity enhanced, cyclooxygenase-2 promoter-based conditionally replicative adenovirus for pancreatic cancer. Gastroenterology. 2003;125:1203-1218. [PubMed] |
| 14. | Izadyar F, Van Tol HT, Colenbrander B, Bevers MM. Stimulatory effect of growth hormone on in vitro maturation of bovine oocytes is exerted through cumulus cells and not mediated by IGF-I. Mol Reprod Dev. 1997;47:175-180. [PubMed] |