修回日期: 2008-03-11
接受日期: 2008-03-28
在线出版日期: 2008-04-08
目的: 探讨黄芩甙对人肝癌BEL-7402细胞系分化的影响.
方法: 应用细胞培养技术培养BEL-7402细胞, MTT实验和软琼脂克隆形成实验观察黄芩甙对肝癌细胞增殖的作用. 光镜、电子显微镜观察细胞形态、超微结构, 酶促反应试剂盒检测细胞浆中碱性磷酸酶(ALP)、γ-谷氨酰转移酶(γ-GT)活性, 放免法检测细胞甲胎蛋白(AFP)、白蛋白(ALB)分泌量和细胞内环核苷酸(cAMP)含量, 流式细胞术测定细胞周期, 免疫组化染色检测细胞AFP表达.
结果: 黄芩甙能明显抑制肝癌细胞增殖, 对肝癌细胞形态及超微结构的观察显示黄芩甙作用后细胞趋于成熟分化, 实验组AFP在胞质内均匀分布, 呈黄色, 着色较淡. 黄芩甙作用后γ-GT比活力明显低于对照组(135±10 nkat/g vs 2432±15 nkat/g, P<0.05), ALP比活力明显高于对照组(6635±1350 nkat/g vs 5872±450 nkat/g, P<0.05), ALP耐热型同工酶即胎盘型ALP活性显著低于对照组,黄芩甙组AFP分泌量较对照组细胞显著性降低, ALB分泌显著升高, 细胞内cAMP含量增加. 随黄芩甙浓度的增加和作用时间的延长肝癌细胞G1/G0期比例逐步增高, S期细胞减少.
结论: 黄芩甙能诱导肝癌细胞分化, 与细胞周期调节密切相关.
引文著录: 郭霞, 郭昱. 黄芩甙体外对人肝癌细胞BEL-7402的诱导分化作用. 世界华人消化杂志 2008; 16(10): 1119-1123
Revised: March 11, 2008
Accepted: March 28, 2008
Published online: April 8, 2008
AIM: To explore the baicalin-induced differen-tiation of human hepatocellular carcinoma cell line BEL-7402 in vitro.
METHODS: Human hepatocellular carcinoma cell line BEL-7402 was cultured in vitro. Cell morphology and ultrastructures were observed under a light and electronic microscope. The specific activities of alkaline phosphatase (ALP) and heat-resistant ALP were assayed with ALP kit based on Bessey method. The specific activity of glutamyltranspeptidase (γ-GT) was measured with γ-GT kit. The secretion of alpha-fetoprotein (AFP) was determined qualitatively and quantitatively by immunohistochemistry and radioimmunoassay, and the contents of albumin and cAMP were detected with radioimmunoassay kit. The effects of baicalin on cell cycle were observed by flow cytometry (FCM).
RESULTS: Baiclin inhibited the proliferation of BEL-7402 cells in a time- and dose-dependent manner, and induced the maturing and normality of morphology and ultrastructure. After treatment with baicalin, γ-GT activity was descended significantly (135 ± 10 nkat/g vs 2432 ± 15 nkat/g, P < 0.05), while ALP activity was remarkably enhanced (6635 ± 1350 nkat/g vs 5872 ± 450 nkat/g, P < 0.05); secretion of AFP dropped, but that of albumin ascended. Heat-resistant ALP activity was obviously decreased while intracellular cAMP content was increased in comparison with that in control group. G1/G0-phase cells were significantly increased while S-phase cells were decreased with the elevation of baicalin concentration and prolongation of treatment time.
CONCLUSION: Baicalin can induce normal differentiation of BEL-7402 cells by modulating cell cycle.
- Citation: Guo X, Guo Y. Effect of baicalin on differentiation of human hepatocellular carcinoma cell line BEL-7402 in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(10): 1119-1123
- URL: https://www.wjgnet.com/1009-3079/full/v16/i10/1119.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i10.1119
诱导恶性肿瘤细胞向正常表型分化是肿瘤治疗的新途径之一, 寻找高效低毒的分化诱导剂是诱导分化治疗的关键. 黄芩甙是从传统中药黄芩中提取分离出来的一种黄酮类化合物, 是黄芩的主要有效成分之一, 具有解热、降压、利胆、保肝、镇静、抗菌等药理作用. 近年发现黄芩甙具有显著的抗肿瘤作用[1-3]. 我们以人肝癌BEL-7402细胞为靶细胞, 观察黄芩甙在体外对该细胞的诱导分化作用.
人肝癌细胞株BEL-7402由本室冻存; 黄芩甙由四川汉坤植化有限公司提供(纯度≥95% Mr = 446.35); AFP免疫组化试剂盒购自北京中山生物技术有限公司, 甲胎蛋白(AFP)、白蛋白(ALB)、cAMP放免测定盒购自中国原子能科学研究院, 碱性磷酸酶(ALP)和γ-谷氨酰转肽酶(γ-GT)检测试剂盒购自上海长征医学科学有限公司. JEM2000EX透射电镜, 流式细胞仪Epics XLⅡ型美国Beckman Coulter公司产品.
人肝癌BEL-7402细胞株常规培养于含100 mL/L小牛血清、100 U/L青霉素、100 μg/L链霉素的RPMI 1640培养液中, 在37℃、50 mL/L CO2培养箱内培养. 每组设3个副孔. 生长在盖玻片经10 mg/L黄芩甙作用48 h及相应对照细胞HE染色, 光镜下观察. 按常规方法制备超薄切片, 透射电镜观察亚细胞结构.
1.2.1 细胞抑制率的测定: 取对数生长期细胞, 制成1×105/L的细胞悬液, 接种于96孔培养板, 每孔加细胞悬液100 μL,培养过夜, 实验组分别加入浓度为1.25, 2.5, 5, 10, 20, 40 mg/L的黄芩甙, 对照组只加培养基. 继续培养48 h后, 加入5 g/L MTT溶液10 μL, 继续培养4 h, 弃去各孔内液体, 每孔加入100 μL二甲基亚砜, 置振荡器上振荡5 min, 使细胞内和周围的紫色颗粒充分溶解, 室温放置10 min, 于全自动酶标仪上测定各孔A490nm值, 取3孔平均值计算细胞抑制率: 抑制率% = (1-实验组A值/对照组A值)×100%. 另对照组、10 mg/L黄芩甙组作用24、48、72、96、120 h, MTT法测定A490nm值, 计算细胞抑制率.
1.2.2 软琼脂克隆形成实验: 6 g/L琼脂糖的RPMI 1640培养液3 mL铺于直径6 cm的培养皿中, 形成底层琼脂, 含有1000个细胞的3.3 g/L琼脂糖的RPMI 1640培养液2 mL铺于平皿中, 形成上层琼脂. 培养2 wk后, 倒置显微镜下统计克隆形成数, 细胞数>50计为一个克隆, 克隆形成率(%) = 形成克隆平均数/接种细胞数×100%. 实验重复3次.
1.2.3 γ-GT和ALP活性测定: 细胞用2.5 g/L胰酶消化, 2000 r/min离心10 min后, 加入预冷的2.5 g/L脱氧胆酸钠溶解细胞, 再4℃ 12 000 r/min离心20 min, 收集上清液供测定, -70℃保存备用. 按酶促反应试剂盒说明测定γ-GT和ALP活性, 耐热型ALP(胎盘型)活性的测定于65℃加热30 min后, 测定剩余酶活力占总活力的百分比, 总蛋白质含量用考马斯亮蓝法测定. γ-GT(或ALP)比活力(nkat/g) = γ-GT(或ALP)值/总蛋白量.
1.2.4 细胞内AFP的免疫组化检测: 将生长在盖玻片上经10 mg/L黄芩甙作用48 h及相应对照组细胞取出, PBS洗6次, 晾干, 4℃丙酮固定10 min, 阴性对照用PBS替代第一抗体, PBS洗6次, 晾干, 按SABC试剂盒说明进行常规免疫组化染色, 封片后光先于光镜下观察, 再于真彩色图像分析仪上测定阳性细胞光密度值, 每个浓度测量20个细胞阳性色的吸光度值(IA), 换算成每个细胞阳性色的光密度值(IA/cell), 间接反映AFP的量.
1.2.5 AFP和ALB分泌量测定: 收集经10 mg/L黄芩甙作用48 h及相应对照组的培养液, 4000 r/min离心5 min, 取上清冷冻干燥. 细胞消化后台盼蓝拒染法计数活细胞数. 将干燥后的培养液溶于PBS中, 用放免法测定AFP和ALB的含量.
1.2.6 细胞内环核苷酸(cAMP)含量测定: 收集经10 mg/L黄芩甙作用48 h及相应对照组的细胞, 4000 r/min离心5 min, 收集细胞, 每管加入50 mmol/L pH4.75醋酸缓冲液1 mL, -70℃反复冻融, 显微镜下间细胞碎屑, 再离心, 取上清做检测样品, 放免法测定cAMP含量. 总蛋白质含量用考马斯亮蓝法测定.
1.2.7 细胞周期测定: 将细胞进行同步化处理24 h后, 换新鲜含小牛血清的培养液, 待细胞长至80%融合时, 收获细胞, PBS洗2次, 700 mL/L乙醇固定, 然后用碘化丙啶染色, 流式细胞仪进行检测.
统计学处理 计量资料数据以均数±标准差表示, 用SPSS10.0软件进行统计分析. 多组间的均数差异性比较采用单因素方差分析(One-way ANOVA)及LSD检验. P<0.05为有统计学意义.
1.25, 2.5, 5.0, 10, 20和40 mg/L黄芩甙对人肝癌BEL-7402细胞的抑制率(%)分别为4.16±0.89, 10.69±1.52, 24.36±2.39, 38.59±2.68, 55.87±5.69和65.26±5.88, 作用24, 48, 72, 96和120 h的抑制率(%)分别为8.89±1.72, 38.59±2.68, 43.27±4.18, 54.98±4.09和60.37±8.96, 均呈浓度和时间依赖关系, 并选取10 mg/L为有效浓度进行以下实验.
黄芩甙可明显抑制细胞克隆形成, 0, 5, 10和20 mg/L克隆形成数分别为622, 288, 147和52, 克隆形成率(%)分别为62.2, 28.8, 14.7和5.2, 表明其具有较强的抑制与杀灭肿瘤干细胞的能力, 且随剂量增加, 抑制作用增强, 呈现良好的量效关系.
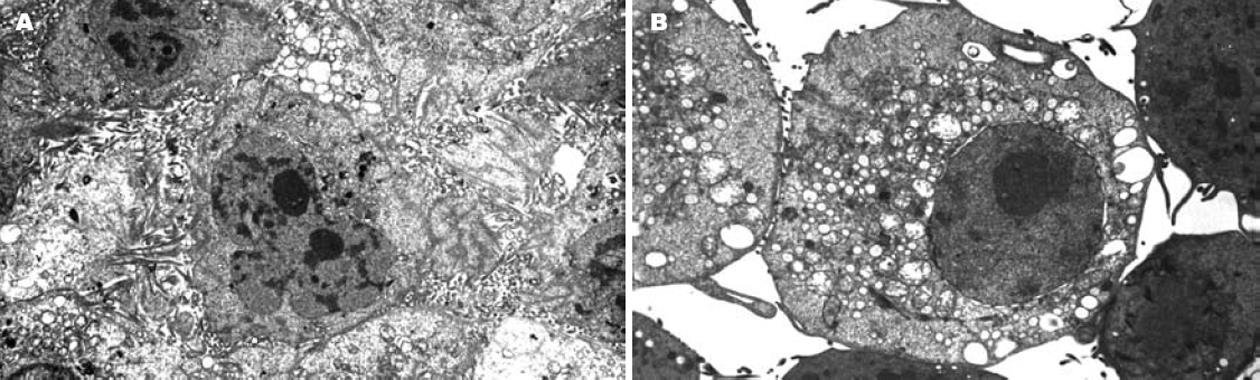
光学显微镜下: 对照组表现出纤维母细胞样形态, 伸出形态各异的伪足, 而黄芩甙组细胞形态较圆, 伪足数目相对较少. 透射电镜下观察(图1): 对照组肝癌细胞具有肿瘤细胞典型特点, 核大而圆, 染色质疏松, 核仁明显, 有多个大核仁, 形态不规则, 电子密度不均, 常见核仁边集现象, 细胞质较少, 细胞器都比较简单, 糖原丰富, 高尔基复合体不发达, 难以见到. 细胞表面微绒毛细长且密集. 黄芩甙处理组, 细胞核变小, 皱缩, 染色质凝集, 异染色质增多, 核仁减少、浓缩甚至消失. 细胞质增多, 线粒体数量增多, 有的为基质密度增高, 内外膜间隙增宽, 但体积变化不明显, 有的线粒体体积增大, 肿胀呈空泡状. 滑面内质网扩张, 有的呈空泡状, 局部粗面内质网丰富, 并呈板层状排列, 并可见脂肪空泡. 胞质有部分溶解, 出现了自噬体, 内有吞噬的细胞器, 高尔基复合体体积增大、发育较完善, 易于发现, 提示细胞趋于成熟分化.
实验观察2 d, 细胞免疫组化结果显示, 对照细胞AFP均为阳性, 主要成团浓集分布于胞质中, 呈棕黄色, 着色较深. 实验组AFP在胞质内均匀分布, 呈黄色, 着色较淡. 对照和实验细胞AFP的IA/cell值分别为253.5和169.4. 黄芩甙组培养48 h后γ-GT比活力明显低于对照组(135±10 nkat/g vs 2432±15 nkat/g, P<0.05), ALP比活力明显高于对照组(6635±1350 vs 5872±450 nkat/g, P<0.05), ALP耐热型同工酶即胎盘型ALP活性显著低于对照组(37.54±2.38 vs 63.36±2.84, P<0.05), 黄芩甙组AFP分泌量较对照组细胞显著性降低(42.65±4.27 vs 78.54±6.88, P<0.05), ALB分泌显著升高(85.59±7.69±4.27 vs 50.49±4.09, P<0.05), 细胞内cAMP含量增加(423.93±32.18 vs 228.76±23.51, P<0.05).
现代医学发现, 肿瘤细胞的基本生物学特征为增殖与分化的平衡失调. 虽然肿瘤细胞由于某种原因发生分化阻断或分化异常, 但仍然具有和正常细胞相同的分化潜能. 因而有可能在分化诱导作用下被诱导分化转为良性细胞. 基于以上认识, 近年来抗肿瘤研究开辟了一条崭新的途径, 即诱导肿瘤细胞分化的治疗研究. 诱导分化治疗不同于以往的治疗途径. 他的目的不在于杀灭肿瘤, 而在于"改造"肿瘤细胞, 诱导肿瘤细胞分化为正常细胞或接近正常细胞. 新近的研究表明, 肝癌和非实体瘤一样, 其癌细胞亦可在分化诱导剂的作用下向正常细胞转化[4-5].
MTT实验中吸光度值的大小可以反映活细胞的数量及代谢活性, 因此应用MTT比色法可定量测定抗癌药物对人肝癌细胞的细胞毒活性和细胞生长抑制情况. 克隆形成率是筛选抗肿瘤药物的常用方法, 主要用于观测抗肿瘤药物对肿瘤干细胞的杀灭能力. 本研究MTT法和软琼脂克隆形成实验结果显示黄芩甙可以直接作用于肿瘤细胞, 抑制细胞的生长. 形态学上的分化成熟是表明恶性肿瘤细胞分化的标志[6]. 一般说来, 恶性程度越高, 分化越差的恶性肿瘤细胞内线粒体往往越少, 线粒体内嵴发育越差. 粗面内质网的量与癌细胞的生长速率、恶性程度呈正比. 分化低和生长快的肿瘤细胞高尔基体发育差, 而分化较好的恶性和良性肿瘤细胞高尔基体发育较好[7-9]. 糖原增生程度与癌细胞的无氧酵解代谢活动呈正比, 而与其分化程度呈反比[10]. 本研究中, 光镜、电镜观察的结果发现黄芩甙作用后细胞形态和超微结构发生了明显的变化, 细胞已出现了和能量代谢、蛋白质合成、贮存或分泌功能相关的发育分化, 提示癌细胞恶性表型发生逆转.
为了探讨肝癌细胞分化的定量指标, 本实验根据肝细胞的代谢特点, 选择了几种反映肝细胞分化的特异性酶和蛋白为标志. AFP是公认的肝细胞增殖和恶变的重要标志物. 细胞内免疫组化检测发现并不是所有的癌细胞均呈AFP阳性. 这可能是处于不同细胞周期的细胞合成AFP量不同所致. 过去研究证明AFP合成的高峰迟于DNA合成的高峰, 在DNA合成开始后, 细胞以指数增长时, AFP才开始合成. 进一步发现AFP的合成出现在G2期, 并于G2/M期或细胞分裂之后释放. 我们发现, 黄芩甙可抑制细胞合成、分泌AFP. γ-GT在成年鼠肝中的活性极低, 而在诱癌过程中逐渐上升, 是肝癌变的早期标志[11]. ALP则是肝癌细胞去分化的酶学指标[12]. 研究证明, ALP肝癌患者出现耐热型ALP同工酶[13]. ALB是肝细胞分化成熟的指标. cAMP是动物细胞特有的细胞内信号体系. 许多研究表明cAMP是细胞内的诱导分化剂, 是细胞产生的具有分化诱导作用的化学物质. 本研究结果表明, 降低细胞γ-GT和耐热型ALP活性, 升高ALP总活性, 增加ALB分泌量和细胞内cAMP含量.
细胞周期是细胞生命活动的基本过程, 细胞周期的长短主要决定于G1期, G1期阻滞可使细胞增殖周期延长[14-16]. S期可反映细胞的增殖情况, S期占细胞周期比例高, 则提示DNA合成活跃. 一般而言, 肿瘤细胞的S期比例较正常细胞要高, 其增殖活性也较正常细胞高. Chang et al[17]研究发现黄芩甙影响肝癌细胞周期, 而且发现因细胞系的不同结果不一致, 作用于HepG2细胞, G2/M期显著增多, 作用于 Hep3B细胞G1期细胞增多. 我们用PI标记流式细胞仪分析黄芩甙作用后肝癌细胞BEL-7402细胞周期的变化. 结果发现随着黄芩甙药物浓度的增加, 作用时间的延长, 细胞周期中G0/G1期的比例逐渐增加, S期比例逐渐减少. 表明黄芩甙主要用于G1/S节点, 使细胞停滞于G1期, S期细胞减少, 反映细胞增殖活性降低, 进而细胞趋于分化.
肿瘤细胞的基本生物学特征为增殖与分化的平衡失调. 虽然肿瘤细胞由于某种原因发生分化阻断或分化异常, 但仍然具有和正常细胞相同的分化潜能. 因而有可能在分化诱导作用下被诱导分化转为良性细胞. 诱导恶性肿瘤细胞向正常表型分化成为肿瘤治疗的新途径之一, 寻找高效低毒的分化诱导剂是诱导分化治疗的关键.
沈柏用, 副教授, 上海交通大学医学院附属瑞金医院肝胆胰外科中心
近年发现黄芩甙具有显著的抗肿瘤作用, 表现为抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡, 但是否具有诱导分化作用尚乏研究.
金锦梅 et al报道人参皂甙对CD34+造血干/祖细胞有诱导分化作用. 曾小莉 et al报道人参总皂甙对人肝癌细胞胞质中某些表型有逆转作用.
本研究深入探讨了黄芩甙诱导肝癌细胞分化的作用及机制.
本研究为揭示黄芩甙抗肿瘤作用机制提供了有用的资料, 为其进一步开发应用奠定了基础.
本文选题新颖, 统计处理合理, 结果可靠, 但立题依据不够充分, 讨论不够深入, 全面.
编辑: 程剑侠 电编:吴鹏朕
| 1. | Motoo Y, Sawabu N. Antitumor effects of saikosaponins, baicalin and baicalein on human hepatoma cell lines. Cancer Lett. 1994;86:91-95. [PubMed] [DOI] |
| 2. | Hu CQ, Chen K, Shi Q, Kilkuskie RE, Cheng YC, Lee KH. Anti-AIDS agents, 10. Acacetin-7-O-beta-D-galactopyranoside, an anti-HIV principle from Chrysanthemum morifolium and a structure-activity correlation with some related flavonoids. J Nat Prod. 1994;57:42-51. [PubMed] [DOI] |
| 3. | Matsuzaki Y, Kurokawa N, Terai S, Matsumura Y, Kobayashi N, Okita K. Cell death induced by baicalein in human hepatocellular carcinoma cell lines. Jpn J Cancer Res. 1996;87:170-177. [PubMed] [DOI] |
| 6. | 史 景泉, 陈 喜生, 卞 修武. 超微病理学. 第1版. 北京: 化学工业出版社 2005; 255-280. |
| 7. | 王 蘅文. 实验肿瘤学基础. 第1版. 北京: 人民卫生出版社 1992; 177-178. |
| 10. | 谭 曾鲁, 周 柔丽. 医学细胞生物学. 第1版. 北京: 中国协和医科大学和北京医科大学联合出版社 1992; 22-35. |
| 11. | Hong JT, Wilson MW, Glauert HP. Effect of phenobarbital and the peroxisome proliferator ciprofibrate on gamma-Glutamyltranspeptidase activity and leukotriene C4 concentration in cultured rat hepatocytes. J Biochem Toxicol. 1995;10:239-243. [PubMed] [DOI] |
| 12. | Fanjul M, Thèveniau M, Palévody C, Rougon G, Hollande E. Expression and characterization of alkaline phosphatases during differentiation of human pancreatic cancer (Capan-1) cells in culture. Biol Cell. 1991;73:15-25. [PubMed] [DOI] |
| 13. | Lu Y, Lu Q, Chen HL. Diagnosis of primary liver cancer using lectin affinity chromatography of serum alkaline phosphatase. J Exp Clin Cancer Res. 1997;16:75-80. [PubMed] |
| 14. | Gansauge S, Gansauge F, Ramadani M, Stobbe H, Rau B, Harada N, Beger HG. Overexpression of cyclin D1 in human pancreatic carcinoma is associated with poor prognosis. Cancer Res. 1997;57:1634-1637. [PubMed] |
| 15. | Kamb A, Gruis NA, Weaver-Feldhaus J, Liu Q, Harshman K, Tavtigian SV, Stockert E, Day RS 3rd, Johnson BE, Skolnick MH. A cell cycle regulator potentially involved in genesis of many tumor types. Science. 1994;264:436-440. [PubMed] [DOI] |
| 16. | Bindels EM, Lallemand F, Balkenende A, Verwoerd D, Michalides R. Involvement of G1/S cyclins in estrogen-independent proliferation of estrogen receptor-positive breast cancer cells. Oncogene. 2002;21:8158-8165. [PubMed] [DOI] |
| 17. | Chang WH, Chen CH, Lu FJ. Different effects of baicalein, baicalin and wogonin on mitochondrial function, glutathione content and cell cycle progression in human hepatoma cell lines. Planta Med. 2002;68:128-132. [PubMed] [DOI] |