修回日期: 2008-02-27
接受日期: 2008-03-28
在线出版日期: 2008-04-08
目的: 研究灵芝孢子粉对人肝癌细胞HepG2生长的抑制作用.
方法: 运用MTT法研究灵芝孢子粉水溶性成份在体外对HepG2细胞的抑制作用, 并利用裸小鼠的移植瘤模型研究灵芝孢子粉在体内对HepG2细胞的生长抑制作用. HE染色观察肝癌组织结构和细胞形态改变.
结果: TMTT实验结果表明灵芝孢子粉对HepG2细胞的IC50值随作用时间增加而减小, 72 h达到最低, 为2.14 g/L. 体内抑瘤实验结果显示灵芝孢子粉为2000 mg/kg时, 对裸小鼠移植瘤的抑制率为57.0%. 镜下观察灵芝孢子粉治疗组肿瘤坏死组织较多, 细胞异型性较小.
结论: 高浓度及高剂量的灵芝孢子粉具有抑制肿瘤细胞生长的作用.
引文著录: 王顺官, 王筱婧, 李琳, 徐江平. 灵芝孢子粉对人肝癌细胞HepG2及裸鼠移植瘤生长的抑制作用. 世界华人消化杂志 2008; 16(10): 1114-1118
Revised: February 27, 2008
Accepted: March 28, 2008
Published online: April 8, 2008
AIM: To evaluate the inhibitory effects of Lucid Ganoderma spore (LGS) on human hepato-carcinoma cell line HepG2.
METHODS: MTT assay was used to detect the in vitro inhibition of LGS on human hepatocarcinoma cell line HepG2. Nude mouse model of human hepatocarcinoma was established and growth of the transplanted tumor was observed in vivo. The morphology of tumor cells was observed by microscopy after HE staining.
RESULTS: MTT assay showed that the 50% inhibitory concentration (IC50) was decreased with the increasing of time. The minimum value of IC50 was observed at 72 h (2.14 g/L). In vivo study revealed that LGS had an inhibitory action on HepG2 cells (dose: 2000 mg/kg, inhibitory rate: 57.0%). The morphologic observation exhibited larger areas of necrosis and less degree of atypia afer LGS treatment.
CONCLUSION: LGS has inhibitory action on human hepatocarcinoma cell line HepG2 at high concentrations and high dosages.
- Citation: Wang SG, Wang XJ, Li L, Xu JP. Inhibitory effect of Lucid Ganoderma spore on human hepatocarcinoma cell line HepG2 and growth of transplanted tumor in nude mice. Shijie Huaren Xiaohua Zazhi 2008; 16(10): 1114-1118
- URL: https://www.wjgnet.com/1009-3079/full/v16/i10/1114.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i10.1114
灵芝是担子菌纲多孔科灵芝属真菌, 其生长成熟后所散发出来的孢子体即灵芝孢子粉. 灵芝孢子粉富含多糖肽, 有机锗, 多种氨基酸, 脂肪酸及微量元素等成份. 临床报道孢子粉可改善机体的免疫功能, 防治癌症, 减轻患者对放、化疗的不良反应. 以往药理研究表明, 灵芝孢子粉可增强免疫功能, 并对多种移植性动物肿瘤有明显的抑制作用[1-3]. 但灵芝孢子粉对体外培养人癌细胞的直接作用及人癌裸鼠移植瘤治疗作用的研究则较少. 本文报道灵芝孢子粉体外对人肝癌细胞株HepG2生长的抑制作用及对裸小鼠人HepG2移植瘤的抗肿瘤作用的研究.
HepG2为人肝癌细胞株, 武汉大学中国典型培养物保藏中心, 用DMEM培养基(含100 mL/L小牛血清, 青霉素100 kU/L, 链霉素100 mg/L), 37℃, 50 mL/L CO2培养. 实验动物为6-9 wk龄BALB/c裸小鼠, 22-30 g, 23只, 雌雄兼有, 无特定病原体(SPF)条件下饲养, 由南方医科大学动物实验中心提供. 灵芝孢子粉(B), 广州盈康科技有限公司提供. 5-氟脲嘧啶(5-Fluorouracil, 5-FU), 江苏南通精华制药有限公司产品. 噻唑蓝(MTT), Sigma产品, 北京鼎国公司分装, 用PBS配制成5 g/L溶液, 无菌滤膜过滤, 4℃避光保存.
1.2.1 体外细胞毒实验(MTT法): 按照Mosmann et al[4]描述的方法进行实验. 取对数生长期的HepG2细胞, 2.5 g/L胰酶消化成单个细胞, 配制细胞悬液, 计数板计数为5×107cell/L, 于96孔培养板内每孔接种100 µL(每孔含5×103个细胞, 经反复实验得出较为合适的细胞数目), 放入培养箱中孵育, 24 h贴壁弃上清液, 加入180 µL DMEM培养基继续孵育24 h使细胞生长同步化. 用加入终浓度为10 g/L DMSO的DMEM配制灵芝孢子粉B, 设5个浓度, 5 g/L、2.5 g/L、1.25 g/L、0.625 g/L、0.3125 g/L, 并用0.22 µm微孔滤膜过滤除菌. 阳性对照5-FU DMEM稀释, 使终浓度为180 mg/L(通过从250 mg/L、180 mg/L、150 mg/L、120 mg/L、90 mg/L、60 mg/L等6个浓度中筛选出较合适浓度). 并设调零孔, 空白对照及等体积DMSO溶剂对照, 每组设5-6个平行孔. 待HepG2细胞同步化完成后, 加入药物20 µL/孔, 空白孔加入等量DMEM. 放入孵箱中分别孵育24 h、48 h、72 h、96 h后, 每孔加入MTT 20 µL, 放入孵箱继续孵育4-6 h. 终止培养, 小心吸弃孔内培养液上清, 每孔加入DMSO 150 µL, 振摇15 min, 使甲臢结晶充分溶解. 于酶标仪570 nm处测各孔A值, 并计算药物对细胞生长的抑制率, 抑制率 = (1-给药组平均A值/对照组平均A值)×100%. 以上每组实验重复3次, 并用Logit法计算半数抑制浓度IC50值.
1.2.2 体内抑瘤实验(人肝癌细胞HepG2裸鼠移植瘤的生长抑制实验): 取对数生长期的人肝癌HepG2细胞, 2.5 g/L胰酶消化后, 用无血清DMEM配成1×1010 cell/L的单细胞悬液. 在无菌条件下接种于裸鼠腋窝皮下, 0.2 mL/只(相当于每只裸鼠接种2×106个肿瘤细胞)[5]. 接种1 wk后可见肿瘤生长, 当肿瘤大小到直径约为3-4 mm时(接种10 d以后), 将荷瘤裸鼠按肿瘤大小随机分为3组, 每组7-8只裸鼠, 雌雄兼有, (1)空白组: 生理盐水100 mL/kg, ig, 每日给药; (2)阳性对照组: 5-FU, 用生理盐水稀释, 无菌分装, 20 mg/kg, ip, 隔日给药; (3)给药组: 灵芝孢子粉B, 5 g/L CMC-Na配制, 高压灭菌, 2000 mg/kg, ig, 每日给药. 共给药21 d. 自接种后每日测量裸鼠体质量, 每周用游标卡尺测量裸鼠肿瘤的长(a)短(b)径, 并按以下公式计算相对体积. V = 0.5ab2, 各组按时间点的平均瘤体积作生长曲线图. 末次给药后24 h时处死动物, 剥离肿瘤称质量. 做大体和病理观察, 部分肿瘤组织用40 g/L多聚甲醛固定, 石蜡包埋, 连续4 µm切片, HE染色, 光镜下观察肝癌细胞坏死, 形态改变情况. 计算各组抑瘤率, 抑瘤率 = (1-用药组平均瘤质量/空白组平均瘤质量)×100%, 实验重复两次.
统计学处理 用SPSS10.0统计软件进行分析, 结果以mean±SD表示, 用One-Way ANOVA和t-test进行分析. 给药组组间比较用LSD法.
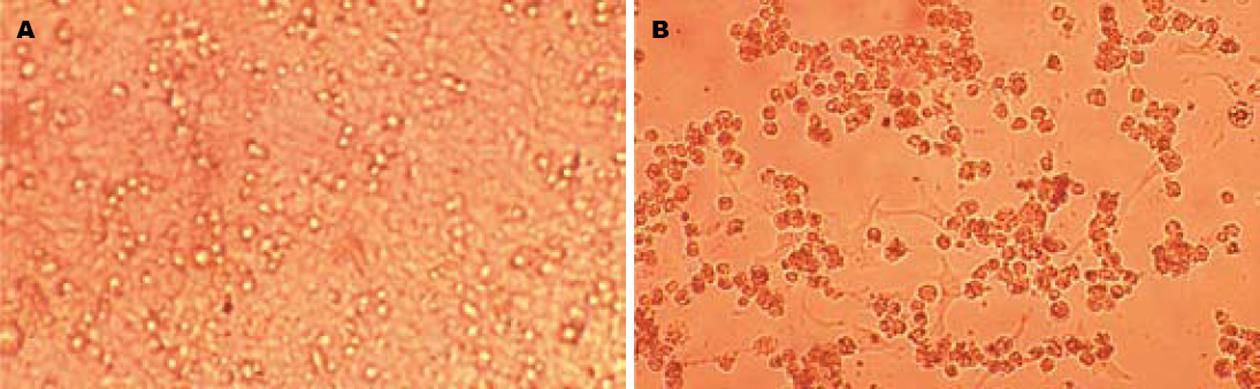
灵芝孢子粉水溶性成份对HepG2细胞具有明显的抑制作用, 随着时间延长和剂量的增加, 对肿瘤细胞的抑制作用越强, 具有一定的时间和剂量效应关系. B药对HepG2细胞的IC50值, 随着作用时间增加而减小, 在72 h时达到最低, B药的IC50值为2.14 g/L, 表明HepG2细胞在72 h时对B药最为敏感(表1). 空白组和B组作用72 h后镜下观察结果, 可看出灵芝孢子粉对HepG2细胞具有明显的抑制作用(图1A-B).
| 药物 | 剂量(mg/kg) | 48 h | 72 h | 96 h | ||||||
| A570 | IR(%) | IC50(CI 95%) | A570 | IR(%) | IC50(CI 95%) | A570 | IR(%) | IC50(CI 95%) | ||
| 对照组 | _ | 1.109±0.003 | 1.503±0.046 | 1.774±0.035 | ||||||
| 5-FU | 180 | 0.582±0.013 | 47.5b | 0.389±0.014 | 74.1b | 0.341±0.005 | 80.1b | |||
| 灵芝孢 | 5 | 0.691±0.009 | 37.7b | 14.2 | 0.678±0.016 | 54.9b | 2.14 | 0.829±0.023 | 53.3b | 2.88 |
| 子粉B药 | 2.5 | 0.774±0.018 | 30.2b | (6.42-89.65) | 0.740±0.016 | 50.8b | (1.73-2.32) | 0.916±0.006 | 48.4b | (2.05 -4.83) |
| 1.25 | 0.838±0.017 | 24.4b | 0.790±0.009 | 47.1b | 0.966±0.032 | 45.5b | ||||
| DMSO | 0.992±0.080 | 1.465±0.038 | 1.694±0.047 | |||||||
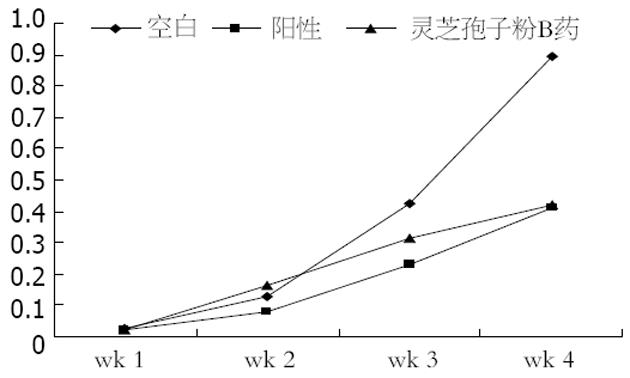
高剂量的灵芝孢子粉B对裸小鼠移植瘤的生长具有一定抑制作用, 并且对裸鼠体质量增加无影响(表2). 观察其活动进食状况均无明显异常, 表明灵芝孢子粉B对裸鼠的生长并无明显的毒副作用. 当ig给药剂量为2000 mg/kg时, 其对裸鼠移植瘤生长的抑制率达到了57.0%(图2, 表3).
| 分组 | n | 肿瘤体积(cm3) | |||
| wk 1 | wk 2 | wk 3 | wk 4 | ||
| 对照组 | 7 | 0.025±0.012 | 0.127±0.077 | 0.426±0.357 | 0.896±0.345 |
| 5-FU | 8 | 0.023±0.012 | 0.081±0.030 | 0.231±0.122 | 0.413±0.228a |
| 灵芝孢子粉B药 | 8 | 0.024±0.010 | 0.163±0.121 | 0.312±0.161 | 0.420±0.179a |
灵芝被公认为扶正固本, 滋补强壮的传统中药. 灵芝孢子粉是灵芝的精华, 其有效成份[6-8]如多糖类、腺苷类、氨基酸类、维生素类远远超过了灵芝. 近年来研究表明灵芝具有多方面的生理活性及药理作用[9-13]. 目前认为, 灵芝孢子粉的抗肿瘤作用与增强免疫功能有关[14-17].
在本实验条件下, 体外实验表明高剂量的灵芝孢子粉对HepG2细胞具有直接的抑制作用, 并成剂量和时间依赖性. 生药剂量为5 g/L的灵芝孢子粉水溶液, 作用96 h, 抑制率最高可达55.6%. 虽然其对HepG2的IC50值与一些抗癌药物相比较低, 但由于水中溶解成份有限, 因此仍可认为对肿瘤细胞的生长具有直接的抑制作用. 体内实验结果也表明, 灵芝孢子粉对于裸鼠人HepG2移植瘤具有一定的抑制作用. 给药剂量2000 mg/kg, 抑瘤率可达57.0%, 且无明显毒副作用. 另方面, 本实验采用BALB/C-nu品系的裸鼠, 无胸腺且功能性T淋巴细胞缺损, 免疫机能低下. 在此情况下, 灵芝孢子粉仍对移植瘤具有一定的抑制作用, 说明其作用机制不单单在于提高机体免疫力, 更有可能与直接抑制肿瘤生长有关. 因此无论在体内或体外, 灵芝孢子粉对肿瘤细胞均有一定的直接抑制作用.
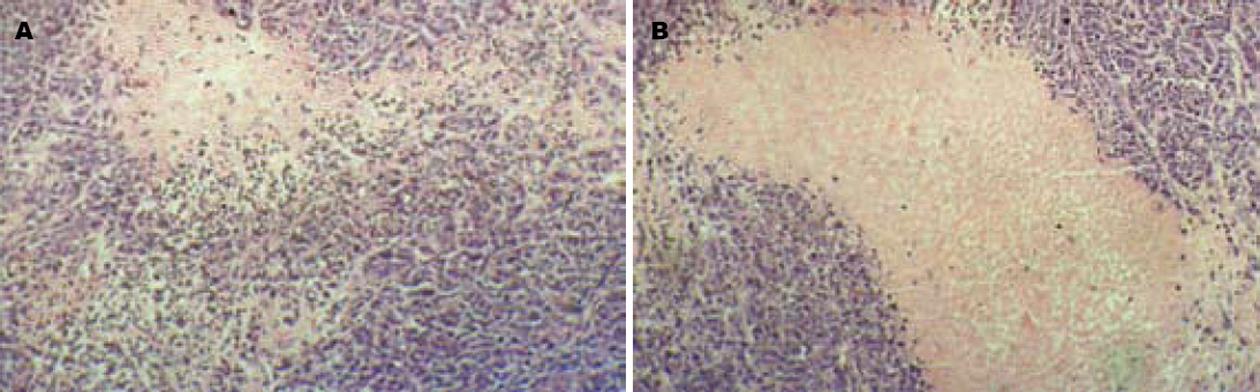
目前灵芝孢子粉在体内外抑制肿瘤细胞生长的作用机制尚不清楚, 一些研究表明其抗肿瘤作用可能与抑制TOPⅠ、TOPⅡ异构酶[18], 破坏肿瘤细胞端粒酶[19]有关. 本实验中肿瘤组织的病理切片HE染色后观察, 发现给药组与对照组相比, 不但坏死区域增加, 纤维化明显, 而且间质血管明显少于对照组, 提示其作用机制或许也与抑制肿瘤血管生成有关. 其具体的作用机制还需进一步实验研究.
灵芝是担子菌纲多孔科灵芝属真菌, 公认为扶正固本, 滋补强壮的传统中药. 临床报道孢子粉可改善机体的免疫功能, 防治癌症, 减轻患者对放、化疗的不良反应.
张吉翔, 教授, 南昌大学第二附属医院消化内科
药理研究表明, 灵芝孢子粉可增强免疫功能, 并对多种移植性动物肿瘤有明显的抑制作用.
近年来研究表明灵芝具有多方面的生理活性及药理作用. 目前认为, 灵芝孢子粉的抗肿瘤作用与增强免疫功能有关.
灵芝孢子粉: 灵芝生长成熟后所散发出来的孢子体, 富含多糖肽, 有机锗, 多种氨基酸, 脂肪酸及微量元素等成份.
本文就灵芝孢子粉对人干癌细胞HepG2及其裸鼠移植瘤生长的作用进行研究, 发现灵芝孢子粉具有抑制肿瘤生长的作用, 具有较大的科学价值.
编辑: 程剑侠 电编:郭海丽
| 1. | 李 怡岚, 乔 姗姗, 李 国兴. 灵芝粉抗肿瘤及提高机体免疫力作用的研究. 中国慢性病预防与控制. 2004;12:156-157, 160. |
| 4. | Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983;65:55-63. [PubMed] [DOI] |
| 5. | 魏 泓. 医学实验动物学. 第2版. 成都: 四川科学技术出版社 2001; 595-596. |
| 11. | 郭 家松, 沈 志勇, 詹 朝双, 李 艳, 李 振林. 灵芝孢子粉及灵芝孢子蜂胶对急性胃溃疡形成的影响. 第一军医大学分校学报. 2004;27:21-22. |
| 14. | 王 鹏云, 王 赛贞, 林 树钱, 林 志彬. 灵芝孢子和破壁孢子多糖对体外培养的小鼠脾淋巴细胞及腹腔巨噬细胞免疫调节活性的比较. 北京大学学报(医学版). 2005;37:569-574. |