修回日期: 2008-02-25
接受日期: 2008-03-28
在线出版日期: 2008-04-08
目的: 研究壮肝逐瘀煎对肝纤维化(HF)大鼠TβRⅠ/Ⅱ、Smad3、Smad4和Smad7表达的影响.
方法: Wistar大鼠44只, 随机取8只作为正常对照(A)组; 余大鼠用CCl4复合因素法进行HF造模, 4 wk随机处死4只证实HF形成后随机分为病理模型(B)组、壮肝逐瘀煎治疗(C)组、秋水仙碱对照(D)组、大黄蟅虫丸对照(E)组. B组予生理盐水ig, C、D、E组予相应药液ig. 6 wk后获取肝组织, HE染色观察HF程度; 用免疫组化、图像分析方法对TβRⅠ/Ⅱ、Smad3、Smad4、Smad7的组织分布进行半定量分析.
结果: 与B组比较, C、D、E组肝小叶结构趋于正常, 肝组织TβRⅠ/Ⅱ、Smad3、Smad4表达显著减少(TβRⅠ: 2.75±0.10, 3.14±0.07, 3.44±0.06 vs 5.47±0.13, P<0.01; TβRⅡ: 1.86±0.12, 2.09±0.10, 2.53±0.12 vs 3.52±0.15, P<0.01; Smad3: 2.28±0.59, 3.84±1.11, 3.97±0.90 vs 5.65±1.28, P<0.01; Smad4: 1.57±0.53, 3.15±0.79, 3.37±0.78 vs 5.25±1.60, P<0.01), Smad7表达显著增加(3.45±0.58, 2.09±0.38, 1.75±0.29 vs 0.73±0.34, P<0.01), C组强于D、E组(P<0.01).
结论: 壮肝逐瘀煎能显著改善HF组织病理变化, 其作用机制可能与壮肝逐瘀煎调控TβRⅠ/Ⅱ、Smad3、Smad4、Smad7的表达有关.
引文著录: 林寿宁, 王振常, 何磊, 韦刚, 郑身宏. 壮肝逐瘀煎对肝纤维化大鼠TβRⅠ/Ⅱ、Smad3、Smad4和Smad7表达的影响. 世界华人消化杂志 2008; 16(10): 1105-1109
Revised: February 25, 2008
Accepted: March 28, 2008
Published online: April 8, 2008
AIM: To investigate the effects of Zhuanggan Zhuyu Decoction (ZZD) on the expression of TβRⅠ/Ⅱ, Smad3, Smad4 and Smad7 in experimental liver fibrosis of rats, and to explore its anti-fibrotic molecular mechanism.
METHODS: Forty-four Wistar rats were used in this study, 8 of which were selected as normal controls (group A), and the rest were used to establish liver fibrosis model with carbon tetrachloride (CCl4) and combined factors. At the 4th wk, four rats were executed to confirm the formation of liver fibrosis, and then the rest of rats were randomly divided into the pathological model group (B), ZZD-treated group (C), colchicine-treated group (D) and Dahuang Zhechong Pill-treated group (E). The rats in group B were treated (ig) with saline. At the end of the 6th wk, the formation of hepatic fibrosis was observed by HE staining and the expression of TβRⅠ/Ⅱ, Smad3, Smad4 and Smad7 were detected by SP immunohistochemistry.
RESULTS: Six weeks later, in comparison with that in group B, the structure of liver lobules almost restored to normal in groups C, D and E; the fibrous septum became thinner; the expression of TβRⅠ/Ⅱ, Smad3 and Smad4 were also significantly decreased (TβR-Ⅰ: 2.75 ± 0.10, 3.14 ± 0.07, 3.44 ± 0.06 vs 5.47 ± 0.13, P < 0.01; TβR-Ⅱ: 1.86 ± 0.12, 2.09 ± 0.10, 2.53 ± 0.12 vs 3.52 ± 0.15, P < 0.01; Smad3: 2.28 ± 0.59, 3.84 ± 1.11, 3.97 ± 0.90 vs 5.65 ± 1.28, P < 0.01; Smad4: 1.57 ± 0.53, 3.15 ± 0.79, 3.37 ± 0.78 vs 5.25 ± 1.60, P < 0.01), whereas the expression of Smad7 was significantly increased (3.45 ± 0.58, 2.09 ± 0.38, 1.75 ± 0.29 vs 0.73 ± 0.34, P < 0.01). The effect in group C was stronger than that in group D or E, and the differences were significant (both P < 0.01).
CONCLUSION: ZZD can reverse liver fibrosis induced by CCl4 and combined factors and the mechanism may be associated with its effect on regulating and controlling the expression of TβRⅠ/Ⅱ, Smad3, Smad4 and Smad7.
- Citation: Lin SN, Wang ZC, He L, Wei G, Zheng SH. Effects of Zhuanggan Zhuyu Decoction on expression of TβRⅠ/Ⅱ, Smad3, Smad4 and Smad7 in experimental liver cirrhosis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(10): 1105-1109
- URL: https://www.wjgnet.com/1009-3079/full/v16/i10/1105.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i10.1105
我们的前期研究表明, 壮肝逐瘀煎能抑制肝纤维化(hepatic fibrosis, HF)大鼠肝星状细胞(hepatic stellate cell, HSC)的活化和增殖, 减轻肝脏炎症及纤维化程度, 具有抗肝纤维化作用[1]. 为进一步探讨该方抗HF作用的机制, 我们运用CCl4诱导的大鼠HF模型, 观察壮肝逐瘀煎对HF大鼠TβRⅠ/Ⅱ、Smad3、Smad4、Smad7表达的影响, 现报告如下.
清洁级Wistar大鼠44只, 雌雄各半, 体质量220-250 g, 广西中医学院实验动物中心提供. 壮肝逐瘀煎颗粒剂, 江苏江阴天江药业有限公司生产, 由广西中医学院瑞康医院药剂科提供, 药物组成有当归、灵芝、鳖甲、黄芪、绞股蓝、地鳖虫、田七、虎杖等; 秋水仙碱, 湛江中承制药有限公司生产, 大黄蟅虫丸, 湛江中承制药有限公司生产, CCl4分析纯, 天津易发化学试剂厂生产, TβR-Ⅰ/Ⅱ、Smad3、Smad4、Smad7免疫组化试剂盒及DAB显色SP试剂盒购自北京普京康生物技术有限公司.
Wistar大鼠随机取8只作为正常对照(A)组, 给予正常饲养; 剩余大鼠参照文献[2]以CCl4复合因素造模方法(高脂低蛋白食物配合100 mL/L乙醇为唯一饮料)进行HF造模, 于4 wk末造模结束时随机处死4只, 证实中度HF形成. 其余造模大鼠40只随机分为病理模型(B)组、壮肝逐瘀煎颗粒剂治疗(C)组、秋水仙碱对照(D)组、大黄蟅虫丸对照(E)组共5个组, 每组8只. 各组于造模结束后即分别予以与治疗组药物同体积的ig给药, 各组剂量选择参考文献[2]方法, 以临床常用量按体表面积换算, 其中壮肝逐瘀煎实验ig剂量约相当于成人日用量的20倍. B组给予0.9%氯化钠; C组给予壮肝逐瘀煎1 g/100 g; D组给予秋水仙碱10 µg/100 g; E组给予大黄蟅虫丸0.15 g/100 g. 均1次/d, 共6 wk. 为防止肝脏自然修复对实验结果的影响, 除A组外其余各组于用药开始后每周按3 mL/kg注射1次400 mL/L CCl4. 各组于用药治疗6 wk后, 禁食12 h, 称质量, 10 g/L戊巴比妥麻醉, 股动脉采血后处死, 剖取肝脏, 取肝脏右叶相同部位组织1块置入40 g/L甲醛, 作常规石蜡切片. 各组肝组织相同部位石蜡切片苏木精-伊红(HE)染色, 光镜观察. HF的分级参照文献[3]标准, 将HF分为6级, 正常为0级, 每张切片随机选取5个视野, 分别记录病理分级, 并取其平均值作为该动物肝脏的病理分级. 应用链菌素亲生物素-过氧化物酶(S-P)免疫组化染色方法, 具体操作参照试剂盒说明书. TβR-Ⅰ/Ⅱ、Smad3、Smad4及Smad7蛋白免疫反应以细胞浆内出现棕黄色颗粒或团块判断为阳性细胞. 图像分析采用MIAS医学分析软件进行半定量分析, 随机选取每张切片5个视野(×400)测定阳性面积比.
统计学处理 数据均以mean±SD表示, 统计推断采用SPSS11.5软件进行组间方差分析. 以P<0.05为有统计学差异.
光镜观察, A组肝小叶结构完整清晰, 呈条索状向四周放射状排列. B组多数正常小叶结构破坏或消失, 粗大胶原纤维分割、包绕肝小叶, 肝细胞索排列紊乱, 肝细胞水肿明显, 脂肪变性广泛, 部分有坏死, 纤维隔内大量炎细胞浸润. 与B组比较, 各治疗组肝小叶结构破坏明显减轻, 胶原纤维增生较少, 纤维疏松变窄, 肝细胞水肿及变性不明显, 炎细胞浸润较少. 其中以C、D组及E组HF程度较低(表1).
| 肝纤维化程度分级 (n) | |||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| A组 | 8 | 0 | 0 | 0 | 0 | 0 | 0 |
| B组 | 0 | 0 | 0 | 0 | 1 | 5 | 2 |
| C组 | 0 | 0 | 1 | 4 | 3 | 0 | 0 |
| D组 | 0 | 0 | 1 | 3 | 2 | 1 | 1 |
| E组 | 0 | 0 | 1 | 2 | 3 | 2 | 0 |
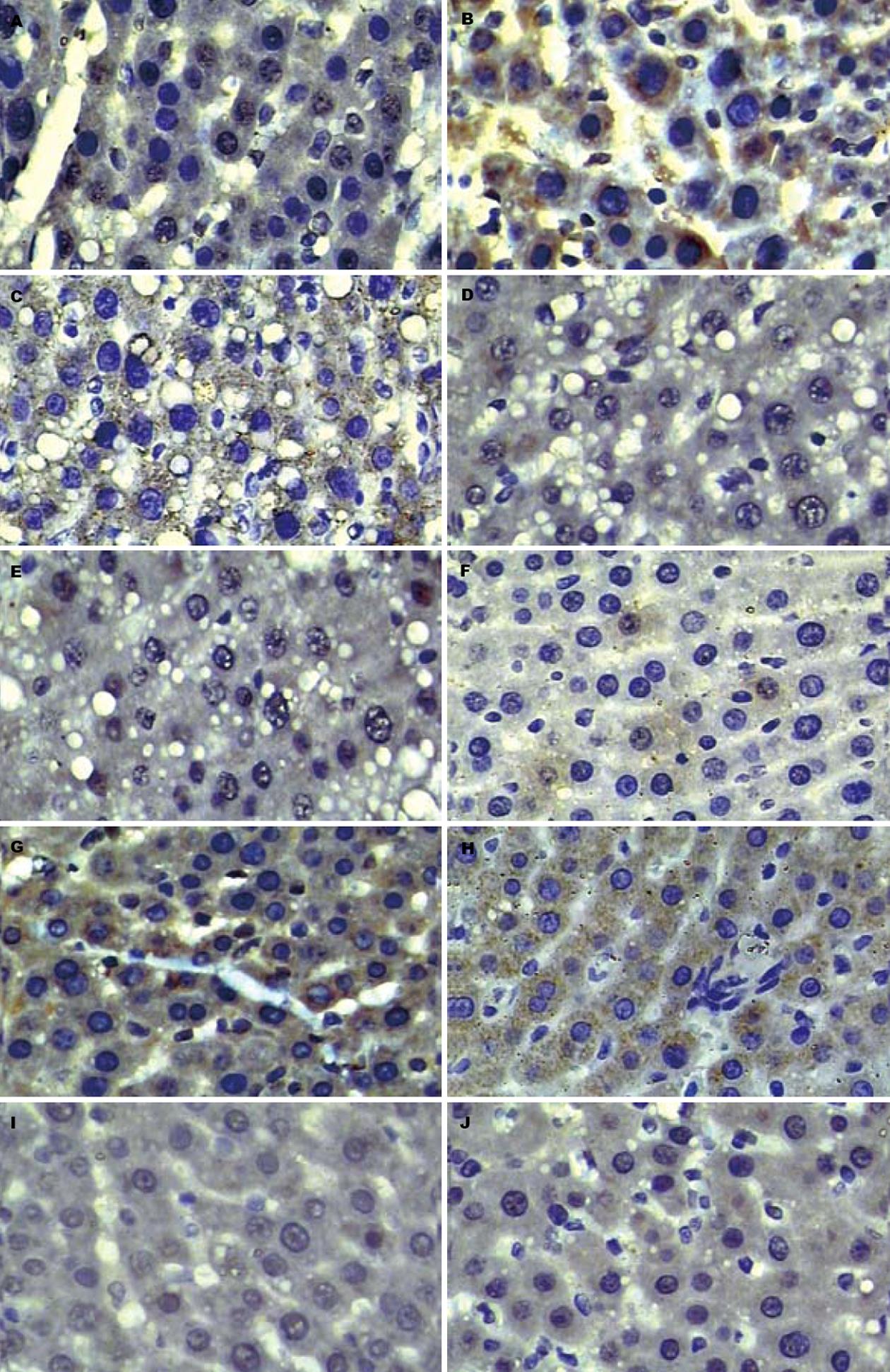
A组TβR-Ⅰ/Ⅱ、Smad3、Smad4的表达很少, 而Smad7的表达十分明显. B组TβR-Ⅰ/Ⅱ、Smad3、Smad4的表达显著升高, Smad7表达极少, 两组比较有显著性差异(P<0.01). C、D、E组TβR-Ⅰ/Ⅱ、Smad3、Smad4的表达均比A组明显增加(P<0.01), Smad7的表达则比A组明显减少. 但C、D、E组TβR-Ⅰ/Ⅱ、Smad3、Smad4表达的增加均没有B组显著, Smad7的表达减少也没有B组显著, C、D、E组TβR-Ⅰ/Ⅱ、Smad3、Smad4 、Smad7的表达与B组比较, 有显著性差异(P<0.01). 在C、D、E组各组中, C组TβR-Ⅰ/Ⅱ、Smad3、Smad4的表达较少, 而Smad7的表达较多, C组与D、E组比较, 有显著性差异(P<0.01, 表2, 图1).
| 分组 | TβR-Ⅰ | TβR-Ⅱ | Smad3 | Smad4 | Smad7 |
| A组 | 0.63±0.05b | 0.33±0.07b | 0.17±0.74b | 0.15±1.06b | 4.28±0.30b |
| B组 | 5.47±0.13 | 3.52±0.15 | 5.65±1.28 | 5.25±1.60 | 0.73±0.34 |
| C组 | 2.75±0.10bdfh | 1.86±0.12bdfh | 2.28±0.59bdfh | 1.57±0.53bdfh | 3.45±0.58bdfh |
| D组 | 3.14±0.07bd | 2.09±0.10bd | 3.84±1.11bd | 3.15±0.79bd | 2.09±0.38bd |
| E组 | 3.44±0.06bd | 2.53±0.12bd | 3.97±0.90bd | 3.37±0.78bd | 1.75±0.29bd |
HF是多种慢性肝病病情发展的共同病理基础, 是各种致病因素导致肝内弥散性细胞外基质(extracelluar matrix, ECM)过度沉积的病理过程, 其实质是肝细胞外间质的结缔组织增生. TGF-β1是促进肝纤维化发生、发展的最重要的细胞因子之一. 其具体机制为活化HSC, 增加ECM合成, 抑制ECM降解, 调节ECM受体的表达.
TGF-β1生物效应的发挥必须通过特定的信号传导过程[4]. TGF-β1胞外激活后, 与其胞膜上特异性受体(TβR-Ⅰ/Ⅱ)结合, 继而主要由Smads蛋白介导胞内信号传递. Smad蛋白家族是TGF-β1受体后信息分子, 参与调控细胞的增殖、转化、合成、分泌和凋亡. 根据Smads结构和功能特点, 可将其分为3类[5]: 受体调节性Smads, 主要有Smad1, 2, 3, 5, 8, 为TβR复合物的下游信号分子, 其中Smad2, 3主要介导TGF-β和生物素的信号; 公用Smads是TGF-β必需的信号转导分子, 目前在哺乳动物发现的有Smad4; 抑制性Smads, 主要有Smad6, 7, 抑制其他二类Smads的活性. 当TβR-Ⅰ激活后, 下游分子Smad2与Smad3与TβR-Ⅰ发生短暂结合而直接发生磷酸化, 而Smad4被活化的TβR-Ⅰ间接激活. 激活的Smad2、Smad3和Smad4聚集成共同复合体或形成数个异源二聚体复合物. 其中Smad4是最关键和共同的信号传导分子, 所有的其他均通过与其结合后, 才能转入核内诱导靶基因转录[6]. 有关文献报道肝纤维化时Smad家族的表达模式, 发现大鼠肝纤维化HSC的激活主要与Smad3有关[7], Inagaki et al[8]研究发现胶原分泌细胞中Smad3的激活可能是纤维化病变的关键环节. 这一超家族成员中, Smad7具有与其他信息分子不同的负性调节作用, 研究表明Smad7可以抑制TGF-β诱导的肝细胞凋亡、HSC活化、MFB增殖和胶原合成分泌增加等作用[5,9]. 虽然病理状态下Smad7和Smad6以负反馈的方式制约Smad3、2功能的调节机制发生异常, 但对Smad6在肝纤维化的负反馈调节作用的研究尚未见报道. 目前研究表明, 调控TGF-β1信号途径是治疗肝纤维化的有效方法[10-13].
壮肝逐瘀煎是在林沛湘教授治疗慢性肝炎、肝炎肝硬化有效验方基础上组方而成[14]. 林沛湘教授认为[14]慢性肝炎长期不愈, 进展为HF的中医基本病机是肝虚瘀结. 肝虚指的是肝脏的阴血亏竭, 又兼脾肾不足; 瘀结所指, 乃瘀血及湿毒蕴结之意. 故治疗应当以壮肝逐瘀为要. 壮肝即是扶正, 包括益肝, 健脾, 补肾. 以养肝之阴血为主, 兼顾健脾益肾. 通过扶助机体的正气, 以达到壮肝的目的. 逐瘀即是祛邪, 含有活血祛痰, 解毒化湿等. 壮肝逐瘀煎基本上为二组药物组成. 一是补益药, 体现养肝扶正的治法. 其中当归、灵芝、鳖甲养益肝肾之精血, 黄芪补中益气健脾, 绞股兰既益气扶正又具解毒之功; 二是祛瘀解毒药物, 慢性肝炎发展到HF之瘀血证候, 日久重笃, 已成癥瘕之势, 非一般活血药物所能及. 地鳖虫、鳖甲等活血逐瘀, 破积消癥, 有祛除肝脏瘀血, 通理血脉涩滞之功. 田七活血而不耗血, 止血而不涩血, 是疗瘀的要药, 虎杖清热利湿, 活血解毒以除其邪, 此方正是根据肝纤维化的病理环节组方. 我们以前的研究发现[1], 壮肝逐瘀煎能降低HA、LN、PC-Ⅲ、IV-C水平, 抑制肝内间质反应和贮脂细胞活化, 从而减少胶原等基质的合成, 促进其分解, 加速肝内新生纤维组织的重吸收, 但对其作用的分子机制不太明确. 我们近期研究发现[15]: 该方能下调血清TGF-β1的表达. 本次实验显示, 壮肝逐瘀煎亦能够抑制大鼠肝TβR-Ⅰ、TβR-Ⅱ的表达, 并可调控smad3、4、7的水平. 说明其抗HF的机制之一可能是由于影响TGF-β1/smads细胞内信号传导, 减少HSC的活化, 降低胶原的表达和分泌, 从而缓解HF的发生和发展. 本实验选用的两组对照药物都有较理想的疗效、临床较常用且实验研究充分, 作用机制较明确. 众多研究显示: 秋水仙碱对肝细胞病变有修复作用, 可以刺激胶原酶的活性, 促进胶原的降解, 可显著降低肝内Ⅲ型和Ⅳ型胶原蛋白水平, 降低血清中PⅢP、 CIV、HA、IN水平, 明显抑制基质金属蛋白酶抑制剂-1(TIMP-1)的表达, 促进Ⅰ、Ⅲ型胶原的降解, 对CCl4诱导的肝纤维化具有良好的预防作用, 其机制可能与抑制TGF-β1、TNF-α等致纤维化细胞因子的分泌有关[1,15-17]. 大黄蟅虫丸是治疗肝纤维化的有效中成药. 研究表明: 大黄蟅虫丸能较快改善慢性肝病患者的症状, 可使多项肝生化指标明显好转, 改善肝脏肝细胞摄取和排泄功能, 抑制TGF-β1等促纤维化细胞因子[1,15]. 本组实验结果表明: 在对肝纤维化病理变化的改善和对肝组织TβRⅠ/Ⅱ、Smad3、Smad4、Smad7表达的调控方面, 壮肝逐瘀煎均优于秋水仙碱及大黄蟅虫丸.
肝纤维化的中医药治疗源远流长, 效果显著. 近年来关于肝纤维化发生、发展及逆转的现代生物机制的研究取得较大进展. 用现代生物技术阐释中医药的治疗机制是中医界面临的重要研究任务.
许玲, 副教授, 中国人民解放军第二军医大学附属长征医院中医科
TGF-β1/Smads信号传导途径是肝纤维化最重要的调控机制之一, 其传导过程已基本阐明, 复方中药对该信号通路的干预是当前重要的研究热点.
Gressner et al研究表明, 调控TGF-β信号途径是治疗肝纤维化的有效方法, 而针对发病机制某些关键环节的治疗必然存在一定的局限性和副作用, 而复方中药多途径、多靶位的作用恰恰体现了其独特的优势.
本研究观察了TGF-β1/Smads信号传导途径中几乎全部意义明确的调控因子, 在结合现代生物医学进展解释名老中医学术理论的同时, 进一步研究明确该信号通路众多信号因子之间相互影响共同作用的机制.
本研究有利于中医学术经验的继承和发扬, 为相关的科研工作提供了借鉴和参考, 为壮肝逐瘀煎的研究开发和推广应用提供实验依据.
本文有较好的科学性, 可读性, 具有一定的临床指导意义.
编辑: 程剑侠 电编:吴鹏朕
| 1. | 林 寿宁, 黄 贵华, 王 振常, 黄 彬. 壮肝逐瘀煎抗大鼠肝纤维化的实验研究. 中国中西医结合消化杂志. 2004;12:267-270. |
| 2. | 徐 叔云, 卞 如濂, 陈 修. 实验药理方法学. 第3版. 北京: 人民卫生出版社 2002; 202-1351. |
| 3. | 王 宝恩, 王 惠吉, 朱 家璇, 刘 尔瑜. 复方丹参不同剂型治疗肝纤维化实验研究与临床观察. 胃肠病学和肝病学杂志. 1993;2:69-72. |
| 4. | Massague J. TGF-beta signal transduction. Annu Rev Biochem. 1998;67:753-791. [PubMed] [DOI] |
| 5. | Qi Z, Atsuchi N, Ooshima A, Takeshita A, Ueno H. Blockade of type beta transforming growth factor signaling prevents liver fibrosis and dysfunction in the rat. Proc Natl Acad Sci U S A. 1999;96:2345-2349. [PubMed] [DOI] |
| 6. | Correia JJ, Chacko BM, Lam SS, Lin K. Sedimentation studies reveal a direct role of phosphorylation in Smad3:Smad4 homo- and hetero-trimerization. Biochemistry. 2001;40:1473-1482. [PubMed] [DOI] |
| 7. | Schnabl B, Kweon YO, Frederick JP, Wang XF, Rippe RA, Brenner DA. The role of Smad3 in mediating mouse hepatic stellate cell activation. Hepatology. 2001;34:89-100. [PubMed] [DOI] |
| 8. | Inagaki Y, Mamura M, Kanamaru Y, Greenwel P, Nemoto T, Takehara K, Ten Dijke P, Nakao A. Constitutive phosphorylation and nuclear localization of Smad3 are correlated with increased collagen gene transcription in activated hepatic stellate cells. J Cell Physiol. 2001;187:117-123. [PubMed] [DOI] |
| 9. | Nakamura T, Sakata R, Ueno T, Sata M, Ueno H. Inhibition of transforming growth factor beta prevents progression of liver fibrosis and enhances hepatocyte regeneration in dimethylnitrosamine-treated rats. Hepatology. 2000;32:247-255. [PubMed] [DOI] |
| 10. | Breitkopf K, Haas S, Wiercinska E, Singer MV, Dooley S. Anti-TGF-beta strategies for the treatment of chronic liver disease. Alcohol Clin Exp Res. 2005;29:121S-131S. [PubMed] [DOI] |
| 11. | Liu X, Hu H, Yin JQ. Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis. Liver Int. 2006;26:8-22. [PubMed] [DOI] |
| 12. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 13. | Jiang W, Yang CQ, Liu WB, Wang YQ, He BM, Wang JY. Blockage of transforming growth factor beta receptors prevents progression of pig serum-induced rat liver fibrosis. World J Gastroenterol. 2004;10:1634-1638. [PubMed] [DOI] |
| 14. | 林 寿宁. 中国百年百名中医临床家丛书-林沛湘. 北京: 中国中医药出版社 2001; 23-39. |