修回日期: 2008-02-29
接受日期: 2008-03-28
在线出版日期: 2008-04-08
目的: 构建并鉴定绿色荧光蛋白为报告基因的pEGFP-N1-FUT4真核表达载体.
方法: 采用RT-PCR方法获得α1, 3-岩藻糖基转移酶IV(FUT4)全长基因, 克隆至pEGFP-N1-FUT4表达载体并进行鉴定. 通过脂质体转染到人表皮癌细胞系A431中, 荧光显微镜下观察并经逆转录-聚合酶链反应(RT-PCR)和Western blot检测FUT4的表达.
结果: 测序及酶切鉴定证明获得人全长FUT4基因, FUT4基因正确插入pEGFP-N1中, 在荧光显微镜下观察到绿色荧光蛋白在A431细胞中的表达, RT-PCR和Western blot检测结果显示FUT4的表达明显增加.
结论: 成功构建绿色荧光蛋白为报告基因的FUT4 真核表达载体, 并检测到在A431细胞中的表达.
引文著录: 杨雪松, 贾爽, 张震波, 燕秋. 人α1, 3-岩藻糖基转移酶IV荧光真核表达载体的构建及鉴定. 世界华人消化杂志 2008; 16(10): 1064-1068
Revised: February 29, 2008
Accepted: March 28, 2008
Published online: April 8, 2008
AIM: To construct and identify the eukaryotic expression vector pEGFP-N1-FUT4 with en-hanced green fluorescent protein (EGFP) gene.
METHODS: The full-length fucosyltransferase 4 (FUT4) cDNA was acquired by reverse transcription-polymerase chain reaction (RT-PCR) and cloned into pEGFP-N1vector. The obtained pEGFP-N1-FUT4 was transiently transfected into cell line A431. Then the expression of FUT4 was observed under fluorescence microscope and examined by semi-quantitative RT-PCR and Western blotting.
RESULTS: The full-length human FUT4 cDNA was obtained and identified correct through sequencing and enzyme digestion. The recombinant plasmid pEGFP-N1-FUT4 was successfully constructed and FUT4 cDNA was correctly inserted into pEGFP-N1-FUT4. The expression of EGFP in A431 cells transfected with pEGFP-N1-FUT4 was observed by fluorescence microscopy. Semi-quantitative RT-PCR and Western blotting showed that FUT4 expression significantly increased after pEGFP-N1-FUT4 transfection in A431 cells in comparison with that in the controls.
CONCLUSION: The prokaryotic expression plasmid pEGFP-N1-FUT4 vector is successfully constructed, which could express FUT4 in A431 cells.
- Citation: Yang XS, Jia S, Zhang ZB, Yan Q. Construction and identification of human fucosyltransferase 4 eukaryotic fluorenscent expression vector. Shijie Huaren Xiaohua Zazhi 2008; 16(10): 1064-1068
- URL: https://www.wjgnet.com/1009-3079/full/v16/i10/1064.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i10.1064
岩藻糖基转移酶(fucosyltransferase, FUT)是一类催化岩藻化寡糖合成的酶类, 其中FUT4是α1, 3岩藻糖基转移酶, 是合成细胞表面唾液酸化的Lewis Y(LeY)的特异性合成酶基因[1-3]. 研究表明, 在人类70%-90%的上皮癌中LeY高表达, 并与肿瘤细胞的生长、浸润和转移有关, 但其具体机制还不十分清楚[4-5]. 我们成功地构建了FUT4的重组表达质粒pEGFP-N1-FUT4, 转染并检测了在A431细胞中的表达, 为 FUT4在LeY阳性肿瘤生长中的表达调控研究提供了实验基础.
人表皮癌细胞系A431细胞购自美国ATCC细胞库, DMEM/F12培养液、胎牛血清、胰蛋白酶购于Gibco公司, 脂质体(LipofectamineTM 2000)及TRIzol为Invitrogen公司产品, pEGFP-N1载体购于Biosciences Clontech公司, 引物合成及测序由大连宝生物公司完成, TaKaRa cDNA kit、AMV反转录酶、Taq DNA polymerase、限制性内切酶、T4 DNA连接酶和DL 2000 Marker均为大连宝生物公司产品, 其他试剂均为国产分析纯.
采用TRIzol试剂制备人子宫内膜细胞中总RNA. 以总RNA为模板, 使用TaKaRa cDNA Kit进行逆转录反应, 最终得到cDNA. 具体操作按厂商提供的试剂盒说明书进行. 以cDNA为模板用特异引物进行PCR扩增, 依据GenBank中FUT4的mRNA的序列设计合成全基因的特异性引物, 上游5'-CCGCTCGAGATGGGGGCACCGTGGGGCTCGC-3'(下划线为XhoⅠ酶切位点), 下游5'-CCGGAATTCAGTAGAGGATCAAAAAGCTGACAAC-3(下划线为EcoRⅠ酶切位点). PCR反应条件是: 95℃预变性5 min; 95℃变性30 s, 55℃退火30 s, 72℃延伸1 min 30个循环; 最后72℃延伸5 min, 扩增片断长度为1218 bp. PCR产物用10 g/L琼脂糖凝胶电泳, 恒压100 V, 电泳35 min, 利用凝胶成像系统观察分析扩增产物的电泳结果. 用DNA凝胶回收试剂盒回收PCR产物. 用XhoⅠ+EcoRⅠ双酶切FUT4片段和pEGFP-N1载体, 得到FUT4片段和载体片段. 采用低熔点琼脂糖回收FUT4和载体片段并将两者连接, 16℃过夜. 次日, 连接反应液转化宿主菌DH5α感受态细胞, 小量提取质粒. 用内切酶XhoⅠ+EcoRⅠ双酶切进行鉴定. 将处于对数生长期的人表皮癌细胞A431用胰酶消化, 接种于24孔板, 待细胞至80%-90%铺满后换无血清无双抗DMEM/F12培养基, 用脂质体LipofectamineTM 2000介导将pEGFP-N1-FUT4真核表达质粒转染A431细胞, 具体操作按试剂操作说明书进行.转染24 h后换含100 mL/L血清的DMEM/F12继续培养经G418筛选后, 获得稳定表达FUT4的细胞株1和2, 荧光显微镜下观察绿色荧光蛋白的表达情况.
1.2.1 目的基因的RT-PCR鉴定: 收集转染48 h后的细胞, RNA提取和cDNA合成后(方法同前文), 进行PCR反应, 其条件为: 94℃预变性5 min, 94℃变性40 s, 57℃退火45 s, 72℃延伸45 s, 扩增35个循环, 72℃延伸5 min. 引物序列为上游5'-CGGACGTCTTTGTGCCTTAT-3'和下游5'- CGAGGAAAAGCAGGTACGAG-3', 扩增片段为456 bp. β-actin内参引物序列为上游5'-ATCTGGCACCACACCTTCTACAATGAGCTGCG-3' 和下游5'-CGTCATACTCCTGCTTGCTGATCCACATCTGC-3', 扩增片段为838 bp, 产物用10 g/L琼脂糖凝胶电泳检测.
1.2.2 目的基因的Western blot鉴定: 收集转染48 h后的细胞, 蛋白质提取, 采用Bradeford法测定蛋白含量. 收获的蛋白经120 g/L SDS-PAGE电泳分离后, 转移至硝酸纤维膜上, 用50 mL/L的小牛血清4℃封闭过夜, 加入1∶200稀释的FUT4 一抗, 4℃过夜, 洗膜3次后, 加入1∶500稀释的辣根过氧化物酶标记的二抗, 室温1 h, 洗膜3次, 每次5 min, 然后加入化学发光试剂作自显影, 具体方法参照《分子克隆实验指南》.
统计学处理 应用SPSS11.0统计软件包处理. 数据采用mean±SD表示, 应用独立样本t检验, P<0.05有显著性差异.
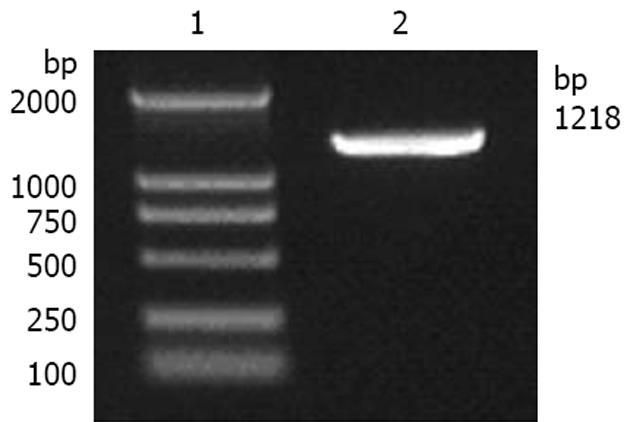
以人子宫内膜提取的RNA为模板, 逆转录合成cDNA, 以FUT4特异性全长引物进行PCR扩增后, 进行电泳, 可见1218 bp特异性很强的扩增条带(图1), 说明扩增出FUT4目的基因, 与预期一致.
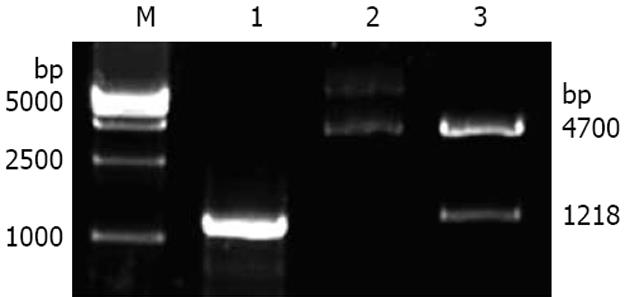
将FUT4基因连接入真核表达载体pEGFP-N1-FUT4, 转化DH5α, 随机挑取菌落提取质粒, 经限制性内切酶鉴定筛选阳性克隆. 用EcoRⅠ和XhoⅠ双酶切阳性重组质粒, 酶切产物电泳, 获得两个条带, 分别为4700 bp和1218 bp, 与预期载体和基因大小一致, 说明FUT4 cDNA已正确插入pEGFP-N1表达载体中(图2). 重组pEGFP-N1-FUT4质粒DNA送大连宝生物公司测序, 序列分析结果FUT4基因编码区序列(CDS) 与GenBank报道序列有100%的同源性.
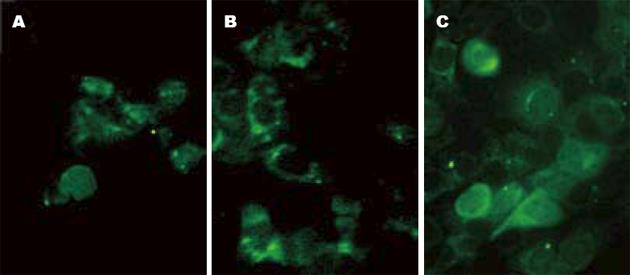
采用脂质体法, 将重组质粒pEGFP-N1-FUT4和空载体质粒pEGFP-N1转染A431细胞, 并在荧光显微镜下观察到绿色荧光的表达. pEGFP-N1空载体稳定转染细胞的绿色荧光蛋白充满整个细胞中, 而pEGFP-N1-FUT44稳定转染细胞的绿色荧光主要分布在胞质中, 细胞核中未见有绿色荧光蛋白表达(图3).
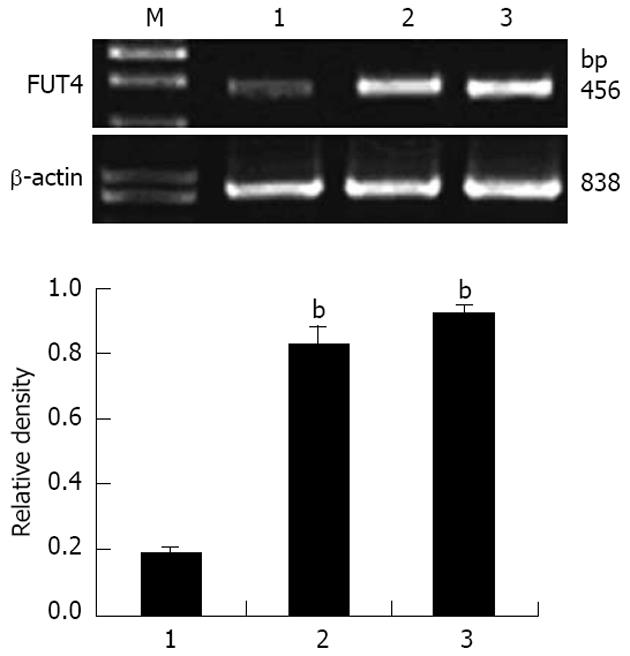
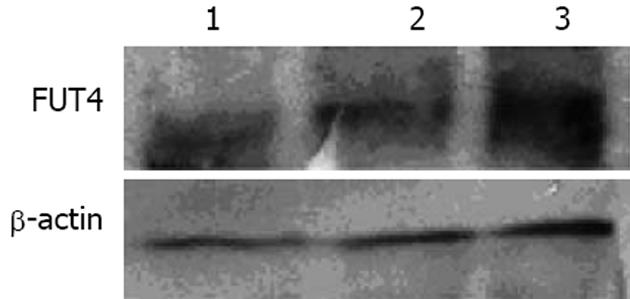
提取细胞中的总RNA, 逆转录并扩增出456 bp的特异性FUT4基因产物和838 bp内参产物. 转染pEGFP-N1-FUT4组的细胞FUT4基因表达与未处理组和转空质粒组相比, 表达量有明显增高. 另外, 转染空质粒组与未转染组FUT4表达量无明显变化, 是低表达(图5). 以内参基因β-actin 为基准分析各条带的相对密度值, 应用Excel和SPSS10.0软件进行作图及统计分析(图4).
用FUT4的抗体对表达的融合蛋白进行免疫印迹杂交, 如图5所示, 可以发现表达的蛋白能与抗体反应, 出现特异性的抗原抗体反应条带, 这表明转染细胞已经有FUT4蛋白的表达. 稳定转染pEGFP-N1-FUT4细胞的FUT4酶蛋白比空载体转染的细胞表达增加.
许多细胞表面糖蛋白或糖脂是含有岩藻糖(Fucose, Fuc)化的糖链[6], 参与胚胎发育、组织器官形成, 并且与肿瘤的生长、浸润有关, 如LeY, LeX, sLeX等Lewis系血型抗原分子. 其中LeY寡糖是一双岩藻糖的寡糖[Fucα1→2Galβ1→4(Fucα1→3)GlcNAcβ1→R], 在人类70%-90%的上皮癌中高表达[7-9], 并与肿瘤细胞的生长、浸润和转移有关, 被认为是肿瘤相关的抗原[10-11]. FUT是编码一组催化糖复合物糖链岩藻糖化的酶蛋白, 催化糖复合物岩藻糖基化一系列反应的最后一步反应可将L-fucose从GDP-fucose转移至相应受体上形成α1, 2, α1, 3/4和α1, 6连接. 到前为止, 得到确认的岩藻糖基转移酶基因有13种, 其中α1, 3岩藻糖基转移酶有六种, 包括FUT3, FUT4, FUT5, FUT6, FUT7, FUT9[12-13]. FUT4(EC.2.4.1.152) 主要在白细胞和上皮细胞中表达[14]. FUT4在肿瘤细胞中表达异常, 如肠癌、克隆癌、胰腺癌中FUT4明显升高[15-19]. LeY寡糖的α1, 3岩藻糖基化是由FUT4催化完成的[20-23]. 因此, FUT4是LeY寡糖合成的关键酶[24-27].
我们克隆了FUT4基因的全序列, 并成功地构建了含人FUT4全长的带绿色荧光和核糖体进入位点的真核表达质粒. 选用绿色荧光蛋白(EGFP)为报告基因其最大优点在于简化了基因表达的检测过程. 以该蛋白作为报告基因, 可以方便、快速地测试构建的载体是否能够顺利表达, 从而可以使转染细胞以后的工作大为方便. 同时在FUT4和EGFP基因之间引入了IRES片断从而避免了表达水平低以及表达的报告基因和目的基因蛋白结构上相互影响的缺陷, 所构建的表达质粒可用于在体和离体的研究应用[28-30]. 我们成功构建了含FUT4全长的绿色荧光蛋白为报告基因的pEGFP-N1-FUT4真核表达载体, 并转染到真核细胞A431细胞内, 为进一步探讨肿瘤糖分子病理机制、FUT4对糖抗原合成的调节及FUT4对肿瘤生长凋亡机制的深入研究提供一定理论基础, 并为临床治疗LeY阳性表达的肿瘤提供新的思路.
许多细胞表面糖蛋白或糖脂是含有岩藻糖(Fuc)化的糖链, 参与胚胎发育、组织器官形成, 并且与肿瘤的生长、浸润有关, 如LeY、LeX、sLeX等Lewis系血型抗原分子. 其中LeY寡糖是一双岩藻糖的寡糖[Fucα1→2Galβ1→4(Fucα1→3)GlcNAcβ1→R], 在人类70%- 90%的上皮癌中高表达, 并与肿瘤细胞的生长、浸润和转移有关, 被认为是肿瘤相关的抗原.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
Marionneau et al报道在小鼠克隆癌细胞中血型抗原A表达能提高细胞抗凋亡作用; Goupille et al报道在小鼠克隆癌细胞中岩藻糖基转移酶表达抑制凋亡.
本研究首次克隆人岩藻糖基转移酶Ⅳ的基因, 并且转染至A431细胞中获得稳定表达的细胞株.
本文为研究人岩藻糖基转移酶Ⅳ的功能和在肿瘤生长、增殖和凋亡以及作用机制提供了一个工具.
本文行文流畅, 所用方法先进, 图片清晰, 可信性强, 分析讨论客观, 符合实际, 是肿瘤基础研究方面的好文章.
编辑: 潘伯荣 电编:郭海丽
| 1. | Sasaki K, Kurata K, Funayama K, Nagata M, Watanabe E, Ohta S, Hanai N, Nishi T. Expression cloning of a novel alpha 1,3-fucosyltransferase that is involved in biosynthesis of the sialyl Lewis x carbohydrate determinants in leukocytes. J Biol Chem. 1994;269:14730-14737. [PubMed] |
| 2. | Natsuka S, Gersten KM, Zenita K, Kannagi R, Lowe JB. Molecular cloning of a cDNA encoding a novel human leukocyte alpha-1,3-fucosyltransferase capable of synthesizing the sialyl Lewis x determinant. J Biol Chem. 1994;269:16789-167894. [PubMed] |
| 3. | Kaneko M, Kudo T, Iwasaki H, Ikehara Y, Nishihara S, Nakagawa S, Sasaki K, Shiina T, Inoko H, Saitou N. Alpha1,3-fucosyltransferase IX (Fuc-TIX) is very highly conserved between human and mouse; molecular cloning, characterization and tissue distribution of human Fuc-TIX. FEBS Lett. 1999;452:237-242. [PubMed] [DOI] |
| 4. | Farhan H, Schuster C, Klinger M, Weisz E, Waxenecker G, Schuster M, Sexl V, Mudde GC, Freissmuth M, Kircheis R. Inhibition of xenograft tumor growth and down-regulation of ErbB receptors by an antibody directed against Lewis Y antigen. J Pharmacol Exp Ther. 2006;319:1459-1466. [PubMed] [DOI] |
| 5. | Baldus SE, Monig SP, Zirbes TK, Thakran J, Kothe D, Koppel M, Hanisch FG, Thiele J, Schneider PM, Holscher AH. Lewis(y) antigen (CD174) and apoptosis in gastric and colorectal carcinomas: correlations with clinical and prognostic parameters. Histol Histopathol. 2006;21:503-510. [PubMed] |
| 6. | Jiang J, Chen X, Shen J, Wei Y, Wu T, Yang Y, Wang H, Zong H, Yang J, Zhang S. Beta1,4-galactosyltransferase V functions as a positive growth regulator in glioma. J Biol Chem. 2006;281:9482-9489. [PubMed] [DOI] |
| 7. | Madjd Z, Parsons T, Watson NF, Spendlove I, Ellis I, Durrant LG. High expression of Lewis y/b antigens is associated with decreased survival in lymph node negative breast carcinomas. Breast Cancer Res. 2005;7:R780-R787. [PubMed] [DOI] |
| 8. | Takehara K, Kubushiro K, Kiguchi K, Ishiwata I, Tsukazaki K, Nozawa S, Iwamori M. Expression of glycolipids bearing Lewis phenotypes in tissues and cultured cells of human gynecological cancers. Jpn J Cancer Res. 2002;93:1129-1137. [PubMed] [DOI] |
| 9. | Liu F, Qi HL, Chen HL. Regulation of differentiation- and proliferation-inducers on Lewis antigens, alpha-fucosyltransferase and metastatic potential in hepatocarcinoma cells. Br J Cancer. 2001;84:1556-1563. [PubMed] [DOI] |
| 10. | Capelle MA, Brugger P, Arvinte T. Spectroscopic characterization of antibodies adsorbed to aluminium adjuvants: correlation with antibody vaccine immunogenicity. Vaccine. 2005;23:1686-1694. [PubMed] [DOI] |
| 11. | Klinger M, Farhan H, Just H, Drobny H, Himmler G, Loibner H, Mudde GC, Freissmuth M, Sexl V. Antibodies directed against Lewis-Y antigen inhibit signaling of Lewis-Y modified ErbB receptors. Cancer Res. 2004;64:1087-1093. [PubMed] [DOI] |
| 12. | Javaud C, Dupuy F, Maftah A, Julien R, Petit JM. The fucosyltransferase gene family: an amazing summary of the underlying mechanisms of gene evolution. Genetica. 2003;118:157-170. [PubMed] [DOI] |
| 13. | Becker DJ, Lowe JB. Fucose: biosynthesis and biological function in mammals. Glycobiology. 2003;13:41R-53R. [PubMed] [DOI] |
| 14. | Allahverdian S, Wojcik KR, Dorscheid DR. Airway epithelial wound repair: role of carbohydrate sialyl Lewisx. Am J Physiol Lung Cell Mol Physiol. 2006;291:L828-L836. [PubMed] [DOI] |
| 15. | Petretti T, Schulze B, Schlag PM, Kemmner W. Altered mRNA expression of glycosyltransferases in human gastric carcinomas. Biochim Biophys Acta. 1999;1428:209-218. [PubMed] [DOI] |
| 16. | Kudo T, Ikehara Y, Togayachi A, Morozumi K, Watanabe M, Nakamura M, Nishihara S, Narimatsu H. Up-regulation of a set of glycosyltransferase genes in human colorectal cancer. Lab Invest. 1998;78:797-811. [PubMed] |
| 17. | Ito H, Hiraiwa N, Sawada-Kasugai M, Akamatsu S, Tachikawa T, Kasai Y, Akiyama S, Ito K, Takagi H, Kannagi R. Altered mRNA expression of specific molecular species of fucosyl- and sialyl-transferases in human colorectal cancer tissues. Int J Cancer. 1997;71:556-564. [PubMed] [DOI] |
| 18. | Martin-Satua M, Marrugat R, Cancelas JA, Blanco J. Enhanced expression of alpha(1,3)-fucosyltransferase genes correlates with E-selectin-mediated adhesion and metastatic potential of human lung adenocarcinoma cells. Cancer Res. 1998;58:1544-1550. [PubMed] |
| 19. | Taniguchi A, Suga R, Matsumoto K. Expression and transcriptional regulation of the human alpha1, 3-fucosyltransferase 4 (FUT4) gene in myeloid and colon adenocarcinoma cell lines. Biochem Biophys Res Commun. 2000;273:370-376. [PubMed] [DOI] |
| 20. | Ajit V, Richard C, Jeffrey E, Hudson F, Gerald H, Jamey M. Essential of glycobiology. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Pub 1999; 125-320. |
| 21. | Aubert M, Panicot L, Crotte C, Gibier P, Lombardo D, Sadoulet MO, Mas E. Restoration of alpha(1,2) fucosyltransferase activity decreases adhesive and metastatic properties of human pancreatic cancer cells. Cancer Res. 2000;60:1449-1456. [PubMed] |
| 22. | Escrevente C, Machado E, Brito C, Reis CA, Stoeck A, Runz S, Marme A, Altevogt P, Costa J. Different expression levels of alpha3/4 fucosyltransferases and Lewis determinants in ovarian carcinoma tissues and cell lines. Int J Oncol. 2006;29:557-566. [PubMed] |
| 23. | Wang H, Ge CH, Kong Y, Xin Y, Zhu ZM. Ovary Hormonal Control of Le(y) Oligosaccharide Expression during Peri-implantation of Mouse Endometrium. Shengwu Huaxue Yu Shengwu Wuli Xue Bao (Shanghai). 2001;33:542-546. [PubMed] |
| 24. | Mollicone R, Gibaud A, Francois A, Ratcliffe M, Oriol R. Acceptor specificity and tissue distribution of three human alpha-3-fucosyltransferases. Eur J Biochem. 1990;191:169-176. [PubMed] [DOI] |
| 25. | Yago K, Zenita K, Ginya H, Sawada M, Ohmori K, Okuma M, Kannagi R, Lowe JB. Expression of alpha-(1,3)-fucosyltransferases which synthesize sialyl Le(x) and sialyl Le(a), the carbohydrate ligands for E- and P-selectins,in human malignant cell lines. Cancer Res. 1993;53:5559-5565. [PubMed] |
| 26. | Taniguchi A, Suga R, Matsumoto K. Expression and transcriptional regulation of the human alpha1, 3-fucosyltransferase 4 (FUT4) gene in myeloid and colon adenocarcinoma cell lines. Biochem Biophys Res Commun. 2000;273:370-376. [PubMed] [DOI] |
| 27. | Cao Y, Merling A, Karsten U, Schwartz-Albiez R. The fucosylated histo-blood group antigens H type 2 (blood group O, CD173) and Lewis Y (CD174) are expressed on CD34+ hematopoietic progenitors but absent on mature lymphocytes. Glycobiology. 2001;11:677-683. [PubMed] [DOI] |
| 28. | Greaves J, Duncan RR, Tapechum S, Apps DK, Shipston MJ, Chow RH. Use of ANF-EGFP for the visualization of secretory vesicles in bovine adrenal chromaffin cells. Ann N Y Acad Sci. 2002;971:275-276. [PubMed] [DOI] |
| 29. | Duncan RR, Greaves J, Tapechum S, Apps DK, Shipston MJ, Chow RH. Efficacy of Semliki Forest virus transduction of bovine adrenal chromaffin cells: an analysis of heterologous protein targeting and distribution. Ann N Y Acad Sci. 2002;971:641-646. [PubMed] [DOI] |
| 30. | Fratantoni JC, Dzekunov S, Singh V, Liu LN. A non-viral gene delivery system designed for clinical use. Cytotherapy. 2003;5:208-210. [PubMed] [DOI] |