修回日期: 2008-02-29
接受日期: 2008-03-28
在线出版日期: 2008-04-08
目的: 研究CCl4诱导的肝纤维化大鼠肝组织Smad基因表达的变化及其意义.
方法: 80只健康雄性SD大鼠分为2组: 正常组(C组, n = 40)和模型组(M组, n = 40). 以CCl4 sc法诱导肝纤维化, HE和VG胶原染色观察肝脏胶原沉积情况, 原位杂交法及免疫组化法检测肝组织Smads分子表达水平变化.
结果: 与C组比较, M组大鼠肝脏组织学积分显著增加(3.29±0.68 vs 0, P<0.05), 平均胶原面积显著增加(290.86±89.37 μm2vs 56.12 ± 21.45 μm2, P<0.01), 肝组织Smad4蛋白表达率较C组明显增加(4.27%±0.43% vs 2.86%±0.86%, P<0.05), 而Smad7蛋白表达虽然增加, 但水平低下; Smad3 mRNA表达A值明显增加(0.167±0.092 vs 0.010±0.002, P<0.05), Smad4 mRNA表达A值也明显增加(0.241±0.098 vs 0.021±0.004, P<0.05), Smad6、Smad7 mRNA虽然增加, 但表达水平仍然低下.
结论: 实验性大鼠肝纤维化存在肝脏Smads分子表达水平的比例失调, TGF-Smad信号通路可能参与了肝纤维化的形成与发展.
引文著录: 吴晓玲, 曾维政, 蒋明德, 秦建平, 徐辉. 肝纤维化大鼠肝组织Smads基因表达状况及意义. 世界华人消化杂志 2008; 16(10): 1037-1041
Revised: February 29, 2008
Accepted: March 28, 2008
Published online: April 8, 2008
AIM: To investigate the expression of Smads gene and its significance in rats with liver fibrosis induced by carbon tetrachloride (CCl4).
METHODS: Eighty healthy male SD rats were randomly divided into two groups: normal control group (n = 40) and hepatic fibrosis model group (n = 40). Experimental liver fibrosis was induced by subcutaneous injection of CCl4. The deposition of collagen fiber in liver was detected with Masson and VG staining. The expression of Smad3, Smad4, Smad6, and Smad7 were assayed with in situ hybridization (ISH) and immunohistochemistry (IHC).
RESULTS: A significant increase of collagen deposition and rearrangement of the parenchyma were noted in fibrosis model rats. The semi-quantitative histological scores (3.29 ± 0.68 vs 0, P < 0.01) and average area of collagen deposition (290.86 ± 89.37 μm2vs 56.12 ± 21.45 μm2, P < 0.05) in model group were significantly increased. The positive rate of Smad4 protein expression was higher in model group than that in control group (4.27% ± 0.43% vs 2.86% ± 0.86%, P < 0.05), but the positive rate of Smad7 protein expression was not markedly different between the two groups. The A values of Smad3 mRNA (0.167 ± 0.092 vs 0.010 ± 0.002, P < 0.05) and Smad4 mRNA (0.241 ± 0.098 vs 0.021 ± 0.004, P < 0.05) were significantly higher in model group that those in control group. Meanwhile, although the expression levels of Smad6 and Smad7 mRNA were increased in model animals, there were no significant differences between the two groups. The protein expression of Smad4 and the mRNA expression of Smad6 and Smad7 were at very low levels both in normal and in model animals.
CONCLUSION: Unbalanced expression of Smads exists in experimental hepatic fibrosis of rats. TGF-β-Smad signal pathway may take part in the occurrence and progression of liver fibrosis in rats.
- Citation: Wu XL, Zeng WZ, Jiang MD, Qin JP, Xu H. Expression of Smads gene in CCl4-induced liver fibrosis and its significance in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(10): 1037-1041
- URL: https://www.wjgnet.com/1009-3079/full/v16/i10/1037.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i10.1037
肝纤维化是多种慢性肝脏疾病发展为肝硬化的中间环节, 积极地控制肝纤维化的进展具有极为重要的临床意义. 本研究旨在观察CCl4诱导的肝纤维化大鼠肝组织Smads基因表达水平的变化, 了解其与肝纤维化主要的病理变化肝脏胶原沉积的关系, 进一步从分子水平探讨实验性大鼠肝纤维化发生发展的可能分子机制, 为肝纤维化的临床防治提供新思路.
体质量150±10 g健康♂SD大鼠(购自华西医科大学实验动物中心), 化学纯CCl4(成都联合化工试剂研究所), Smads抗体及免疫组化试剂盒(武汉博士德生物工程公司), Dig-CBP探针及原位杂交试剂盒(上海申能生物工程公司).
1.2.1 动物分组与造模: 80只大鼠随机分为2组: 正常对照组(C组)40只, 肝纤维化模型组(M组)40只, 各组间暴露因素无差别. 用CCl4 sc法诱导大鼠肝纤维化模型, 即用300 mL/L CCl4石蜡油溶液, 以3 mL/kg做sc, 2次/wk, 共8 wk. 正常对照组予等量石蜡油sc处理. 各组动物在最后一次CCl4注射后48 h处死, 取肝组织标本待检.
1.2.2 检测方法: 肝组织标本以40 g/L中性甲醛溶液固定、石蜡包埋, 以多聚赖氨酸涂布的载玻片制作5 μm厚度的肝组织切片, 进行HE染色和Masson三重胶原染色作组织病理学检查; 免疫组织化学(immunohistochemistry, IH)方法检测Smad4、Smad7蛋白表达水平, 原位杂交法(in situ hybridization, ISH)检测Smad3、Smad4、Smad6、Smad7 mRNA、CBP mRNA表达水平, 检测步骤参考试剂说明书进行. Smad3 mRNA探针序列(5'→3'): Biotin-GAA GGC CGG CTC ACA GTA GGT GAC TGG CTG(981-1010 bp, GC% = 63.33), 以生物素标记探针, 碱性磷酸酶搭桥, BCIP和NBT显色反应; CBP mRNA探针序列(5'→3'): Dig-TGA CAG TTG TTT ATG TTT GGA CGC(371-394 bp, GC% = 41.67, Tm: 61.9), 以地高辛标记探针, 辣根过氧化物酶搭桥, DAB显色反应, 显微镜下观察结果.
统计学处理 肝脏胶原纤维染色、Smads表达水平的ISH检测结果均使用日本Nikon TE2000-H倒置显微镜采集图像, 美国Image-Pro Plus专业图像软件分析系统专进行数据采集和半定量统计分析.
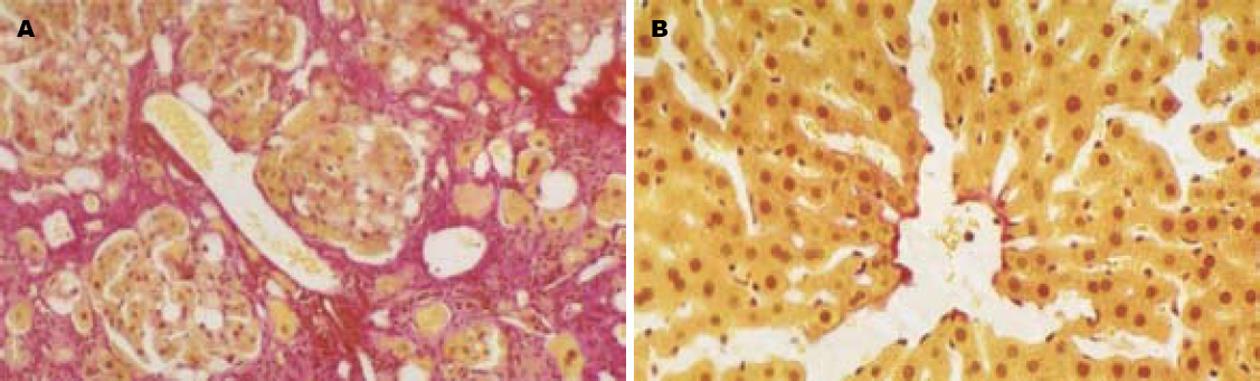
HE染色光镜下可见正常肝组织肝小叶结构清晰, 肝细胞围绕中央静脉呈放射状排列, 肝纤维化模型组大鼠肝细胞广泛脂肪变性、坏死, 炎性细胞浸润以汇管区及中央静脉周围为重, 肝小叶结构破坏, 胶原纤维明显增生; Masson染色见蓝色胶原纤维明显增多, 汇管区-中央静脉区纤维间隔宽大, 包绕分隔肝小叶, 部分标本形成假小叶(图1), 肝纤维化半定量组织学积分为3.29±0.68. C组与M组组织学积分0, 3.29±0.68; 胶原面积56.12±21.45 μm2, 290.86±89.37 μm2.
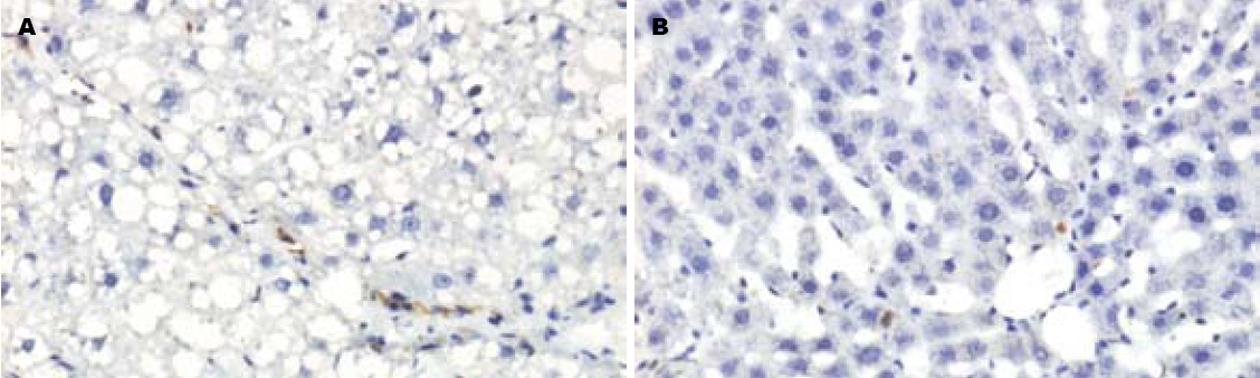
免疫组化检测表明, 正常对照组大鼠肝脏未检测出Smad7阳性表达, 肝组织Smad4蛋白表达水平低下阳性表达率2.86%±0.86%; CCl4 sc模型大鼠肝脏肝组织Smad4蛋白表达率明显增加至4.27%±0.43%, (P<0.05). 模型大鼠肝组织Smad7蛋白表达水平低下, 仅在汇管区见少数间质细胞显色, 棕黄色的阳性颗粒主要位于细胞质(图2), 计算机图像分析其阳性率为1.34%±0.13%, 两者无显著差异(P>0.05).
原位杂交检测表明, Smad3 mRNA在正常对照组大鼠肝脏仅有少数间质细胞显示阳性表达, 为胞质细小的蓝紫色颗粒, 且表达强度微弱, A值为0.010±0.002; CCl4 sc可使大鼠肝脏Smad3 mRNA表达明显增加, 间质细胞和肝细胞均有表达, 计算机图像分析其表达A值为0.167±0.092, 两者差异非常显著(P<0.01).
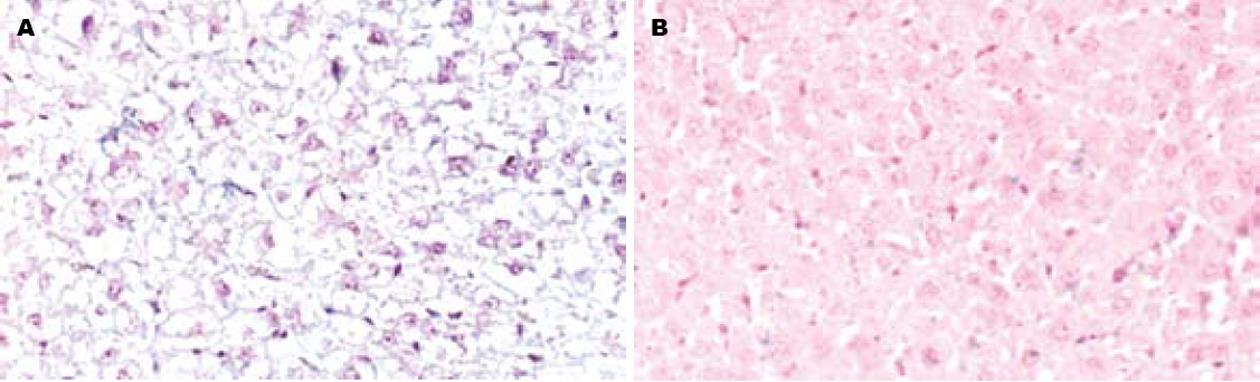
Smad4 mRNA在正常对照组大鼠肝组织基本为阴性表达; 肝纤维化模型组大鼠肝脏Smad4 mRNA表达强度明显增加, 胞质蓝紫色的阳性颗粒出现于间质细胞和肝实质细胞, 且颗粒较大着色较深(图3), 计算机半定量分析其平均A值为0.241±0.098, 与正常大鼠相比有明显的增加(P<0.05), 与Smad4蛋白的表达水平变化趋势一致, 反映其基因转录与翻译都有一定程度的增加, 可能与肝纤维化的发生发展有关.
正常大鼠肝脏以原位杂交法未检测出明显的Smad6 mRNA阳性表达; 肝纤维化模型大鼠肝脏Smad6 mRNA表达较正常大鼠有所增加, 但其表达水平低下, 仅见少数间质细胞和肝实质细胞阳性显色, 呈细胞质蓝紫色的颗粒, 沿着细胞膜排列成为环状颗粒(由于胞质脂肪变性的脂肪滴溶解形成空泡, 将细胞质成分挤压至细胞膜内表面), 计算机扫描分析其平均A值为0.039±0.014, 与正常组大鼠比较无显著差异(P>0.05).
正常组大鼠肝组织Smad7 mRNA表达显示为阴性结果, 肝纤维化大鼠肝脏检出少量阳性表达细胞, 肝细胞和间质细胞均有阳性表达, 蓝紫色的颗粒主要位于细胞质, 沿着细胞膜排列成为环状, 计算其平均A值为0.074±0.012, 但与正常组比较无显著差异(P>0.05), 两者表达水平相近.
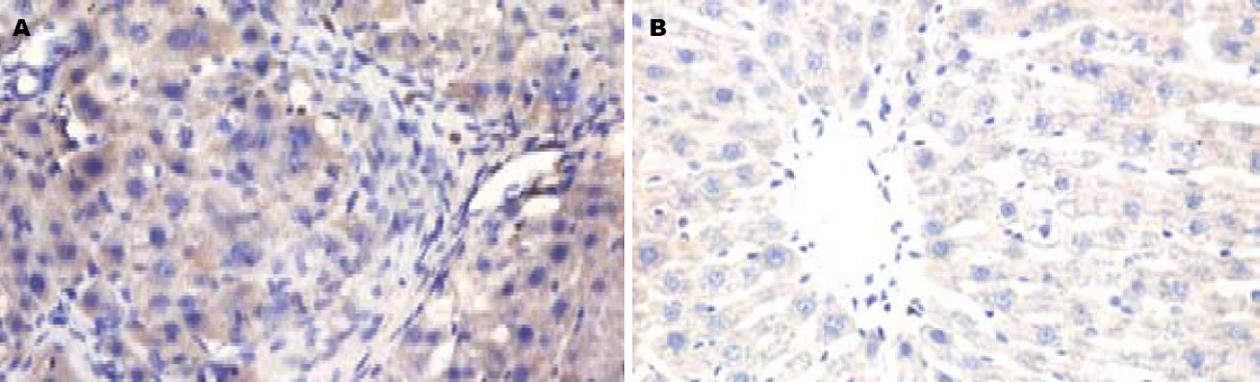
原位杂交检测表明, 正常对照组大鼠肝脏CBP mRNA表达水平低下, 显色信号微弱; CCl4 sc使大鼠肝脏CBP mRNA表达明显增加, 棕黄色的阳性颗粒主要位于肝实质细胞胞质, 间质细胞表达较少, 且着色深、表达强度高, 计算机图像分析其平均吸光度值分别为0.092±0.032, 0.235±0.025, 两者有显著差异(图4, P<0.01).
转化生长因子β(transforming growth factor-β, TGFβ)-Smad信号传导通路调控损伤修复, 肿瘤生长与转移等生物行为的重要信号通路, 近年研究发现TGF β-Smad信号通路也是肝纤维化主要的信息传导途径[1-7]. Smad蛋白家族是TGFβ受体后信息分子, 参与调控细胞的增殖、转化、合成、分泌和凋亡. 这一超家族成员根据功能不同分为三类: 受体激活Smad(R-Smad), 共用Smad(Co-Smad), 和抑制性Smad(I-Smad). 来自TGFβ的信号与细胞膜表面的Ⅰ型、Ⅱ型受体结合后使R-Smad(Smad2、3)磷酸化而活化, Smad2、3再和胞质中的Smad4(Co-Smad)结合形成异多聚体转位进入细胞核, 进而通过与一系列的转录辅激活蛋白或转录辅阻遏分子结合调节靶基因的表达[8-14]; Smad6、7(I-Smad)则分别通过抑制Smads多聚体的形成和抑制R-Smads磷酸化而阻止该信号转导过程[15-18], 其表达下调可能与慢性肝病的持续化及进展为肝纤维化有关[11-12]. CREB(cAMP response element(CRE)-binding protein, cAMP反应元件结合蛋白)是一重要的核转录因子, 为bZIP家族成员之一. CREB受多种信号转导通路的调控, 除了经典的cAMP调控通路外, 还有Ras-Raf-MAPK通路、Ca2+-CaMK通路、应激相关的P38通路等. 活化的CREB需同转录辅激活因子CBP(CREB binding protein)相结合, 才能激活转录发生. 研究表明, CBP是将TGFβ信号转化为生物学效应的关键分子, 通过激活AP-1等转录因子促进靶基因表达, 引起胶原蛋白合成、肝细胞再生、肝小叶重建等生物效应. 对TGFβ-Smad信号传导通路及其中关键的分子表达状况的深入研究不仅有助于进一步阐明肝纤维化的发病机制, 也为肝纤维化的防治提供了一个新的途径[19-21].
本实验研究表明, CCl4 sc法能够成功诱导实验大鼠的肝纤维化病变, 模型组大鼠肝脏胶原蛋白沉积显著增加, 肝纤维化组织学积分与对照组比较有显著差异, 纤维化病变明显, 且造模方法简便、时间短, 可作为肝纤维化防治研究的首选模型.
美国学者Flanders[22]认为, TGFβ的大多数促纤维化效应是由Smad3介导的; 转基因鼠肝脏内源性Smad4表达降低, 则大鼠肝脏Ⅰ型胶原减少, 表明抑制Smad3、Smad4的表达有潜在的抗纤维化价值. 本实验表明, 肝纤维化大鼠肝组织Smad4 mRNA及其蛋白表达水平均明显增加, 蛋白表达率为高于对照组, Smad4和Smad3 mRNA表A值同对照组相比, 均明显增加, 证实在大鼠实验性肝纤维化形成过程中伴有Smad3、Smad4表达水平的明显增加.
CBP是TGFβ-Smad信号通路中处于下游位置的基因, 接受TGFβ的刺激而进一步将信号向细胞内靶基因传递. 实验结果表明, 伴随着Smad3、Smad4表达水平的明显增加, CBP的表达亦呈明显增加, 其A值也相应增加, 显示来自TGFβ的刺激有效地经过一系列信号分子传递至下游通路, 并可能进而引起下游靶基因的表达增加[23-24].
相反, Smad6、Smad7分子作为TGF β-Smad信号通路中具有自身调节作用的抑制性信号分子, 其在大鼠肝纤维化中的表达趋势呈现不同的变化. 在对照组, 这两种抑制性分子的mRNA表达水平极低, 几乎检测不出, 半定量分析其表达水平接近0, 在模型组大鼠肝脏, 可以检测出Smad6、Smad7 mRNA分子的表达, 但也处于较低的水平, 表明在肝纤维化形成过程中同样有抑制性信号分子表达的增加, 这可能是由于来自TGFβ的刺激性信号, 引起Smad3、Smad4表达的增加, 进而诱导抑制性分子表达的增加以发挥负反馈调节作用. 但同Smad3、Smad4增加的程度相比, 抑制性分子的增加显然处于较弱的地位, 因此, 其增加亦不能有效抑制上游的刺激性信号继续向细胞内传递, 终于导致胶原基因表达增加、胶原蛋白过度沉积的肝纤维化病变.
本实验结果显示, 在大鼠实验性肝纤维化模型大鼠的肝组织呈现明显的胶原纤维沉积, 同时有Smads基因表达水平的明显变化, 表现为刺激性分子Smad3与共用性分子Smad4表达水平的显著增加, 下游CBP分子表达的同步增加, 以及抑制性信号分子Smad6、Smad7表达的微弱增加, 其相对比例明显失调, 表明TGFβ-Smad信号通路可能参与了大鼠实验性肝纤维化的形成与发展, 其关键信号分子的表达失调是慢性肝损伤进展为肝纤维化的重要机制, 因此, 调整Smads分子的表达水平有望成为临床防治肝纤维化的一个有效途径[25-30].
随着分子生物学的发展, 许多研究进一步阐明了肝纤维化发病的分子机理, 维护机体正常功能的细胞信号通路失调是肝纤维化发病的重要原因, 可表现为关键信号分子表达水平的不平衡, 最终导致纤维组织大量产生、沉积于肝脏.
丁惠国, 主任医师, 首都医科大学附属北京佑安医院肝病消化科
TGFβ/Smad信号通路是参与肝纤维化的重要信号通路, 肝组织Smads表达的失调是导致过多纤维合成、沉积的重要原因, 合理调节Smad分子表达水平有望成为干预肝纤维化的有效途径.
国外有报道肝星状细胞活化、增殖时伴有Smad表达的失调, 不同Smad分子在肝脏的急性和慢性损害中所发挥的作用不尽相同.
研究肝组织原位TGFβ/Smad信号通路中关键分子表达的失调状况, 可为肝纤维化防治提供新的思路.
Smad: 是一大类将细胞损伤信息传递至细胞核, 最终影响靶基因表达, 完成创伤修复的关键信息分子, 按照其功能不同可分为抑制性Smad、受体结合活化的Smad和共用Smad3大类, 正常情况下三类分子表达被精密调节, 共同配合完成信号的传递过程.
本文选题设计及实验方法正确, 实验结果可靠, 论文书写规范, 尽管国内有类似的文献报告, 但该文对认识肝纤维化的机制有一定新观点.
编辑: 程剑侠 电编:郭海丽
| 5. | Breitkopf K, Godoy P, Ciuclan L, Singer MV, Dooley S. TGF-beta/Smad signaling in the injured liver. Z Gastroenterol. 2006;44:57-66. [PubMed] [DOI] |
| 8. | 孙 校男, 王 先开, 娄 国强. Smad蛋白与肝纤维化. 国外医学·流行病学传染病学分册. 2005;4:243-245. |
| 9. | 何 燕, 肖 诚, 胡 志峰, 沙 洪, 熊 佳鹏, 李 平. Smad蛋白及其对中医药防治肝纤维化作用的研究进展. 中国中医基础医学杂志. 2007;13:399-402. |
| 11. | 严 蓉, 陈 峰. Smad蛋白-肝纤维化时TGFβ1信号转导的关键物质. 国际流行病学传染病学杂志. 2007;34:191-195. |
| 14. | Seyhan H, Hamzavi J, Wiercinska E, Gressner AM, Mertens PR, Kopp J, Horch RE, Breitkopf K, Dooley S. Liver fibrogenesis due to cholestasis is associated with increased Smad7 expression and Smad3 signaling. J Cell Mol Med. 2006;10:922-932. [PubMed] [DOI] |
| 15. | Yoshida K, Matsuzaki K, Mori S, Tahashi Y, Yamagata H, Furukawa F, Seki T, Nishizawa M, Fujisawa J, Okazaki K. Transforming growth factor-beta and platelet-derived growth factor signal via c-Jun N-terminal kinase-dependent Smad2/3 phosphorylation in rat hepatic stellate cells after acute liver injury. Am J Pathol. 2005;166:1029-1039. [PubMed] [DOI] |
| 17. | Kitamura Y, Ninomiya H. Smad expression of hepatic stellate cells in liver cirrhosis in vivo and hepatic stellate cell line in vitro. Pathol Int. 2003;53:18-26. [PubMed] [DOI] |
| 22. | Flanders KC. Smad3 as a mediator of the fibrotic response. Int J Exp Pathol. 2004;85:47-64. [PubMed] [DOI] |
| 23. | 畅 晓燕, 方 家椿. 核蛋白CREB的转录调控机制. 国外医学·分子生物学分册. 2002;24:136-139. |