修回日期: 2007-12-12
接受日期: 2007-12-25
在线出版日期: 2008-01-08
目的: 探讨肝细胞癌变过程中基因表达谱的动态变化, 观察热休克蛋白(HSP)gp96表达及其在肝癌早期诊断及判断预后方面的临床价值.
方法: 以2-乙酰氨基芴(2-FAA, 0.05%)喂饲SD大鼠诱发肝癌发生, 观察肝病理组织学(HE染色)改变, 用全基因组芯片分析肝基因表达谱的动态变化, 以巢式逆转录酶链反应扩增gp96基因片段.
结果: SD大鼠在喂饲2-FAA后, 肝细胞在诱癌早期发生颗粒样变性, 中期出现不典型增生, 后期见大量癌巢结节. 肝癌发生过程中大鼠肝基因表达谱明显改变, 与对照大鼠比较, 癌变大鼠gp96上调3倍; 诱癌变过程中, 肝组织gp96 mRNA表达明显增加, 变性组, 癌前组和癌变组的肝组织中gp96基因表达均明显高于正常对照组(90.9%, 100%, 100% vs 16.67%, P<0.05).
结论: 肝细胞癌变过程中基因表达谱明显改变, 其中gp96 mRNA呈过度表达, 其分析有利于肝癌的诊断和预后判断.
引文著录: 吴信华, 姚登福, 苏小琴, 黄华, 邱历伟, 吴玮. 肝癌基因谱动态表达及HSPgp96异常的临床价值. 世界华人消化杂志 2008; 16(1): 76-80
Revised: December 12, 2007
Accepted: December 25, 2007
Published online: January 8, 2008
AIM: To investigate the dynamic expression of the entire hepatic genome during hepatocellular carcinoma (HCC) development, and the clinical values of heat-shock protein gp96 for early diagnosis of HCC and estimating its prognosis.
METHODS: A rat hepatoma model was induced with 0.05% 2-acetamidoflurene (2-FAA) in male Sprague-Dawley rats. Morphological changes were observed by pathological examination (HE staining). Total RNA was extracted from fresh liver tissues and analyzed by oligonucleotide array during liver carcinogenesis. Total RNA was transferred into cDNA by reverse transcription, and the gene fragment of gp96 was amplified by nested RT-PCR.
RESULTS: Histological examination showed that hepatocytes in rats fed with 2-FAA exhibited vacuole-like denaturation at an early stage, then dysplastic nodules appeared at the middle stage, and finally progressed to cancerous nest tubercles, all of which were highly differentiated during HCC development. gp96 increased three-fold in the liver of rats with HCC, compared with that of normal rats. gp96 mRNA in the liver of rats with denatured, precancerous and cancerous tissues increased compared with that in normal tissues(90.9%, 100%, 100% vs 16.67%, P < 0.05).
CONCLUSION: Alterations in the entire genome pattern and gp96 overexpression are observed during HCC development. gp96 may be a useful molecular marker for early diagnosis of HCC and prognosis estimation.
- Citation: Wu XH, Yao DF, Su XQ, Huang H, Qiu LW, Wu W. Dynamic expression of entire hepatic genomes and heat-shock protein gp96 abnormality during development of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(1): 76-80
- URL: https://www.wjgnet.com/1009-3079/full/v16/i1/76.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i1.76
肝细胞癌(hepatocellular carcinoma, HCC)是由病毒、化学致癌物等多病因作用以及经启动、促进、演变等多阶段的发病过程, 因癌基因或癌相关基因激活、抗癌基因失活或胚胎期某些基因重新复活等诸多因素引起肝细胞生长失控, 出现持续增殖而致癌变, 与基因调控和表达密切相关[1]. 目前在肝癌的早期诊断方面缺乏金标准, 寻找确实有效的肿瘤标志物以尽早发现肝癌并监测其转归一直是肿瘤学研究领域的重要课题. HSP通过多种途径参与细胞生长繁殖, 可与许多癌基因、抑癌基因的产物相互作用, 参与肿瘤细胞周期调控和凋亡, 在肿瘤的发生发展中发挥重要作用[2]. 依据分子量的不同可分为HSP70和HSP90等, gp96属于HSP90家族[3]. gp96在不典型性增生和HCC中的检出率高于HSP70[4], 但gp96在肝癌发生过程中的动态改变及其机制尚不清楚. 我们以2-FAA诱发大鼠肝癌发生制作动物模型, 以寡核苷酸全基因组芯片技术进行高通量分析肝癌发生发展中的基因动态表达, 重点观察gp96在肝细胞癌变发生过程中的表达特点与改变.
♂Sprague-Dawley(SD)大鼠48只,由南通大学实验动物中心提供, 体质量120-160 g, 随机分为8组, 每组6只. 任选一组为对照组, 其余为实验组(其中一组为备用鼠, 用以替换实验期间死亡鼠). 对照鼠给予一般颗粒饲料; 其余各实验鼠以2-FAA制作的颗粒饲料作恒环境饲养, 按文献[4]方法制备肝癌模型, 每2周处死一组实验鼠和一只对照鼠, 留取部分肝组织作病理学检查(HE染色)及组织匀浆的制备.
1.2.1 标本与分组: 分别留取实验鼠及对照鼠新鲜肝组织约200 mg混合为癌前病变组、鼠肝细胞癌变组及正常鼠肝组、胎鼠肝组织, 浸泡于RNAlater中, 4℃过夜后再去除最上层液体, -20℃保存.
1.2.2 DNA合成: 以TRIzol法制备肝组织总RNA, 在岛津UV-2201型紫外分光光度计上测定A260和A280值, 检测RNA纯度并换算总RNA浓度(μg/mg组织). 纯化后合成双链cDNA(Affymetrix one-cycle cDNA Synthesis Kit)并纯化, IVT(in vitro transcription)合成cRNA(GeneChip IVT Labeling Kit), 纯化后定量、检测.
1.2.3 杂交与检测: cRNA片段化, 标记后的产物cRNA与表达谱芯片(900505-PART大鼠全基因组芯片, affymetrix公司)进行杂交. 杂交完毕, 将载体上未结合的多余cRNA片段洗去. 最后对载体进行激光共聚焦扫描, 微阵列上各点的荧光强度经过光电倍增管放大和扫描软件的处理后得到各点的信号值. 用GCOS软件进行数据分析处理.
1.2.4 引物设计及基因扩增: 按gp96基因序列(NM001012197), 于第1634-2037号核苷酸之间设计引物, 由上海生工生物技术服务有限公司合成. 外部引物为gp96-P1: 5'-ACACGGCTT GCTAAACTTCT-3'(nt1634 -1653); gp96-P2: 5'-ACTA CAGTCTGCGGT CCAAA-3'(nt2018-2037), 产物大小为404 bp. 内部引物: gp96-P3: 5'-GAATCTTCTCCGTTTGTTGA-3'(nt1772-1791); gp96-P4: 5'-TGCTTCCCGACTTT CTTTAC-3'(nt1935-1954), 扩增产物183 bp. 内参引物, GAPDH-P1: 5'-GGCTGCCAT TTGCACTGGCAA-3'和5'-TGCCDTGAGTGG AGTCATACTG-3', 扩增产物为104 bp. 第1阶段PCR以外部引物和cDNA为模板, 扩增程序为: 94℃预变性5 min; 94℃, 30 s; 50℃, 30 s; 72℃, 1 min, 循环38次; 72℃总延伸10 min, 4℃保存. 扩增产物经20 g/L琼脂糖电泳和溴化乙锭染色, 在302 nm紫外光照射下判别扩增结果.
统计学处理 以Stata7.0统计软件进行分析和处理数据, 以P<0.05表示差异有显著性.
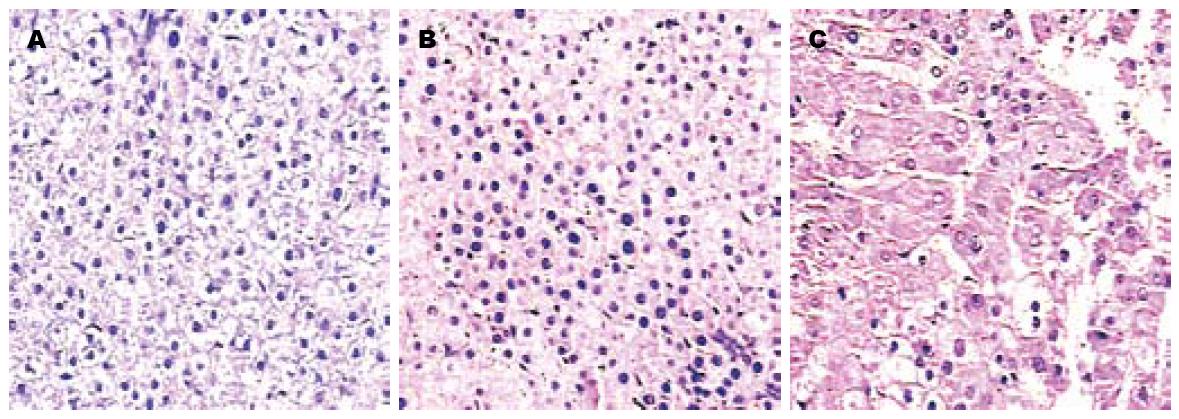
在2-FAA诱癌过程中, 大鼠肝细胞在形态学上发生明显变化. 病理组织学检查发现: 在诱癌早期, 肝外表呈灰黄色, 表面增粗, 肝细胞胞质出现颗粒样变性, 偶见大的异型胞核; 中期阶段, 少数区域有结节形成趋势, 肝板细胞层次增多, 局灶细胞层次超过3层, 细胞核染色质增粗, 核浆比例增大; 在诱癌后期, 可见肝组织结构消失, 肝细胞排列成巢状、粗条索状, 细胞核中等大, 核染色质增粗, 核浆比例增大(图1).
肝组织中制备的总RNA经12 g/L琼脂糖凝胶电泳, 结果提示从肝癌模型鼠中制备的总RNA质量高, 无降解现象. 肝癌形成过程中大鼠基因表达谱的改变情况见表1, 在所分析的大鼠28 000个基因中, 与正常对照相比, 癌前组1179个基因上调 (SR值: Signal Ratio)大于2倍, 268个大于8倍, 癌变组1371个上调大于2倍, 312个大于8倍. 癌变组与正常组比较: 明显改变的基因主要涉及细胞周期相关基因、与信号转导相关基因、肿瘤转移相关基因、凋亡抑制基因、抑癌基因及黏附分子等, 其中包括上调基因gp96, 与正常大鼠比较, 癌变大鼠gp96上调3倍(表1, 表2).
| 分组 | 基因上调(SR值) | 基因下调(SR值) | ||
| ≥8 | ≥2 | ≥8 | ≥2 | |
| 胎肝与癌前组 | 292 | 1149 | 318 | 1546 |
| 胎肝与癌变组 | 559 | 1821 | 425 | 2072 |
| 胎肝与正常组 | 483 | 1439 | 234 | 1464 |
| 癌前与癌变组 | 132 | 1269 | 116 | 629 |
| 癌前组与正常 | 268 | 1179 | 57 | 767 |
| 癌变组与正常 | 312 | 1371 | 201 | 1355 |
| Accession numbers | protein | SLR( = log2cy5/cy3) |
| BI274917 | Laminin, alpha5 | 5.9 |
| NM031511 | insulin-like growth factor 2 | 3.8 |
| NM012912 | activating transcription factor 3, ATF3 | 3.6 |
| BG376410 | tumor-associated calcium signal transducer 1 | 3.6 |
| BI289940 | hepatoma-derived growth factor related protein3, HDGFRP3 | 3.2 |
| BG057543 | tumor rejection gp96 | 3 |
| AA963751 | tumor necrosis factor receptor superfamily, member17 | 2.7 |
| BM384099 | N-myc downstream regulated gene1 | 2.2 |
| BG375362 | latent transforming growth factor beta binding protein4 | 2 |
| NM012967 | intercellular adhesion molecule1 | 2 |
| NM013043 | transforming growth factor beta1 induced transcript 4 | 1.7 |
| BE099050 | nuclear factor L/B | 1.5 |
| NM012493 | alpha-fetoprotein | 1.4 |
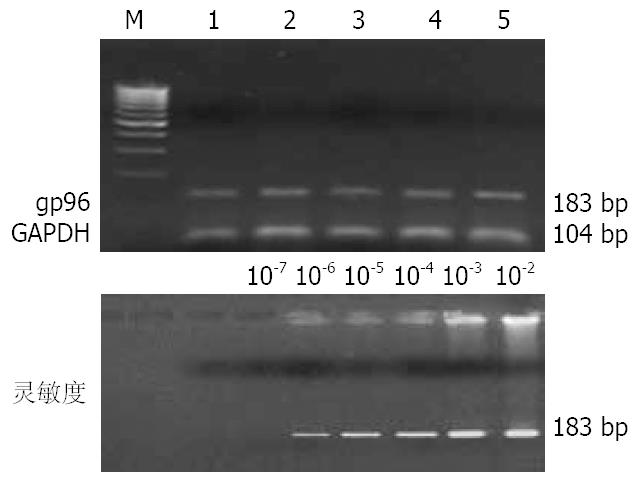
以自行设计的巢式RT-PCR方法, 对大鼠肝癌组织中的gp96基因片段进行扩增. 扩增结果与原设计的基因片段大小一致, PCR终产物为183 bp. 在变性大鼠、癌前及癌变大鼠可检出图谱清晰的gp96基因扩增区带. 取癌变组肝组织总RNA(2 mg/L)分别作102-107倍稀释, 经巢式RT-PCR扩增后, 在总RNA为2 ng/L以上时均可见阳性区带(图2).
在2-FAA的诱癌过程中, 大鼠肝细胞在形态学上发生明显变化, 在正常对照、变性组、癌前组和癌变组的肝组织中, gp96基因片段的扩增结果明显不同, 其检出率: 变性组为90.9%(20/22), 癌前组和癌变组均为100%, 而正常对照大鼠仅为16.67%(1/6). 在肝细胞发生变性的肝组织中gp96基因表达已明显高于正常对照组(P<0.05).
HSP是机体细胞在一些应激原诱导下激活HSP基因, 高效表达的具有高度保守性质的一组蛋白质, 与多种蛋白形成复合体, 陪伴蛋白分子在细胞内转运、跨膜, 参与蛋白的折叠与伸展、多聚复合体的组装, 发挥其调节靶蛋白的作用, 但又不改变靶蛋白的结构, 故HSPs被称为"分子伴侣"(molecular chaperone)[5].
肿瘤的发生发展是一个多因素多步骤的过程, 除与细胞增殖失控和细胞分化异常外, 另一重要原因是发生转化的细胞不能正常凋亡. 有文献报道HSP通过影响增殖必需的蛋白的构象而参与细胞周期调节, 这些蛋白包括C-fos、C-myc、src、p53和Rb等[6]. 此外, HSP还通过抑制凋亡激活基因p53、Bax的表达以及抑制氧自由基的生成而抑制凋亡促进增殖, 参与肿瘤的发生发展过程. 研究发现HSP在某些肿瘤组织中的表达与在正常组织中的表达不同, 并且在某些肿瘤中会出现针对某些HSP的自身抗体. 通过肿瘤组织中HSP或其特异性抗体的测定可对肿瘤进行诊断和风险预报[7].
基因芯片是指将许多特定的寡核苷酸片段或基因片段有序地高密度地排列固定于支持物上, 待测的样品核酸分子经过标记, 与固定在载体上的DNA阵列中的点按碱基配对原则同时进行杂交. 通过激光共聚焦荧光检测系统等对芯片进行扫描, 检测杂交信号强度而获取样品分子的数量和序列信息, 用计算机软件进行数据的比较和分析, 从而对基因序列及功能进行大规模、高通量的研究. Chuma et al[8]对7例早期病例、7例进展期病例及其对应的非肿瘤组织通过基因芯片作比较, 在分析的近12 600基因中, 有95个基因在早期HCC和癌前病变中不同, 有92个基因在早期HCC和进展期HCC中改变. 我们对肝细胞癌变过程中大鼠全基因表达谱尤其gp96基因用芯片技术进行比较分析, 发现在研究的28 000个基因中, 癌前组1179个基因上调大于2倍, 268个大于8倍, 癌变组共有3208个基因上调, 其中1371个上调大于2倍, 312个大于8倍, 涉及细胞周期相关基因、与信号转导相关基因、肿瘤转移相关基因、凋亡抑制基因、抑癌基因及黏附分子等, 其中包括上调基因gp96. 与正常大鼠比较, 癌变大鼠gp96上调3倍. Tanaka et al[9]通过Northern blot分析表明, 与邻近正常肝组织或非HCC患者肝组织相比, HCC中gp96 mRNA上调. 我们通过自行设计的2对引物, 采用了巢式逆转录聚合酶链反应, 通过第一阶段PCR为第二阶段反应探索了条件, 同时也提高了产物的特异性. 结果表明, 正常大鼠gp96 mRNA检出率仅为1/6(16.67%),变性组为20/22(90.91%), 癌前组该基因的检出率已达100%, 与正常鼠比较均有统计学意义(P<0.05). gp96以癌基因的角色参与HCC的发生发展[10].
本研究肝癌模型中, 随着肝细胞癌变的发生, gp96逐渐升高, 虽正常肝组织也有gp96表达, 但癌变肝组织明显过表达, 且在变性组gp96水平已明显上调, 提示gp96表达增高是肝细胞癌变过程中的早期事件.
化学诱癌是一个多阶段过程, 其根本原因在于致癌物诱导的原癌基因的激活和抑癌基因的失活, 可使调控发生异常改变[11]. 正常细胞中HSP90是受细胞周期调控的, 但在肿瘤细胞中HSP90呈持续的高诱导表达不需要应激, 突变的或不正常的蛋白质的存在刺激HSP90的合成[12]. gp96为HSP90家族成员, 推测由于致癌剂对肝细胞的毒性作用, 使某些基因发生突变引起的, 刺激gp96表达, 通过gp96的抑制凋亡作用保护细胞促进恶性转化. 肿瘤细胞是增殖旺盛的永生化细胞, 需要更多gp96充当分子伴侣来协助HCC发生发展中相关分子功能的执行. 因此gp96的升高可能是致癌物作用下gp96促进肿瘤发生的结果[13]. 本文中变性组gp96开始上调, 提示gp96可用于HCC的早期诊断[14].
本文以肝癌模型从基因水平观察肝细胞癌变过程中gp96的动态改变, 肝癌发生过程中变性组gp96 mRNA开始增高, 癌变组中gp96过表达, 提示gp96参与HCC的发生. 对高危人群动态监测gp96的变化既有利于HCC的早期诊断, 又可用于判断患者的病情变化指导临床用药和预后评估.
肝癌(HCC)防治是全世界的医学难题, 正常肝细胞发生癌变是一个多病因、多步骤及多因子协同的复杂过程. 晚期HCC切除后复发率高, 易转移, 所以早期诊断、早期治疗显得尤为重要. HSPgp96由于其独特的分子伴侣功能, 在细胞周期调节、DNA损伤的控制、基因产物的代谢和癌变方面起着重要的作用.
近年发现HSPs与肿瘤发生、发展、生物学行为及其预后有较密切的关系, 与肿瘤增殖实验结果证实, 热休克蛋白与肿瘤增殖存在一定关系, 但在肝细胞性肝癌组织中的表达情况至今尚未见详细报道.
1 成功地制作肝癌动态研究模型, 以最先进的基因芯片技术发现在肝癌发生过程中鼠肝基因表达谱改变情况. 2 以自行设计的巢式RT-PCR法, 对大鼠肝组织中的gp96基因片段进行扩增, 方法检出的最低灵敏度是2 ng/L.
探讨肝细胞癌变过程中基因表达谱的动态变化, 对癌变过程相关基因HSPgp96 mRNA表达状态进行分析, 建立新的既方便, 又易推广, 灵敏度高的肝癌标志物用于肝癌的早期诊断、肝癌发生高危人群的普查、术后肝癌复发或远处转移的监测.
本文所有技术先进, 方法成熟, 有一定的科学性.
编辑: 程剑侠 电编 郭海丽
| 1. | Thorgeirsson SS, Grisham JW. Molecular pathogenesis of human hepatocellular carcinoma. Nat Genet. 2002;31:339-346. [PubMed] |
| 2. | Hartl FU, Hayer-Hartl M. Molecular chaperones in the cytosol: from nascent chain to folded protein. Science. 2002;295:1852-1858. [PubMed] |
| 3. | Ciocca DR, Calderwood SK. Heat shock proteins in cancer: diagnostic, prognostic, predictive, and treatment implications. Cell Stress Chaperones. 2005;10:86-103. [PubMed] |
| 4. | Schueller G, Kettenbach J, Sedivy R, Stift A, Friedl J, Gnant M, Lammer J. Heat shock protein expression induced by percutaneous radiofrequency ablation of hepatocellular carcinoma in vivo. Int J Oncol. 2004;24:609-613. [PubMed] |
| 5. | Jolly C, Morimoto RI. Role of the heat shock response and molecular chaperones in oncogenesis and cell death. J Natl Cancer Inst. 2000;92:1564-1572. [PubMed] |
| 6. | Robert J. Evolution of heat shock protein and immunity. Dev Comp Immunol. 2003;27:449-464. [PubMed] |
| 7. | Fujiyama S, Tanaka M, Maeda S, Ashihara H, Hirata R, Tomita K. Tumor markers in early diagnosis, follow-up and management of patients with hepatocellular carcinoma. Oncology. 2002;62 Suppl 1:57-63. [PubMed] |
| 8. | Chuma M, Sakamoto M, Yamazaki K, Ohta T, Ohki M, Asaka M, Hirohashi S. Expression profiling in multistage hepatocarcinogenesis: identification of HSP70 as a molecular marker of early hepatocellular carcinoma. Hepatology. 2003;37:198-207. [PubMed] |
| 9. | Tanaka K, Kondoh N, Shuda M, Matsubara O, Imazeki N, Ryo A, Wakatsuki T, Hada A, Goseki N, Igari T. Enhanced expression of mRNAs of antisecretory factor-1, gp96, DAD1 and CDC34 in human hepatocellular carcinomas. Biochim Biophys Acta. 2001;1536:1-12. [PubMed] |
| 10. | Isaacs JS, Xu W, Neckers L. Heat shock protein 90 as a molecular target for cancer therapeutics. Cancer Cell. 2003;3:213-217. [PubMed] |
| 11. | Srivastava PK. Immunotherapy for human cancer using heat shock protein-peptide complexes. Curr Oncol Rep. 2005;7:104-108. [PubMed] |
| 12. | Lim SO, Park SG, Yoo JH, Park YM, Kim HJ, Jang KT, Cho JW, Yoo BC, Jung GH, Park CK. Expression of heat shock proteins (HSP27, HSP60, HSP70, HSP90, GRP78, GRP94) in hepatitis B virus-related hepatocellular carcinomas and dysplastic nodules. World J Gastroenterol. 2005;11:2072-2079. [PubMed] |
| 13. | Zhu XD, Li CL, Lang ZW, Gao GF, Tien P. Significant correlation between expression level of HSP gp96 and progression of hepatitis B virus induced diseases. World J Gastroenterol. 2004;10:1141-1145. [PubMed] |
| 14. | Yao DF, Wu XH, Su XQ, Yao M, Wu W, Qiu LW, Zou L, Meng XY. Abnormal expression of HSP gp96 associated with HBV replication in human hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2006;5:381-386. [PubMed] |