修回日期: 2007-12-26
接受日期: 2007-12-28
在线出版日期: 2008-01-08
目的: 探讨丹皮酚(paeonol, Pae)对人大肠癌HT-29细胞的增殖抑制、凋亡诱导作用及可能的作用机制.
方法: 应用MTT法、荧光显微镜及透射电镜技术、TUNEL法和流式细胞仪技术观察不同浓度的Pae对HT-29细胞增殖的抑制及凋亡的诱导作用; 应用免疫细胞化学技术检测用药前后凋亡相关基因Bcl-2, Bax及P53表达的变化.
结果: HT-29细胞经Pae(浓度范围7.81-250 mg/L)作用后细胞生长明显受到抑制, 呈明显的剂量依赖效应关系和时间依赖效应关系; 荧光显微镜及透射电镜观察到Pae作用后HT-29细胞出现典型的细胞凋亡形态; Pae在15.63, 62.5, 250 mg/L 3种浓度下作用48 h均可诱导HT-29细胞凋亡, TUNEL法显示凋亡指数与Pae浓度呈正相依赖关系; 流式细胞仪技术检测其凋亡率分别为7.6%, 16.2%和34.5%, 也有明显的剂量效应关系, 同时Pae使细胞周期分布发生明显变化, 表现为S期细胞比例上升, G0/G1期和G2/M期细胞比例下降; 免疫细胞化学结果显示Pae作用后HT-29细胞Bcl-2及P53蛋白表达显著降低, Bax蛋白表达无显著改变.
结论: Pae能抑制HT-29细胞增殖并诱导其凋亡, 呈现明显的剂量依赖效应关系和时间依赖效应关系. 其作用可能与影响癌细胞的细胞周期、下调Bcl-2/Bax的比例及P53蛋白的表达有关.
引文著录: 计春燕, 谭诗云, 刘长青. 丹皮酚对人大肠癌HT-29细胞增殖、凋亡的影响及其分子机制. 世界华人消化杂志 2008; 16(1): 33-38
Revised: December 26, 2007
Accepted: December 28, 2007
Published online: January 8, 2008
AIM: To investigate the effects of paeonol in inhibiting proliferation of human colorectal cancer cell line HT-29 and inducing their apoptosis, and the possible molecular mechanisms involved.
METHODS: The inhibitory effect of paeonol on HT-29 cell proliferation was detected by MTT assay. Induction of apoptosis of HT-29 cells was measured by fluorescence microscopy, transmission electron microscopy, TUNEL assay and flow cytometry (FCM). Expression of apoptosis-associated genes bcl-2, bax and P53 was observed by immunocytochemical staining.
RESULTS: Paeonol at a concentration of 7.81-250 mg/L inhibited the proliferation of HT-29 cells, with obvious concentration-and time-effect relationships. Typical apoptosis morphology of HT-29 cells was observed by fluorescence and transmission electron microscopy after treatment with paeonol. Paeonol induced apoptosis of HT-29 cells when it was applied at a concentration of 15.63, 62.5 or 250 mg/L after 48 h. TUNEL assay showed a concentration-effect relationship between paeonol and apoptosis index. By FCM, the apoptosis rate of HT-29 cells was 7.6%, 16.2% and 34.5% respectively, which showed an obvious concentration-effect relationship. Cell cycle distribution was altered simultaneously. The S phase of the cells was increased, while the G0/G1 and G2/M phases were decreased after treatment with paeonol. Immunocytochemical staining showed that the expression of Bcl-2 and p53 was decreased significantly, while the expression of Bax protein was not significantly altered by paeonol.
CONCLUSION: Paeonol inhibits HT-29 cell proliferation and induces apoptosis. This may be mediated via changes in the cell cycle, down-regulation of the Bcl-2/Bax ratio, and expression of p53 protein.
- Citation: Ji CY, Tan SY, Liu CQ. Effects of paeonol on apoptosis and proliferation of HT-29 cells and its molecular mechanism. Shijie Huaren Xiaohua Zazhi 2008; 16(1): 33-38
- URL: https://www.wjgnet.com/1009-3079/full/v16/i1/33.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i1.33
化疗药物的耐药及其毒副作用一直是大肠癌治疗的两大难题, 在植物中寻找有效且副作用小的抗肿瘤药物已成为国内外重要的研究课题. 研究表明, 丹皮酚(paeonol, Pae)具有一定的抗肿瘤活性, 在体外对多种肿瘤细胞株有增殖抑制作用, 灌胃给药有抗小鼠肝肿瘤作用[1]. 但Pae对大肠癌的增殖抑制、凋亡诱导作用及其对凋亡相关基因表达的影响在国内外还未见报道. 我们旨在通过MTT法、荧光显微镜及透射电镜技术、DNA末端原位标记染色(TUNEL)法及流式细胞仪技术研究Pae在体外对大肠癌HT-29细胞的增殖抑制及凋亡诱导作用, 通过免疫细胞化学技术检测用药前后凋亡相关基因Bcl-2、Bax及P53表达的变化, 以探索Pae对大肠癌细胞杀伤作用的可能机制, 为Pae的临床应用提供理论和实验依据.
人大肠癌HT-29细胞株购自中南大学肿瘤研究所. Pae购自上海第一制药厂(5 g/L), 用RPMI1640培养液稀释成终浓度为3.91-250 mg/L(临用前); RPMI 1640培养基(美国Gibco公司); 小牛血清(杭州四季青生物材料研究所); 四噻唑蓝(MTT)、丫啶橙(AO)、溴化乙啶(EB)(美国Sigma公司)均用pH为7.4的的PBS溶解, 过滤除菌, 置棕色小瓶中4℃冰箱保存; 二甲基亚砜(DMSO)(Sigma公司); TUNEL试剂盒、鼠抗Bcl-2、Bax和P53 mAb及SP试剂盒(北京中山生物技术有限公司). CO2培养箱(美国HARIS公司); 酶标仪(美国BIO-TEK公司); 医用超净工作台(北京半导体设备一厂); 流式细胞仪(美国贝克曼库尔特公司); 低温高速离心机(Heraeus); 倒置显微镜及荧光显微镜(日本Olympus公司).
将HT-29细胞培养在含100 mL/L小牛血清的RPMI 1640培养液中, 加入青霉素100 U/L、链霉素100 mg/L, 置37℃、50 mL/L CO2培养箱内培养, 每3-4 d用2.5 g/L胰酶消化传代一次, 取对数生长期细胞用于实验.
1.2.1 Pae抑制细胞增殖: MTT法参照文献[2]取对数生长期的HT-29细胞以5×107/L, 每孔0.2 mL, 接种于96孔培养板中, 24 h细胞贴壁生长后分为实验组和对照组, 实验组分别加入不同浓度的Pae(浓度分别为3.91, 7.81, 15.63, 31.25, 62.5, 125, 250 mg/L), 每组设5个复孔, 对照组加入等量培养液. 连续培养24, 48, 72, 96 h, 根据细胞生长情况, 每天换液1次, 分别于24, 48, 72及96 h每次实验结束前4 h每孔加入20 μL MTT液(5 g/L)显色, 继续培养4 h, 弃上清液, 然后每孔加200 μL DMSO, 振荡10 min, 用酶标仪测定570 nm处各孔的吸光度值. 药物对细胞增殖抑制率的计算方法为: 抑制率 = (1-实验组平均A值/对照组平均A值)×100%.
1.2.2 Pae诱导细胞凋亡: 倒置显微镜下观察, 取对数生长期HT-29细胞消化传代并延续培养24 h后换含不同浓度Pae的培养液培养, 倒置显微镜下连续性动态观察细胞生长情况.
HE染色: 将细胞涂片用冷丙酮4℃固定20 min, 自然凉干, 水化后用5 mg/L TritonX-100 PBS处理10 min, 水化后Gill苏木精染2 min, 10 mL/L盐酸乙醇1 s, 42℃温水蓝化10 min, 伊红染2 s, 常规脱水封片后光镜下观察形态学变化.
AO/EB双荧光染色法[3]: 将HT-29细胞以108/L, 共3 mL铺入培养瓶中, 37℃孵育, 待细胞贴壁生长. 另加各浓度Pae(15.63, 62.5, 250 mg/L)3 mL, 孵育48 h. 洗下瓶内细胞制成单细胞悬液, 加入终浓度均为100 mg/L的AO和EB, 充分混匀, 取细胞悬液4 μL滴于玻片上, 在荧光显微镜下观察、拍照.
透射电镜观察: 于实验及对照组细胞培养瓶中加入25 g/L戊二醛, 置4℃冰箱中过夜, 用细胞刮轻刮细胞, 离心, 10 g/L锇酸固定, 常规包埋, 制成超薄切片, 电镜下观察细胞超微结构的特征.
TUNEL法检测细胞凋亡: HT-29细胞按108/L密度接种于预先置有消毒盖玻片的6孔培养板中, 待其贴壁后加入各浓度Pae(15.63, 62.5, 250 mg/L), 对照组加入等量培养液, 48 h后取出盖玻片, 40 g/L多聚甲醛固定, PBS洗涤, 30 mL/L过氧化氢-甲醛处理, 预冷的1 mg/L TritonX-100处理, PBS洗涤, 其余步骤严格按试剂盒说明进行. 光镜下观测、凋亡细胞计数, 并计算凋亡指数 (apoptosis index, AI). AI计算方法为: 在光镜下, 胞核染色呈棕褐色的细胞被判为凋亡细胞, 随机选取5个高倍镜(×200)视野, 每个视野计数200个细胞, 分别计数凋亡细胞数和总细胞数. AI = 凋亡细胞数/总细胞数×100%.
流式细胞仪检测细胞周期: 消化收集各实验组(Pae浓度分别为15.63, 62.5, 250 mg/L)及对照组培养48 h的细胞, 1000 r/min离心5 min, PBS漂洗, 200目滤网过滤, 调整单细胞悬液浓度为1×109/L. 700 mL/L预冷乙醇固定, 加入RNase及PI染色30 min, 上机检测细胞周期.
1.2.3 凋亡相关基因Bcl-2, Bax及P53的检测: 细胞爬片及实验分组方法同TUNEL法, 48 h后倒去孔内培养液, PBS洗2次, 每次3 min; 体积分数为950 mL/L乙醇固定15-30 min; PBS洗2-3次; 将爬片置于湿盒内, 滴加一抗(Bcl-2, Bax及P53抗体), 37℃孵育箱中孵育30-60 min; PBS洗2-3次, 每次3 min; 其余步骤按SP试剂盒操作说明进行. 判断结果: 每张玻片在40×10高倍显微镜下观察, 细胞染色呈棕褐色被判为阳性细胞,不染为阴性细胞. 凋亡相关基因蛋白Bcl-2, Bax及其免疫反应阳性物质定位于胞质和胞膜, P53阳性物质定位于胞核. 每个视野下分别计算: 表达率(%) = (阳性细胞数/细胞总数)×100%, 每张涂片观察5个视野.
统计学处理 使用SPSS10.0统计软件. 实验数据以mean±SD表示, 完全随机分组实验所得数据的计量资料采用方差分析、t检验, 完全随机分组实验所得数据的计数资料和率的比较采用χ2检验.
Pae在7.81-250 mg/L浓度范围内对HT-29细胞的增殖均有抑制作用, 药物浓度越高, 作用时间越长, 其抑制作用越强, 呈现明显的剂量依赖效应关系和时间依赖效应关系(表1).
| Pae(mg/L) | 24 h | 48 h | 72 h | 96 h | ||||
| A值 | 抑制率(%) | A值 | 抑制率(%) | A值 | 抑制率(%) | A值 | 抑制率(%) | |
| 0 | 0.859±0.028 | - | 1.073±0.021 | - | 1.388±0.024 | - | 1.595±0.019 | - |
| 3.91 | 0.817±0.024 | 4.889 | 1.041±0.031 | 2.982 | 1.341±0.033 | 3.386 | 1.457±0.024a | 8.652 |
| 7.81 | 0.751±0.030b | 12.573 | 0.871±0.013b | 18.826 | 1.084±0.025b | 21.902 | 1.026±0.014b | 35.673 |
| 15.63 | 0.599±0.023b | 30.325 | 0.575±0.026b | 46.412 | 0.570±0.017b | 58.934 | 0.497±0.031b | 68.840 |
| 31.25 | 0.439±0.016b | 48.803 | 0.423±0.018b | 60.578 | 0.386±0.030b | 72.190 | 0.323±0.018b | 79.749 |
| 62.5 | 0.329±0.025b | 61.622 | 0.317±0.014b | 70.456 | 0.305±0.023b | 78.025 | 0.278±0.024b | 82.571 |
| 125 | 0.252±0.014b | 70.676 | 0.227±0.025b | 78.844 | 0.201±0.014b | 85.518 | 0.167±0.016b | 89.529 |
| 250 | 0.225±0.025b | 73.806 | 0.202±0.016b | 81.174 | 0.171±0.019b | 87.680 | 0.130±0.025b | 91.849 |
倒置显微镜下观察: 对照组细胞生长旺盛, 呈高折光率, 胞体大, 随时间延长变化不大. Pae组细胞增殖减慢, 随着药物浓度增大和时间延长, 细胞逐渐变小、折光率减弱, 部分脱落漂浮于培养瓶中, 但细胞膜完整, 最后裂解. Pae浓度越高, 作用时间越长, 上述表现越明显, 漂浮细胞越多. 250 mg/L Pae组除见少数圆形细胞外,可见大量悬浮的细胞碎片.
HE染色: 对照组正常细胞核均匀着色呈淡蓝色或蓝色, 未见凋亡小体. 31.25-250 mg/L浓度范围Pae组出现较多的细胞凋亡, 表现为细胞体积缩小、核固缩、碎裂、深染, 部分裂解形成凋亡小体. 另可见肿胀的坏死细胞, 细胞膜的连续性破坏, 核染成很淡的蓝色甚至蓝色消失.
AO/EB双荧光染色法: 经不同浓度Pae处理48 h后, 大肠癌细胞表现出凋亡细胞的特征性形态变化: 细胞体积缩小, 胞核固缩染色质凝聚、破裂, 核断裂形成凋亡小体等, 部分细胞被染成橘红色, 以250 mg/L Pae组最为明显. 而对照组细胞大小及形态较一致, 胞核较大, 为黄绿色, 形态正常.
透射电镜下表现: 实验组凋亡细胞体积变小, 胞质浓缩, 胞质内空泡增多, 染色质固缩、边集或碎裂成不规则块状, 细胞器保存较好, 核膜完整, 还可见有膜包裹且细胞器完整、有细胞核碎片的凋亡小体.
TUNEL法: 光镜下观察到实验组凋亡细胞的棕褐色染色颗粒定位于细胞核内, 染色阳性的细胞出现细胞核碎裂, 核质固缩, 细胞膜突出形成质膜小泡等凋亡细胞形态学变化. 经Pae处理48 h, 大肠癌细胞株HT-29的凋亡细胞数明显增加, Pae在15.63, 62.5, 250 mg/L 3种浓度浓度下的AI值分别为8.16±2.24%、15.35±3.07%、23.70±3.42%, 对照组为3.32±0.41%, 差异均有显著性(P<0.01), 且AI与Pae浓度呈正相依赖关系.
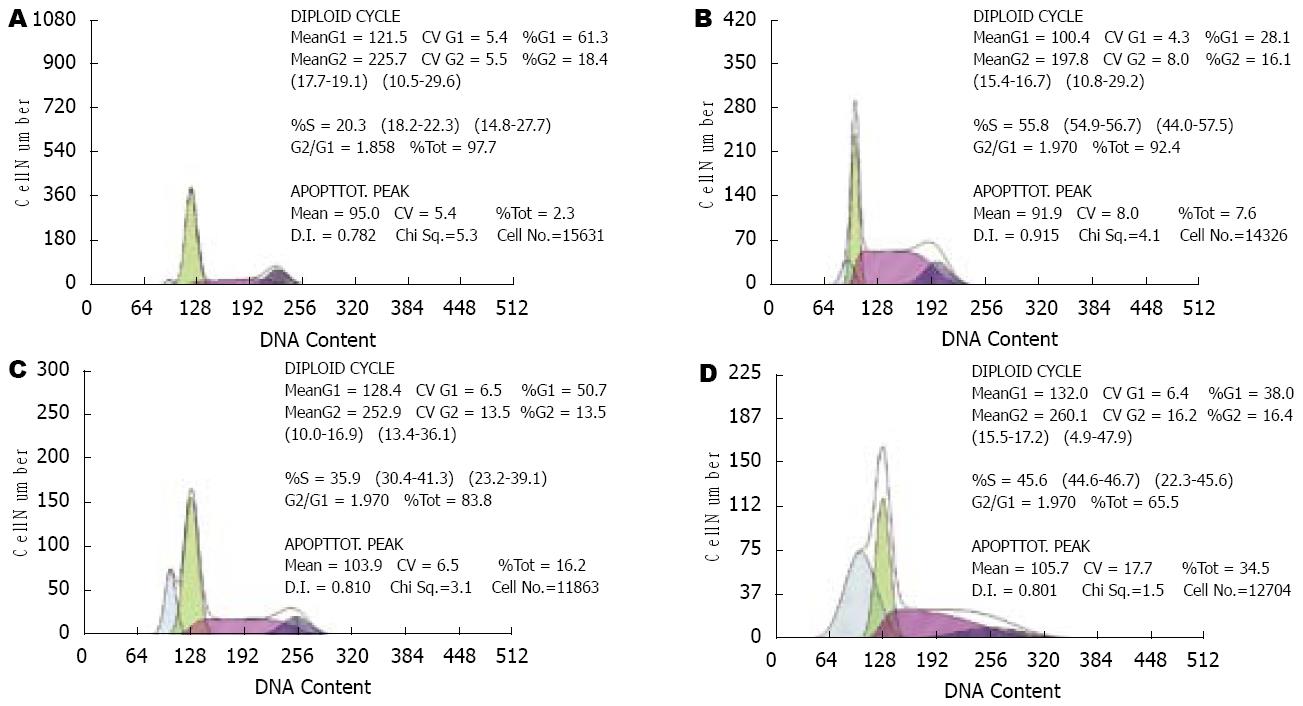
流式细胞仪检测: 不同浓度的Pae作用于HT-29细胞48 h后, 细胞周期分布发生明显改变, 表现为S期细胞比例上升, G0/G1期和G2/M期细胞比例下降(表2), 并出现明显的凋亡峰(图1). 对照组显示HT-29细胞的自然凋亡率仅2.3%. 两组结果相比差异均有显著性(P<0.05).
Bcl-2蛋白表达: 对照组的Bcl-2蛋白表达水平最高, 胞质染色细胞数最多并且呈深棕色, Pae组细胞Bcl-2表达均有下降, 染色阳性细胞减少, 染色明显变浅, 且与药物浓度呈反比关系, 各组结果与对照组相比均具有显著性差异(P<0.01).
Bax蛋白表达: 阳性细胞胞质、胞膜染成深棕色. Pae组染色阳性细胞数及染色程度与对照组相比无显著性差异(P>0.05).
P53蛋白表达: 阳性细胞胞核染成深棕色, Pae组细胞胞核染色细胞数减少, 且与药物浓度呈反比关系, 各组结果与对照组相比有显著性差异(P<0.01)(表3).
研究结果表明, Pae具有镇静催眠、解热镇痛、抗菌消炎、免疫调节、抗氧化及保护心脑血管等广泛的药理活性[4-5]. 本实验研究发现, Pae在7.81-250 mg/L 6个浓度下, 对HT-29细胞株的增殖均有抑制作用, 随着药物浓度的升高和作用时间的延长, 抑制细胞增殖的作用逐步增强, 呈现明显的剂量效应及时间效应关系, 提示Pae具有一定的抗肿瘤活性.
细胞增殖过盛及通过抑制凋亡促进肿瘤细胞存活被认为是肿瘤发生、发展的关键[6]. 众多研究已表明, 细胞凋亡的减少与大肠癌的发生、发展相关. 抗肿瘤药物对肿瘤细胞作用的结果有多种,如细胞增殖抑制、分化、凋亡和坏死. 多种化疗药物均可引起肿瘤细胞凋亡[7]. 通过诱导凋亡治疗肿瘤是目前的一个热点[8]. 本实验中Pae作用于大肠癌HT-29细胞, 通过光镜HE染色及荧光显微镜、透射电镜均可观察到典型的凋亡细胞形态学改变. TUNEL法发现经Pae处理后大肠癌细胞的凋亡指数显著提高, 且与Pae呈剂量依赖关系. 流式细胞仪发现HT-29细胞经Pae作用后出现了明显的凋亡峰, 250 mg/L Pae诱导细胞凋亡率达到34.5%, 与对照组显示的自然凋亡率(2.3%)相比有显著性差异(P<0.01). 细胞周期分布也发生了明显变化, 表现为S期细胞比例上升, G0/G1期和G2/M期细胞比例下降, 表明Pae对HT-29细胞周期分布的影响主要是阻滞细胞周期中S期向G2/M期的转变过程, 减少有丝分裂, 并引起细胞凋亡. 证实Pae作用于大肠癌HT-29细胞的作用机制与诱导该细胞株凋亡及影响其细胞周期分布有关. 同时提示Pae在应用时若能同时合用对S期敏感的药物可能有助于提高抗肿瘤的疗效.
凋亡的过程是程序化的、多基因调控的. 通过研究其分子调控机制, 将对有计划地诱导肿瘤细胞凋亡产生重要的指导作用[9]. 与细胞凋亡相关的基因大致有Bcl-2家族、P53、Fas、c-myc和k-ras等, 细胞是否进入凋亡通道取决于这些凋亡相关基因的综合调控结果, 其中Bcl-2是凋亡调控的中心环节. 在生理和病理状态下, Bcl-2基因及其蛋白产物都是重要的凋亡调节因素. 体外实验表明: 当去除了生长因子后, 正常细胞便逐渐转向凋亡; 而当Bcl-2过度表达时, 这一凋亡现象便被抑制了[10]. 由此可见, Bcl-2通过抑制诱导凋亡而使细胞寿命延长, 细胞堆积, 在肿瘤发生中起始动作用. Bax基因是转录产物αRNA编码的一种21 kDa蛋白质, 是近年来新发现的一种凋亡促进基因, 属Bcl-2同一家族[11]. Bax蛋白的氨基酸序列有21%与Bcl-2同源. Bax基因的作用与Bcl-2相反, 其单体以及形成Bax/Bax形式的同源二聚体均有促凋亡作用. Bax又可与Bcl-2形成异源二聚体, 抑制后者的功能达到促进凋亡. 近期研究表明, Bcl-2家族中促凋亡和抗凋亡蛋白之间的平衡在调节促凋亡因子c-Myc从线粒体的释放起着重要的作用[12]. Bcl-2/Bax两蛋白之间的比例是细胞凋亡发生与否的关键因素[13]. 本实验发现, Pae能明显下调大肠癌HT-29细胞Bcl-2基因的表达(P<0.01), 而Bax在Pae作用后与对照组相比表达率无明显差异(P>0.05), 故可认为经Pae作用后是通过Bcl-2/Bax比例的下降, 从而诱导大肠癌细胞的凋亡.
此外, Bcl-2可改变P53和cdc2及cdk2等细胞周期蛋白的核-胞质转运. 实验表明Bcl-2与P53的共表达可以延缓P53诱导的生长停滞, Bcl-2还可和c-Myc协同封闭P53进入核中, 从而阻断P53诱导的凋亡和生长停滞. 有研究表明P53直接下调Bcl-2基因的表达, 而Bcl-2能抑制P53介导的细胞凋亡, 表明P53和Bcl-2共同参与调节细胞的生存和死亡[14-16]. 该基因发生突变后则具有促癌作用, 突变型P53蛋白在细胞内积聚促进细胞转化和增殖, 上调COX-2的表达, 导致肿瘤发生. 野生型P53蛋白由于其半衰期短, 代谢不稳定及含量低, 故常规免疫组化难以检测到; 而突变型P53蛋白构象改变, 半衰期明显延长(>24 h), 在恶性细胞的核内堆积, 可通过该法检出. 因此在本研究中检测出的P53蛋白多为突变型P53基因的表达产物. Pae作用于大肠癌细胞48 h后, P53及Bcl-2基因的表达与对照组相比均明显降低(P<0.01), 提示Pae同时下调P53及Bcl-2基因的表达可能是其诱导HT-29细胞凋亡的机制之一.
总之, 本实验研究发现中药Pae在一定的浓度范围内能显著抑制人大肠癌HT-29细胞的增殖并诱导其发生凋亡, 具体机制可能与Pae影响HT-29细胞的细胞周期分布、下调Bcl-2/Bax的比例及P53基因的表达有关.
化疗药物的耐药及其毒副作用一直是大肠癌治疗的两大难题, 在植物中寻找有效且副作用小的抗肿瘤药物已成为国内外重要的研究课题.
研究表明, 丹皮酚(Pae)具有一定的抗肿瘤活性, 在体外对多种肿瘤细胞株增殖有抑制作用, 但对大肠癌的增殖抑制、凋亡诱导作用及其对凋亡相关基因表达的影响在国内外还未见报道.
丹皮酚作用于大肠癌HT-29细胞的作用机制与诱导该细胞株凋亡, 及影响其细胞周期分布有关, 同时提示Pae在应用时若能合用对S期敏感的药物可能有助于提高抗肿瘤的疗效.
探索丹皮酚对大肠癌细胞杀伤作用的可能机制, 为Pae的临床应用提供理论和实验依据, 给大肠癌的治疗开辟一条新途径.
本文立题较新, 层次分明, 方法合理, 具有一定的临床指导价值.
编辑: 李军亮 电编:吴鹏朕
| 2. | Keepers YP, Pizao PE, Peters GJ, van Ark-Otte J, Winograd B, Pinedo HM. Comparison of the sulforhodamine B protein and tetrazolium (MTT) assays for in vitro chemosensitivity testing. Eur J Cancer. 1991;27:897-900. [PubMed] |
| 3. | Wang C, Eshleman J, Lutterbaugh J, Bin Y, Willson J, Markowitz S. Spontaneous apoptosis in human colon tumor cell lines and the relation of wt p53 to apoptosis. Chin Med J (Engl). 1996;109:537-541. [PubMed] |
| 5. | Chang HL, Hung CF, Yeh CC, Chang WC, Chung JG. Paeonol promoted 2-aminofluorene and p-aminobenzoic acid acetylations by mononuclear leucocytes from Sprague-Dawley rats. Cytobios. 2000;103:149-158. [PubMed] |
| 6. | Khor TO, Gul YA, Ithnin H, Seow HF. Positive correlation between overexpression of phospho-BAD with phosphorylated Akt at serine 473 but not threonine 308 in colorectal carcinoma. Cancer Lett. 2004;210:139-150. [PubMed] |
| 7. | Cotter TG, Glynn JM, Echeverri F, Green DR. The induction of apoptosis by chemotherapeutic agents occurs in all phases of the cell cycle. Anticancer Res. 1992;12:773-779. [PubMed] |
| 8. | Dong JT, Luo XM. Effects of arsenic on DNA damage and repair in human fetal lung fibroblasts. Mutat Res. 1994;315:11-15. [PubMed] |
| 9. | Lu QL, Poulsom R, Wong L, Hanby AM. Bcl-2 expression in adult and embryonic non-haematopoietic tissues. J Pathol. 1993;169:431-437. [PubMed] |
| 10. | Garcia I, Martinou I, Tsujimoto Y, Martinou JC. Prevention of programmed cell death of sympathetic neurons by the bcl-2 proto-oncogene. Science. 1992;258:302-304. [PubMed] |
| 11. | Adams JM, Cory S. The Bcl-2 protein family: arbiters of cell survival. Science. 1998;281:1322-1326. [PubMed] |
| 12. | Tuynman JB, Peppelenbosch MP, Richel DJ. COX-2 inhibition as a tool to treat and prevent colorectal cancer. Crit Rev Oncol Hematol. 2004;52:81-101. [PubMed] |
| 13. | Rosse T, Olivier R, Monney L, Rager M, Conus S, Fellay I, Jansen B, Borner C. Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c. Nature. 1998;391:496-499. [PubMed] |
| 14. | Mosnier JF, Perret AG, Vindimian M, Dumollard JM, Balique JG, Perpoint B, Boucheron S. An immunohistochemical study of the simultaneous expression of bcl-2 and p53 oncoproteins in epithelial tumors of the colon and rectum. Arch Pathol Lab Med. 1996;120:654-659. [PubMed] |
| 15. | Smith DR, Ji CY, Goh HS. Prognostic significance of p53 overexpression and mutation in colorectal adenocarcinomas. Br J Cancer. 1996;74:216-223. [PubMed] |
| 16. | Basolo F, Pollina L, Fontanini G, Fiore L, Pacini F, Baldanzi A. Apoptosis and proliferation in thyroid carcinoma: correlation with bcl-2 and p53 protein expression. Br J Cancer. 1997;75:537-541. [PubMed] |